黑树莓多酚对糖尿病小鼠血糖代谢的调控作用及机制研究
2021-09-06陈丽莉牛晓琪毕秀丽
陈丽莉,刘 月,牛晓琪,刘 威,毕秀丽
黑树莓多酚对糖尿病小鼠血糖代谢的调控作用及机制研究
陈丽莉,刘 月,牛晓琪,刘 威,毕秀丽*
辽宁大学生命科学院,辽宁 沈阳 110036
探究黑树莓多酚对糖尿病小鼠血糖代谢的调控作用及其作用机制。方法 分别以链脲佐菌素和四氧嘧啶诱导小鼠建立糖尿病模型,给予含黑树莓多酚的饲料喂养,检测各组小鼠血糖;采用试剂盒检测各组小鼠血清中三酰甘油(triglyceride,TG)和总胆固醇(cholesterol,CHO)水平;考察黑树莓多酚对糖尿病小鼠脏器指数的影响;采用qRT-PCR法考察黑树莓多酚对糖尿病小鼠肝脏中白细胞介素-1(interleukin-1,)、、环氧合酶2(cyclooxygenase 2,)和肿瘤坏死因子-α(tumor necrosis factor-α,)mRNA和骨骼肌中葡萄糖转运蛋白4(glucose transporter 4,)和AMP激活蛋白激酶α1(AMP-activated protein kinase α1,)mRNA表达的影响;采用Western blotting法检测黑树莓多酚对糖尿病小鼠骨骼肌中胰岛素信号通路相关蛋白表达的影响。黑树莓多酚显著降低链脲佐菌素和四氧嘧啶诱导的糖尿病小鼠空腹血糖和糖耐量(<0.05、0.01),显著降低四氧嘧啶诱导的糖尿病小鼠血清中TG和CHO水平(<0.05),显著降低四氧嘧啶诱导的糖尿病小鼠肾脏指数(<0.05),显著降低四氧嘧啶诱导的糖尿病小鼠肝脏中、、和mRNA表达水平(<0.05、0.01);显著上调链脲佐菌素诱导的糖尿病小鼠骨骼肌中磷酸化胰岛素受体底物(phosphorylated insulin receptor substrate,p-IRS)、胰岛素受体(insulin receptor,IR)、磷酸化IR(p-IR)和磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)蛋白表达水平(<0.05、0.01),显著上调骨骼肌mRNA表达水平(<0.05);显著上调四氧嘧啶诱导的糖尿病小鼠骨骼肌中p-IRS、IR、p-IR和糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)蛋白表达水平(<0.05),显著上调骨骼肌及mRNA表达水平(<0.05、0.01)。黑树莓多酚可以通过激活胰岛素信号通路并促进葡萄糖代谢,从而缓解链脲佐菌素以及四氧嘧啶诱导的糖尿病小鼠中血糖代谢紊乱引发的相关症状。
黑树莓多酚;糖尿病;葡萄糖耐量;血脂;脏器指数;胰岛素信号通路
糖尿病是一种全球常见的危及生命的代谢性疾病,其特征为由胰岛素抵抗或胰岛素分泌下降引起的高血糖。糖尿病的发病率逐年增加,国际糖尿病联合会预计至2035年将有5.92亿人患有糖尿病。因此,寻找有效的方法来预防和治疗糖尿病及其并发症极其重要[1]。现有的降糖类药物如胰岛素及化学制剂大多是针对某一特定类型的病症进行缓解,但可能产生一定的药物依赖性及不良反应[2]。植物活性提取物具有安全、不良反应小等优点,作为代替药物对于糖尿病的预防及辅助治疗有很大的研究意义。当前具有防治糖尿病作用的活性物质集中于多酚类、多糖类等化合物,其中多酚类化合物可通过加强细胞糖代谢达到降低血糖的作用[3-4],参与其中的信号通路主要有胰岛素受体信号通路、AMP激活蛋白激酶(AMP-activated protein kinase,AMPK)通路等[5]。
黑树莓H. Lévl.又名覆盆子、悬钩子等,为蔷薇科勾悬子属浆果,黑树莓中含有酚酸类、黄酮类、原花青素、鞣质、苯乙烯、木脂素、三萜和甾醇等大量多酚类活性物质[6]。本课题组前期研究发现,黑树莓花青素能够通过调节肠道菌群和分泌型卷曲相关蛋白2(secreted frizzled-related protein 2,SFRP2)去甲基化[7],还能够通过调控miR-24-1-5p、miR-483-3p/Dickkopf相关蛋白3(Dickkopf-related protein 3,DKK3)相关信号通路,从而预防结直肠癌[8-9]。在饮食诱导的肥胖啮齿动物模型中,含有黑树莓花青素的膳食补充剂不会减缓肥胖的发展[10];此外,关于黑树莓花青素对代谢综合征患者的血脂谱和血管内皮功能的最新研究,揭示了黑树莓多酚在血脂代谢相关疾病中的潜在用途[11]。但黑树莓活性成分尚未见血糖调控相关研究。本课题组前期研究表明,黑树莓提取物对体外α-糖苷酶和蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)活性有很好的抑制作用,表现出潜在的降血糖活性[12],提示黑树莓多酚对糖尿病可能具有调控作用。《本草通玄》中有“覆盆子,甘平入肾”之说;而中医在糖尿病尤其并发症的相关研究中,也一直认为其与肾息息相关。本研究考察了黑树莓多酚对链脲佐菌素(streptozotocin,STZ)或四氧嘧啶(allxan,AXN)诱导的糖尿病小鼠的作用及其机制,为黑树莓治疗糖尿病提供科学依据。
1 材料
1.1 动物
SPF级C57BL/6雄性小鼠,4周龄,体质量20 g,购自辽宁长生生物技术有限公司,动物合格证号SCXK(辽)-2014-0001。动物饲养于辽宁大学生命科学院实验动物中心,室内保持12 h明暗交替。动物实验遵循辽宁大学实验动物管理和使用的规定,符合3R原则。
1.2 黑树莓多酚饲料配制
黑树莓多酚(质量分数>90%)由天津尖峰天然产物有限公司提供。根据本课题组前期研究中5%、10%黑树莓冻干粉的小鼠喂食剂量,并结合黑树莓多酚的提取率[7,12-13],将黑树莓多酚混合进正常饲料中做成日粮,具体成分配比见表1。饲料由辽宁长生生物技术有限公司制作。
1.3 药品与试剂
STZ(批号S0130)、AXN(批号A7413)购自美国Sigma公司;活力型血糖仪及试纸(批号RSXTSZ)、SYBR Green PCR Master Mix试剂盒购自瑞士Roche公司;分析级氯仿、异丙醇、无水乙醇、HRP标记的抗小鼠IgG抗体、HRP标记的抗兔IgG抗体购自北京鼎国试剂公司;无RNA酶水(批号B541018)、RIPA裂解液(批号C500005)、BCA蛋白定量试剂盒(批号C503021)、β-tubulin抗体(批号D225847)购自上海生工生物有限公司;Trizol试剂(批号CW0580S)、qPCR逆转录试剂盒(批号RR047A)购自日本Takara公司;胰岛素受体(insulin receptor,IR)、磷酸化IR(p-IR)、磷酸化胰岛素受体底物(phosphorylated insulin receptor substrate,p-IRS)抗体、糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)抗体、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)抗体购自美国CST公司;三酰甘油(triglyceride,TG)、总胆固醇(cholesterol,CHO)试剂盒购自北京北华康泰试剂有限公司。

表1 饲料配方
1.4 仪器
7500HT型qRT-PCR仪(美国ABI公司);iMark酶标仪(美国Bio-Rad公司);高速冷冻离心机(美国Agilent公司);JY-SCZ2垂直电泳槽(北京君意东方电泳设备有限公司);−80 ℃超低温冰箱(日本Sanyo公司);Cary紫外可见光分光光度计(美国Varian公司)。
2 方法
2.1 造模、分组与给药
C57BL/6小鼠适应性饲养1周后,ip STZ溶液(50 mg/kg),每3天1次,共3次,建立STZ诱导的糖尿病小鼠模型;ip AXN溶液(50 mg/kg),每3天1次,共3次,建立AXN诱导的糖尿病小鼠模型。小鼠禁食16 h后,于尾端取静脉血1滴测其血糖值,选择血糖值为10~14并出现多饮、多食、多尿状况的小鼠作为实验性糖尿病模型。
2.1.1 STZ诱导的糖尿病小鼠分组与给药 设置对照组、模型组以及黑树莓多酚低、高剂量组,每组10只。对照组和模型组每日给予正常饲料喂养,各给药组给予相应饲料喂养,连续喂养8周。
2.1.2 AXN诱导的糖尿病小鼠分组与给药 设置对照组、模型组以及黑树莓多酚高剂量组,每组10只。对照组和模型组给予正常饲料,各给药组给予相应饲料,连续喂养4周。
2.2 黑树莓多酚对糖尿病小鼠糖耐量的影响
给药结束后,小鼠禁食16 h,检测其基础血糖值,ip葡萄糖溶液(10 μL/g),进行腹腔葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT),于5、15、30、60、120 min测定血糖值。根据血糖值绘制曲线,对药时曲线下面积(AUC)积分来评价黑树莓多酚对小鼠机体糖耐受的改善状况。
2.3 黑树莓多酚对糖尿病小鼠血脂水平的影响
给药结束后,采集小鼠眼球后静脉丛血液1 mL,室温静置30 min后,4 ℃、4000 r/min离心15 min,取血清,按照试剂盒说明书测定小鼠血清中TC和CHO水平。
2.4 黑树莓多酚对糖尿病小鼠脏器指数的影响
给药结束后,小鼠称定质量,脱颈椎处死,解剖取脾、肝、肾组织,称定质量并计算脏器指数。
脏器指数=脏器质量/小鼠体质量
2.5 黑树莓多酚对糖尿病小鼠肝脏组织白细胞介素-1(interleukin-1,IL-1)、IL-6、环氧合酶2(cyclooxygenase 2,COX2)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA表达的影响
取肝脏组织50 mg,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-AGGCAAACCGTGAAAA- GATG-3’,下游引物5’-AGGCAAACCGTGAAAAG- ATG-3’;上游引物5’-GCAACTGTTCCTGAAC- TCAACT-3’,下游引物5’-ATCTTTTGGGGTCCG- TCAACT-3’;上游引物5’-TAGTCCTTCCTAC- CCCAATTTCC-3’,下游引物5’-TTGGTCCTTAGC- CACTCCTTC-3’;上游引物5’-TGAGCAACT- ATTCCAAACCAGC-3’,下游引物5’-GCACGTAG- TCTTCGATCACTATC-3’;上游引物5’-CCCTCACACTCAGATCATCTTCT-3’,下游引物5’-GCTACGACGTGGGCTACAG-3’。
2.6 黑树莓多酚对糖尿病小鼠骨骼肌组织p-IRS、IR、p-IR、p-Akt和GSK3β蛋白表达的影响
骨骼肌组织用液氮磨碎成粉末状,尽快称取20 mg磨碎后组织,加入200 μL含蛋白酶抑制剂的RIPA裂解液,冰上裂解3 h,4 ℃、12 000 r/min离心15 min,取上清,采用BCA蛋白定量试剂盒测蛋白质量浓度,加入40 μL 5×Loading Buffer混匀后,95 ℃金属浴5 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛血清白蛋白溶液,于室温封闭3 h;分别加入p-IRS、IR、p-IR、p-Akt、GSK3β和β-tubulin抗体,孵育3 h;TBST洗涤3次,30 min/次,加入HRP标记的抗小鼠/兔IgG抗体,室温孵育2.5 h,加入ECL发光液显影。
2.7 黑树莓多酚对糖尿病小鼠骨骼肌组织葡萄糖转运蛋白4(glucose transporter 4,GLUT4)和AMPKα1 mRNA表达的影响
取骨骼肌组织50 mg,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-CTTGGCTCCCTTCAGT- TTGG-3’,下游引物5’-CTACCCAGCCACGTTGC- ATT-3’;上游引物5’-AAGCCGACCCAAT- GACATCA-3’,下游引物5’-CTTCCTTCGTACACG- CAAAT-3’;上游引物5’-AGGCAAACCGTG- AAAAGATG-3’,下游引物5’-AGGCAAACCGTGA- AAAGATG-3’。
2.8 统计学处理
采用SPSS 18.0软件分析数据,组间比较采用检验及方差分析。
3 结果
3.1 黑树莓多酚对糖尿病小鼠一般情况的影响
对照组小鼠状态良好,毛色有光泽,尿量正常,反应灵敏,动作敏捷;造模后第2天,模型组小鼠精神萎靡,扎堆蜷卧,活动量减少,被毛凌乱,饮水量和排尿量增加,尤其以AXN诱导的糖尿病小鼠模型更为明显。各给药组小鼠的皮毛光泽改善,排尿量减少。
3.2 黑树莓多酚对糖尿病小鼠空腹血糖的影响
如图1所示,STZ或AXN诱导的糖尿病模型小鼠血糖水平显著高于对照组(<0.01);与模型组比较,给予黑树莓多酚高剂量饲料第4周开始,STZ诱导的糖尿病小鼠血糖显著降低(<0.05、0.01),给予黑树莓多酚低剂量饲料第6周开始,STZ诱导的糖尿病小鼠血糖显著降低(<0.05);给予黑树莓多酚高剂量饲料第2周开始,AXN诱导的糖尿病小鼠血糖显著降低(<0.05、0.01)。
3.3 黑树莓多酚对糖尿病小鼠糖耐量的影响
如图2所示,STZ或AXN诱导的糖尿病模型小鼠血糖水平及糖耐量曲线AUC积分均显著高于对照组(<0.01);与模型组比较,给予黑树莓多酚低、高剂量饲料15 min时可抑制STZ诱导的糖尿病小鼠血糖的上升状况,但无显著差异;对糖耐量曲线进行AUC积分后,发现黑树莓多酚高剂量组显著抑制STZ诱导的糖尿病小鼠血糖水平(<0.01)。与STZ诱导的糖尿病小鼠不同,黑树莓多酚对AXN诱导的糖尿病小鼠表现出了更佳的降血糖效果。黑树莓多酚高剂量组将AXN诱导的糖尿病小鼠血糖的上升趋势延后至30 min;对糖耐量曲线进行AUC积分后,发现黑树莓多酚高剂量组显著抑制AXN诱导的糖尿病小鼠血糖水平(<0.05)。
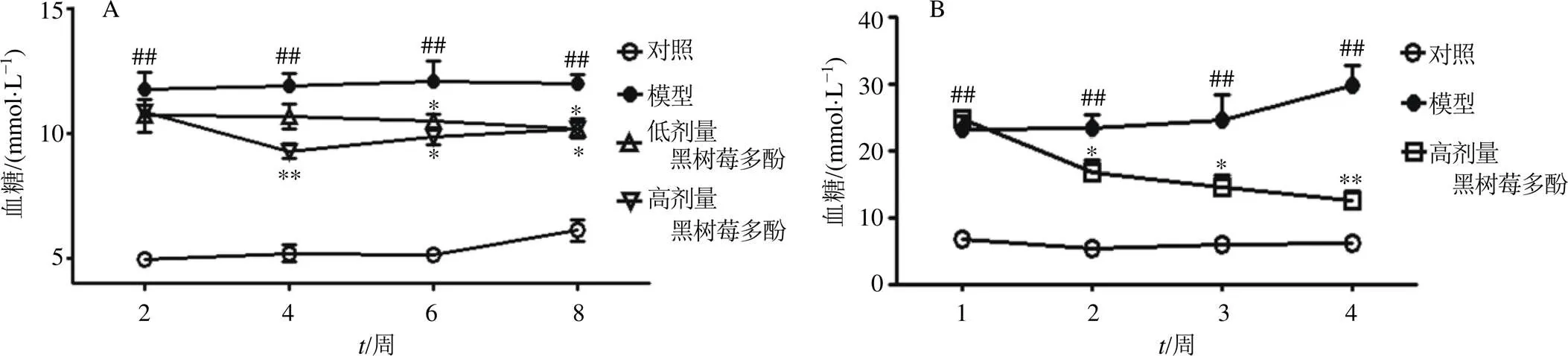
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下同
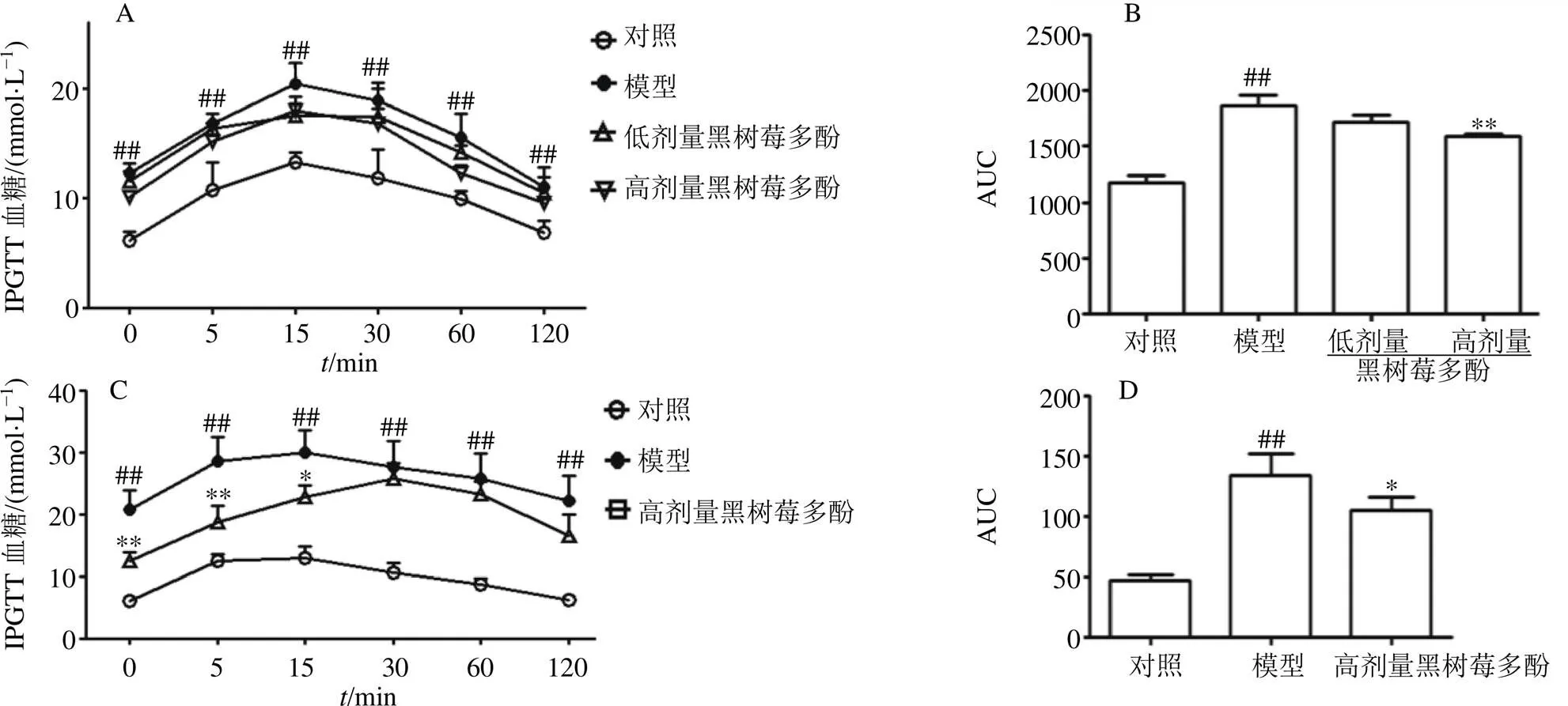
图2 黑树莓多酚对STZ (A、B)及AXN (C、D) 诱导的糖尿病小鼠糖耐量的影响()
3.4 黑树莓多酚对糖尿病小鼠血脂的影响
糖尿病是一组由多病因引起的以慢性高血糖为特征的终身性代谢性疾病。如图3所示,STZ和AXN诱导的糖尿病小鼠在体内特征上有所不同,STZ诱导的糖尿病小鼠血脂无显著变化;AXN诱导的糖尿病小鼠血清中TG和CHO水平显著升高(<0.05、0.01);与模型组比较,黑树莓多酚高剂量组小鼠血清中TG和CHO水平显著降低(<0.05)。
3.5 黑树莓多酚对糖尿病小鼠脏器指数的影响
如图4所示,STZ和AXN诱导的糖尿病小鼠在脏器损伤方面也有所不同,STZ诱导的糖尿病小鼠脏器指数无显著变化;AXN诱导的糖尿病小鼠肾脏指数显著升高(<0.05);与模型组比较,黑树莓多酚高剂量组小鼠肾脏指数显著降低(<0.05)。

图3 黑树莓多酚对STZ (A、B)及AXN (C、D) 诱导的糖尿病小鼠血脂的影响()

图4 黑树莓多酚对STZ (A)及AXN (B) 诱导的糖尿病小鼠脏器指数的影响()
3.6 黑树莓多酚对糖尿病小鼠肝脏炎症的影响
糖尿病的高血糖症状会对机体的内脏造成不同程度的影响,肝脏参与大部分脂代谢,因而在糖尿病糖脂代谢紊乱的条件下,肝脏的负担加重,产生的炎性反应作为并发症加剧糖尿病的发展。通过检测肝脏中炎性因子(、、和)转录水平表达情况,评估黑树莓多酚对糖尿病小鼠肝脏炎症的影响。鉴于上述对糖尿病小鼠并发症(血脂水平及脏器指数)的测定发现,在STZ诱导的糖尿病小鼠中,这2项指标均无显著变化。因此,选用AXN诱导的糖尿病小鼠观察肝脏炎症发生情况。如图5所示,与对照组比较,模型组小鼠肝脏中、和表达水平显著升高(<0.05、0.01);与模型组比较,黑树莓多酚高剂量组小鼠肝脏中、、和mRNA表达水平均显著降低(<0.05、0.01)。
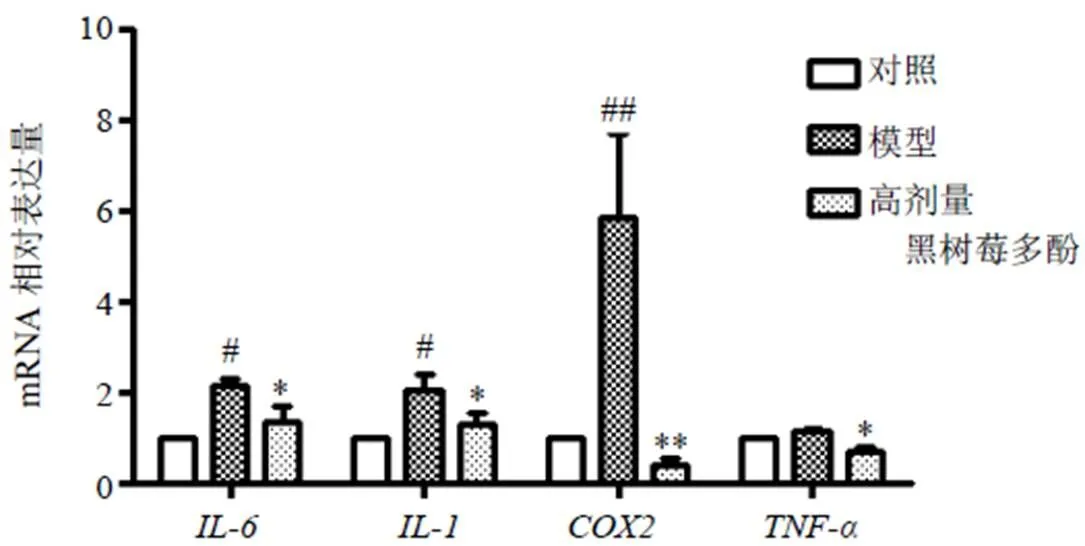
图5 黑树莓多酚对AXN诱导的糖尿病小鼠肝脏炎症的影响()
3.7 黑树莓多酚对糖尿病小鼠胰岛素信号通路相关蛋白表达的影响
胰岛素影响的葡萄糖代谢大部分由骨骼肌细胞负责,因此骨骼肌在葡萄糖的代谢过程中起着重要作用。机体骨骼肌对葡萄糖代谢障碍会导致胰岛素抵抗,胰岛素抵抗除了与胰岛素分泌不足有关,更主要是由机体对胰岛素的不敏感状况导致的。从细胞学角度上来看,机体对胰岛素的不敏感反应,可能是由于胰岛素信号传导通路异常。胰岛素信号通路的相关蛋白主要包括IR、IRS、GSK3β、Akt、GLUT4等,这些蛋白的表达及功能行使异常都有可能会导致胰岛素信号通路的传递障碍,从而加剧机体的胰岛素抵抗。如图6所示,在STZ诱导的糖尿病小鼠中,与对照组比较,模型组小鼠骨骼肌组织中p-IRS、IR、p-IR和p-Akt蛋白表达水平明显降低(<0.05、0.01);与模型组比较,黑树莓多酚低、高剂量组骨骼肌组织IR、p-IR和p-Akt蛋白表达水平均显著升高(<0.05、0.01),黑树莓多酚高剂量组p-IRS蛋白表达水平显著升高(<0.01)。AXN诱导的糖尿病小鼠中,与对照组比较,模型组小鼠骨骼肌组织中p-IRS、IR和p-IR蛋白表达水平明显降低(<0.05、0.01);与模型组比较,黑树莓多酚高剂量组p-IRS、IR、p-IR和GSK3β蛋白表达水平均显著升高(<0.05)。
3.8 黑树莓多酚对糖尿病小鼠骨骼肌GLUT4及AMPKα1 mRNA表达的影响
如图7所示,在STZ诱导的糖尿病小鼠中,与对照组比较,模型组小鼠骨骼肌组织中及mRNA表达水平无明显变化;与模型组比较,黑树莓多酚低、高剂量组mRNA表达水平显著升高(<0.05)。AXN诱导的糖尿病小鼠中,与对照组比较,模型组小鼠骨骼肌组织中及mRNA表达水平无明显变化;与模型组比较,黑树莓多酚高剂量组及mRNA表达水平显著升高(<0.05、0.01)。
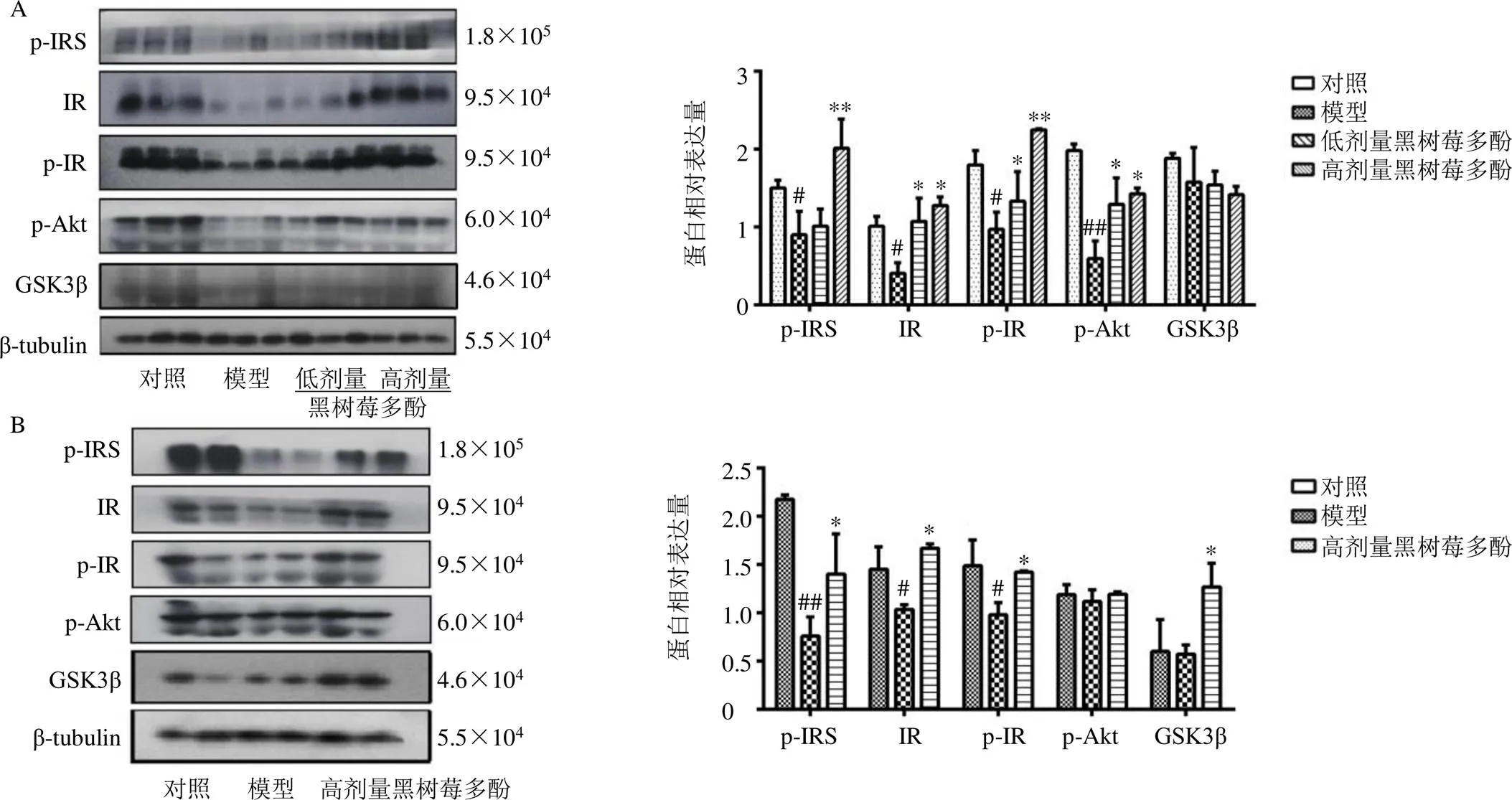
图6 黑树莓多酚对STZ (A)及AXN (B) 诱导的糖尿病小鼠骨骼肌中胰岛素信号通路相关蛋白表达的影响
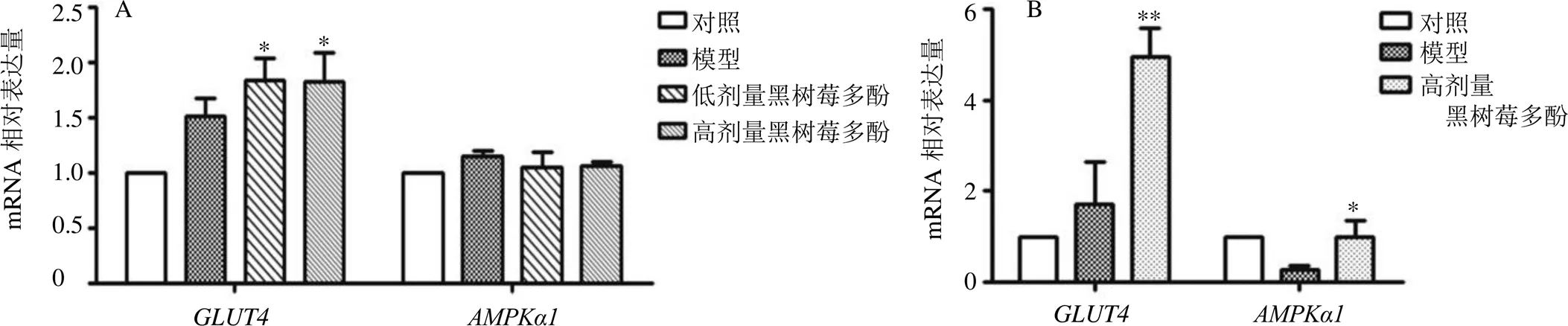
图7 黑树莓多酚对STZ (A)及AXN (B) 诱导的糖尿病小鼠骨骼肌中GLUT4及AMPKα1mRNA表达的影响(, n = 3)
4 讨论
本研究采用STZ或AXN诱导的糖尿病小鼠模型,考察黑树莓多酚对小鼠空腹血糖、糖耐受能力、并发症的作用及机制。实验性糖尿病模型的建立方法主要分为高脂饮食诱导法[14]、化学诱导法[15]、高脂饮食结合化学诱导法和基因敲除方法等[16]。其中,STZ及AXN作为最常见的化学诱导药物得到了广泛应用[17-18]。本研究发现,相同剂量下,AXN诱导的小鼠糖尿病症状较STZ明显。黑树莓多酚饮食显著降低STZ及AXN诱导的糖尿病小鼠血糖水平;黑树莓多酚显著上调STZ诱导的糖尿病小鼠骨骼肌中p-IRS、IR、p-IR和p-Akt蛋白表达水平,显著上调mRNA表达水平,但对GSK3β蛋白表达及mRNA表达无明显影响,这可能由于在STZ诱导的糖尿病小鼠中,黑树莓多酚对GLUT4的活化作用并不是通过刺激GLUT4上游关键蛋白AMPK和GSK3β导致的,可能通过其他通路激活Akt从而导致下游GLUT4的活化[19],其具体靶点还需进一步探究;黑树莓多酚显著上调AXN诱导的糖尿病小鼠骨骼肌中p-IRS、IR、p-IR和GSK3β蛋白表达水平,显著上调及mRNA表达水平。综上,黑树莓多酚能够上调2种糖尿病小鼠模型骨骼肌中胰岛素信号通路上游蛋白IR、IRS的磷酸化水平,但对下游葡萄糖转运关键蛋白GLUT4的活化作用有所不同。黑树莓多酚对AXN诱导的糖尿病小鼠模型GLUT4转录活化是通过刺激GLUT4上游关键蛋白AMPK实现的,对STZ诱导的糖尿病小鼠模型GLUT4转录活化的作用靶点还需进一步探究。
糖尿病是一种由多病因引起的以慢性高血糖为特征的终身性代谢性疾病。患者血糖长期升高,大血管、微血管受损并危及心、脑、肾、周围神经、眼睛、足等[20]。据世界卫生组织统计,糖尿病并发症高达100多种,是目前已知并发症最多的一种疾病,因此针对糖尿病并发症对糖尿病的治疗有着积极意义[21-22]。黑树莓作为可食用的小浆果,其果实中富含多酚类化合物,本课题组前期研究结果提示,通过改善膳食结构,饮食添加一定量黑树莓多酚,亦或是单独开发黑树莓多酚相关制剂,对于糖尿病的辅助治疗有积极价值。黑树莓多酚对糖尿病并发症的缓解作用,主要从血脂水平、脏器指数、肝脏炎症3个方面进行评估。STZ诱导的糖尿病小鼠血脂水平和脏器指数并未发生明显变化,可能是由于STZ主要损伤胰岛细胞,进而引发血糖代谢异常,而对脂类代谢的调控并不明显。黑树莓多酚显著降低AXN诱导的糖尿病小鼠血清中血脂水平和肾脏指数。肝脏是脂类代谢的主要场所,在糖尿病糖脂代谢紊乱的条件下,肝脏负担加重,产生炎性反应并作为并发症加剧糖尿病的发展。黑树莓多酚显著抑制AXN诱导的糖尿病小鼠肝脏中、、和mRNA表达水平,表明黑树莓多酚饮食可以明显缓解AXN诱导的糖尿病小鼠并发症。
综上所述,黑树莓多酚可以通过调控胰岛素信号通路相关蛋白表达,进而促进葡萄糖代谢,缓解STZ及AXN诱导的糖尿病小鼠中血糖代谢紊乱引发的相关症状。
利益冲突 所有作者均声明不存在利益冲突
[1] Pourhanifeh M H, Hosseinzadeh A, Dehdashtian E,. Melatonin: New insights on its therapeutic properties in diabetic complications [J]., 2020, 12: 30.
[2] Tan S Y, Mei Wong J L, Sim Y J,. Type 1 and 2 diabetes mellitus: A review on current treatment approach and gene therapy as potential intervention [J]., 2019, 13(1): 364-372.
[3] Sasaki M, Nishida N, Shimada M. A beneficial role of rooibos in diabetes mellitus: A systematic review and meta-analysis [J]., 2018, 23(4): 839.
[4] Öztürk E, Arslan A K K, Yerer M B,. Resveratrol and diabetes: A critical review of clinical studies [J]., 2017, 95: 230-234.
[5] Vargas E, Podder V, Carrillo Sepulveda M A.[M]. Treasure Island: StatPearls, 2021.
[6] Parry J, Su L, Moore J,. Chemical compositions, antioxidant capacities, and antiproliferative activities of selected fruit seed flours [J]., 2006, 54(11): 3773-3778.
[7] Chen L L, Jiang B W, Zhong C G,. Chemoprevention of colorectal cancer by black raspberry anthocyanins involved the modulation of gut microbiota and SFRP2 demethylation [J]., 2018, 39(3): 471-481.
[8] Guo J, Yang Z, Zhou H R,. Upregulation of DKK3 by miR-483-3p plays an important role in the chemoprevention of colorectal cancer mediated by black raspberry anthocyanins [J]., 2020, 59(2): 168-178.
[9] Zhang H, Guo J, Mao L P,. Up-regulation of miR-24-1-5p is involved in the chemoprevention of colorectal cancer by black raspberry anthocyanins [J]., 2019, 122(5): 518-526.
[10] Prior R L, Wilkes S, Rogers T,. Dietary black raspberry anthocyanins do not alter development of obesity in mice fed an obesogenic high-fat diet [J]., 2010, 58(7): 3977-3983.
[11] Jeong H S, Hong S J, Lee T B,. Effects of black raspberry on lipid profiles and vascular endothelial function in patients with metabolic syndrome [J]., 2014, 28(10): 1492-1498.
[12] Xiao T, Guo Z H, Bi X L,. Polyphenolic profile as well as anti-oxidant and anti-diabetes effects of extracts from freeze-dried black raspberries [J]., 2017, 31: 179-187.
[13] Bi X L, Fang W F, Wang L S,. Black raspberries inhibit intestinal tumorigenesis in Apc1638+/–and Muc2–/–mouse models of colorectal cancer [J]., 2010, 3(11): 1443-1450.
[14] Islam M S, Loots du T. Experimental rodent models of type 2 diabetes: A review [J]., 2009, 31(4): 249-261.
[15] Radenković M, Stojanović M, Prostran M. Experimental diabetes induced by alloxan and streptozotocin: The current state of the art [J]., 2016, 78: 13-31.
[16] 唐艺丹, 王鲜忠, 张姣姣. II型糖尿病动物模型构建的研究进展 [J]. 中国实验动物学报, 2020, 28(6): 870-876.
[17] 王芳, 朱大菊, 孙明谨, 等. 链脲菌素在糖尿病鼠模型中的应用及其作用机理 [J]. 郧阳医学院学报, 2004, 23(1): 15-17.
[18] 王晓颖, 段有金, 董瑶, 等. 四氧嘧啶实验性糖尿病大鼠模型的复制及其发病机制的探讨[J]. 中国医学理论与实践, 2002, 17(7): 802-803.
[19] Turan B, Tuncay E, Vassort G. Resveratrol and diabetic cardiac function: Focus on recentandstudies [J]., 2012, 44(2): 281-296.
[20] 孙天慧. 2型糖尿病慢性并发症的临床特点及其影响因素分析 [D]. 合肥: 安徽医科大学, 2020.
[21] 黄一青, 杨峥. 2型糖尿病健康教育研究进展 [J]. 现代医药卫生, 2013, 29(7): 1042-1044.
[22] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版) [J]. 中国医学前沿杂志: 电子版, 2015, 7(3): 26-89.
Regulation and mechanism of polyphenol fromon blood sugar metabolism in diabetic mice
CHEN Li-li, LIU Yue, NIU Xiao-qi, LIU Wei, BI Xiu-li
College of Life Science, Liaoning University, Shenyang 110036, China
To explore the blood sugar regulation and mechanism of polyphenol fromon blood sugar in diabetic mice.Diabetes models induced by streptozotocin and alloxan were established in mice, after fed with feed containing polyphenol from, blood glucose of mice in each group were detected; Kit was used to detect levels of triglyceride (TG) and total cholesterol (CHO) in serum of mice in each group; The effect of polyphenol fromon organ index of diabetic mice were investigated; qRT-PCR method was used to investigate the effect of polyphenol fromon interleukin-1 (),, cyclooxygenase 2 (), tumor necrosis factor-α () mRNA expressions in liver and glucose transporter 4 (), AMP-activated protein kinase α1 () mRNA expressions in skeletal muscle of diabetic mice; Western blotting was used to detect the effect of polyphenol fromon expression of insulin signaling pathway-related proteins in skeletal muscle of diabetic mice.Polyphenol fromsignificantly reduced fasting blood glucose and glucose tolerance in diabetic mice induced by streptozotocin and alloxan (< 0.05, 0.01), reduced levels of TG and CHO in serum of diabetic mice induced by alloxan (< 0.05), reduced the kidney index of diabetic mice induced by alloxan (< 0.05), reduced,,andmRNA expressions in liver of diabetic mice induced by alloxan (< 0.05, 0.01), up-regulated phosphorylated insulin receptor substrate (p-IRS), insulin receptor (IR), phosphorylated IR (p-IR) and phosphorylated protein kinase B (p-Akt) expressions in skeletal muscle of diabetic mice induced by streptozotocin (< 0.05, 0.01), up-regulatedmRNA expression levels (< 0.05), up-regulated p-IRS, IR, p-IR and glycogen synthase kinase 3β (GSK3β) expressions in skeletal muscle of diabetic mice induced by alloxan (< 0.05), and up-regulatedandmRNA expressions (< 0.05, 0.01).Polyphenol fromcan alleviate the symptoms caused by disorders of blood glucose metabolism in diabetic mice induced by streptozotocin and alloxan through activating the insulin signaling pathway and promoting glucose metabolism.
polyphenol fromH. Lévl.; diabetes; glucose tolerance; blood lipids; organ index; insulin signaling pathway
R285.5
A
0253 - 2670(2021)17 - 5258 - 09
10.7501/j.issn.0253-2670.2021.17.018
2021-07-26
陈丽莉(1990—),女,博士研究生,研究方向为代谢类疾病及肿瘤化学预防。E-mail: lilychen723@163.com
毕秀丽(1977—),女,沈阳药科大学2000级硕博连读,药理学专业校友,博士生导师,教授,辽宁省首批“兴辽英才”计划入选者,辽宁省“百千万人才工程”百层次人选,沈阳市高层次领军人才,研究方向为代谢类疾病及肿瘤化学预防。E-mail: xiulibi@gmail.com
[责任编辑 李亚楠]
