淫羊藿苷元治疗血小板减少症的靶点鉴定及作用机制研究
2021-09-06王岩航叶效明孙成宏姚景春屠鹏飞张贵民曾克武
王岩航,叶效明#,姚 璐,孙成宏,姚景春,屠鹏飞,张贵民*,曾克武*
淫羊藿苷元治疗血小板减少症的靶点鉴定及作用机制研究
王岩航1,叶效明1#,姚 璐1,孙成宏2,姚景春2,屠鹏飞1,张贵民2*,曾克武1*
1. 北京大学 天然药物及仿生药物国家重点实验室,北京 100191 2. 鲁南制药集团股份有限公司 中药制药共性技术国家重点实验室,山东 临沂 276006
探索淫羊藿苷元治疗血小板减少症的直接作用靶点及作用机制。从BALB/c小鼠股骨中分离得到原代骨髓细胞,利用键合淫羊藿苷元的琼脂糖微球捕获并鉴定靶点蛋白,使用表面等离子共振(surface plasmon resonance,SPR)技术进行靶点确证;采用Western blotting检测淫羊藿苷元对胰岛素受体底物1(insulin receptor substrate 1,IRS1)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、Hippo、细胞周期、Janus激酶(Janus kinase,JAK)/信号转导与转录激活子(signal transducer and activator of transcription,STAT)和核因子-κB(nuclear factor-κB,NF-κB)通路相关蛋白的调控作用;通过流式细胞术检测淫羊藿苷元对巨核细胞系分化的影响。共发现20个与造血干细胞增殖分化功能密切相关的靶点蛋白,且淫羊藿苷元可能通过作用于泛素羧基末端酯酶L5(ubiquitin carboxyl-terminal esterase L5,UCHL5)、肿瘤坏死因子α诱导蛋白8(tumor necrosis factor α-induced protein 8,TNFAIP8)、Visfatin靶点,进而激活IRS1/Akt/mTOR/GSK3β和细胞周期通路,并抑制Hippo、JAK/STAT和NF-κB通路,最终促进巨核细胞的分化。淫羊藿苷元通过UCHL5、TNFAIP8、Visfatin等多靶点治疗血小板减少症。
血小板减少症;淫羊藿苷元;靶点识别;信号通路;巨核细胞
血小板减少症是指由于血小板的数量大量减少,造成凝血功能障碍,并以自发性出血为特征的临床常见疾病[1]。血小板减少症的发病机制较为复杂,一方面是血小板的自身生成不足,另一方面是免疫失调导致的血小板破坏过多所致[2]。目前尚无治疗血小板减少症的特效药物。传统中药淫羊藿具有补肾阳、强筋骨、祛风湿等功效,临床上常用于治疗类风湿性关节炎、骨质疏松、慢性再生障碍性贫血等疾病[3]。淫羊藿苷元为淫羊藿的重要活性成分,具有免疫调节、预防骨质疏松、神经保护等药理活性[4]。近年来研究发现,淫羊藿苷元能够显著回调免疫性血小板减少性紫癜模型小鼠外周血的血小板数量,可有效抑制血小板减少[5],但淫羊藿苷元治疗血小板减少症的具体作用靶点与机制仍不明确。因此,本研究利用淫羊藿苷元键合的固相琼脂糖微球,从骨髓细胞裂解液中捕获靶点蛋白并进行高分辨质谱鉴定,同时结合表面等离子共振技术(surface plamon resonace technology,SPR)确认淫羊藿苷元的作用靶点;此外对关键靶点下游的胰岛素受体底物1(insulin receptor substrate 1,IRS1)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、Hippo、细胞周期、Janus激酶(Janus kinase,JAK)/信号转导与转录激活子(signal transducer and activator of transcription,STAT)和核因子-κB(nuclear factor-κB,NF-κB)等信号通路进行验证,旨在从靶点源头上揭示淫羊藿苷元治疗血小板减少症的作用机制。
1 材料
1.1 动物
SPF级雄性BALB/c小鼠20只,6~7周龄,体质量18~22 g,购自北京大学医学部实验动物中心。动物饲养于北京大学医学部实验动物中心动物房,温度25 ℃,自由进食饮水。动物实验经北京大学生物医学伦理委员会批准[批准号SCXK(京)2016-0010]。
1.2 药品与试剂
淫羊藿苷元(批号170602,质量分数>98%)购自山东新时代药业有限公司,其结构式见图1;琼脂糖环氧微球(批号17-0480-01)购自美国GE Healthcare公司;人源泛素羧基末端酯酶L5(ubiquitin carboxyl-terminal esterase L5,UCHL5)蛋白购自美国ProSpec公司;人源肿瘤坏死因子α诱导蛋白8(tumor necrosis factor α-induced protein 8,TNFAIP8)蛋白购自中国北京义翘神州科技有限公司;人源Visfatin蛋白购自英国Abcam公司;mTOR抗体(批号ab134903)购自北京百诺威生物科技有限公司;磷酸化mTOR(p-mTOR)抗体(批号5536)、p-Akt抗体(批号3348)、IRS1抗体(批号3407)、GSK3β抗体(批号5676)、磷酸化Yes相关蛋白1(phosphorylated yes-associated protein 1,p-YAP1)抗体(批号13008)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号8884)、JAK2抗体(批号3230S)、STAT3抗体(批号12640S)、NF-κB抗体(批号8242S)、p-NF-κB抗体(批号3033S)、NF-κB抑制因子α(NF-κB inhibitor α,IκBα)抗体(批号4814T)、p-IκBα抗体(批号2859T)、兔二抗(批号7074)、鼠二抗(批号7076S)购自美国CST公司;Akt抗体(批号BS1502)、p-GSK3β抗体(批号BS94042)、Cyclin B1抗体(批号BS1392)、YAP1抗体(批号BS1701)、哺乳动物体20样激酶1(mammalian sterile-20-like 1,MST1)抗体(批号BS71058)、大抑癌基因1(large tumor suppressor 1,LATS1)抗体(批号ab243656)、p-JAK2抗体(批号BS4837)、p-STAT3抗体(批号AP0274)购自南京巴傲得生物科技有限公司;Cyclin D1抗体(批号bs-0623R)购自北京博奥森生物技术有限公司;β-actin抗体(批号60008-1-Ig)购自美国Proteintech公司;流式细胞术蛋白抗体购自美国BioLegend公司;Hippo通路抑制剂XMU-MP-1(批号HY-100526)、IRS1/Akt/mTOR/GSK3β通路抑制剂MK-2206(批号HY-10358)、NF-κB通路抑制剂Bay11-7082(批号HY-13453)购自美国MedChemExpress公司;JAK/STAT通路抑制剂AZD-1480(批号S2162)购自上海蓝木化工有限公司。
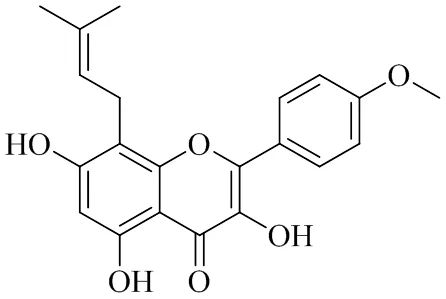
图1 淫羊藿苷元结构式
1.3 仪器
LTQ-Orbitrap质谱(美国Thermo Fisher Scientific公司);Biacore 8K等离子表面共振仪、CM5氨基偶联芯片(美国Biacore公司);Calibur2流式细胞仪(美国BD Biosciences公司)。
2 方法
2.1 骨髓细胞的提取与培养
BALB/c小鼠脱颈椎处死后取股骨,用PBS溶液冲出骨髓,离心后弃去上清,加入红细胞裂解液重悬细胞,离心后弃去上清,得到原代骨髓细胞。将骨髓细胞接种于6孔板中,用含1%青霉素-链霉素混合溶液、10%胎牛血清的RPMI 1640培养基于37 ℃培养箱培养,6 h后更换培养基。
2.2 淫羊藿苷元键合的琼脂糖环氧微球的制备
将未键合的琼脂糖环氧微球和淫羊藿苷元(500 μmol/L)在碱性缓冲条件(pH 8)下孵育12 h,以PBS溶液洗涤键合后的微球5次[6]。
2.3 淫羊藿苷元的靶点蛋白鉴定
用含1%蛋白酶抑制剂的NP-40裂解液对骨髓细胞进行裂解,离心后取上清。分别用键合了淫羊藿苷元的固相微球和未键合的固相微球与等量且等质量浓度蛋白溶液孵育过夜,对微球捕获的蛋白样品用nanoLC-LTQ-Orbitrap MS/MS进行分析:RP-C18AQ毛细管液相色谱柱(15 cm×100 μm,美国Michrom Bioresources公司);正离子模式;进样量为1 μL;扫描分辨率为FWMH 60 000;喷雾电压为1.8 kV;全扫描范围为/350~2000;体积流量为300 nL/min。数据处理采用Thermo Proteome Discoverer v.1.4.1.14。
2.4 SPR鉴定淫羊藿苷元与靶点蛋白互作
分别取100 μL 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3- ethylcarbodiimide hydrochloride,EDC]和100 μL-羟基琥珀酰亚胺(-hydroxysuccinimide,NHS)对8通道CM5氨基偶联的蛋白芯片进行活化,将蛋白用PBS溶液配制成质量浓度为1 mg/mL的溶液,并连接到CM5芯片,直至响应值达到10 000。将淫羊藿苷元母液稀释为0.78~50.00 μmol/L的溶液,分别与UCHL5、TNFAIP8、Visfatin蛋白进行动力学分析和亲和力测试。
2.5 靶点通路富集分析
选择质谱结果中结合组的响应值与空白组的响应值比值大于1.5的蛋白质,利用Cytoscape version 3.6.0软件中的ClueGO程序选择Medium Network Specificity进行基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,种属选择为Mus Musculus [10090]。
2.6 Western blotting检测蛋白表达情况
设置对照组和淫羊藿苷元(5、10、20 μmol/L)组,各给药组加入相应药物,对照组加入不含药物的培养基。骨髓细胞经药物处理后,加入含1%蛋白酶抑制剂的NP-40裂解液,于冰上孵育30 min,12 000 r/min离心20 min,取上清液,加入6×Protein loading buffer,98 ℃加热10 min。蛋白样品经8%~12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入含5%脱脂奶粉的TBST溶液封闭30 min,分别加入IRS1、p-Akt、Akt、p-mTOR、mTOR、p-GSK3β、GSK3β、MST1、LATS1、p-YAP1、YAP1、Cyclin B1、Cyclin D1、p-IκBα、IκBα、p-NF-κB、NF-κB、p-JAK2、JAK2、p-STAT3、STAT3、GAPDH和β-actin抗体,室温孵育2 h;加入二抗,孵育1 h,加入ECL化学发光试剂,采用Tanon-5200 Multi系统成像,Image J软件进行灰度分析。
2.7 流式细胞术检测巨核细胞的分化
设置对照组、淫羊藿苷元(10 μmol/L)、XMU-MP-1(1 μmol/L)、MK-2206(1 μmol/L)、Bay11-7082(1 μmol/L)和AZD-1480(1 μmol/L)组,除对照组外,其余各组加入淫羊藿苷元(10 μmol/L),各抑制剂组再加入相应抑制剂,对照组加入不含药物的培养基。骨髓细胞经药物处理后,收集细胞,用预冷的含10%胎牛血清的PBS溶液调节细胞悬液至1×106/mL;加入CD41、CD117、Lineage抗体,同时加入7-AAD以排除死细胞,4 ℃避光孵育30 min,以PBS溶液清洗细胞后,2000 r/min离心3 min,然后重悬于预冷的含10%胎牛血清的PBS溶液中。将细胞避光保存于冰上,采用流式细胞仪进行分析,Lineage阴性、CD41阳性、CD117阴性的细胞被认为是巨核细胞[7]。
2.8 统计学分析
所有数据采用GraphPad Prism 6统计学软件进行单因素方差分析(One-way ANOVA)和检验。
3 结果
3.1 淫羊藿苷元作用靶点的质谱检测及作用靶点网络分析
为了探索淫羊藿苷元的作用靶点,采用LC-MS的方法对键合有淫羊藿苷元的琼脂糖微球富集到的蛋白质进行检测,结果表明UCHL5、TNFAIP8、Visfatin、ESD、谷胱甘肽巯基转移酶K1(glutathione-transferase κ1,GSTK1)、SUMO活化酶E1(SUMO-activating enzyme E1,SAE1)、蛋白酪氨酸磷酸酶-α(protein tyrosine phosphatase-α,PTP-α)、蛋白二硫化物异构酶A6(protein disulfide-isomerase A6,PDIA6)可能是淫羊藿苷元的潜在作用靶点。研究表明,UCHL5主要参与细胞内的代谢[8],TNFAIP8参与调控细胞周期[9],ESD和Visfatin参与免疫功能调控[10-11],GSTK1发挥抗氧化作用[12],SAE1参与蛋白质的降解[13],PTP-α和PDIA6参与信号传递[14-15]。
对质谱检测到的潜在作用靶点进行KEGG通路富集,如图2所示,靶点功能主要集中于内质网蛋白加工、嘧啶代谢、DNA复制、转运RNA合成以及蛋白降解,此外还有部分靶点参与了免疫调节[12-13]。表明淫羊藿苷元可能通过促进内质网蛋白合成、增强细胞代谢、促进细胞周期以及免疫调节等功能,从而治疗血小板减少症。
3.2 淫羊藿苷元与关键靶点的结合作用确证
为了进一步确证淫羊藿苷元与不同靶点蛋白的结合能力,本研究采用SPR技术分析了淫羊藿苷元与靶点蛋白的解离常数(D),主要选取了3个具有代表性功能的靶点蛋白,分别是与细胞代谢相关的UCHL5、与细胞周期相关的TNFAIP8以及与免疫调节相关的Visfatin。如图3所示,淫羊藿苷元与UCHL5的D为8.72×10−6mol/L,为强结合;淫羊藿苷元与TNFAIP8的D为9.99×10−6mol/L,为强结合;淫羊藿苷元与Visfatin的D为5.64×10−5mol/L,为中等强度结合。由此判断,淫羊藿苷元与UCHL5、TNFAIP8、Visfatin等靶点的结合存在特异性,因此UCHL5、TNFAIP8、Visfatin可能是淫羊藿苷元发挥药效作用的关键靶点蛋白。
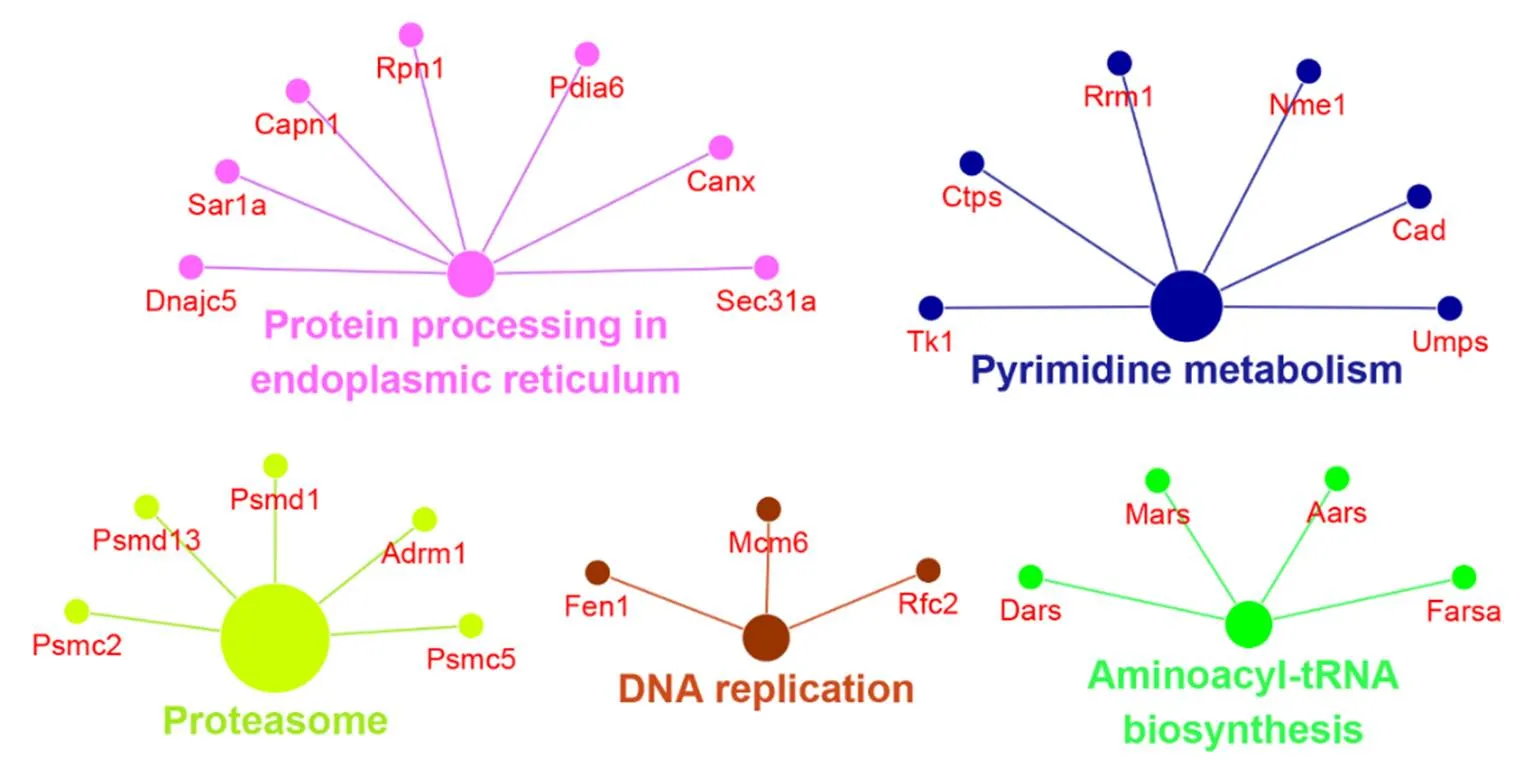
图2 淫羊藿苷元的作用靶点网络分析

图3 淫羊藿苷元与UCHL5、TNFAIP8、Visfatin蛋白的结合动力学分析
3.3 淫羊藿苷元对IRS1/Akt/mTOR/GSK3β信号通路的调控作用
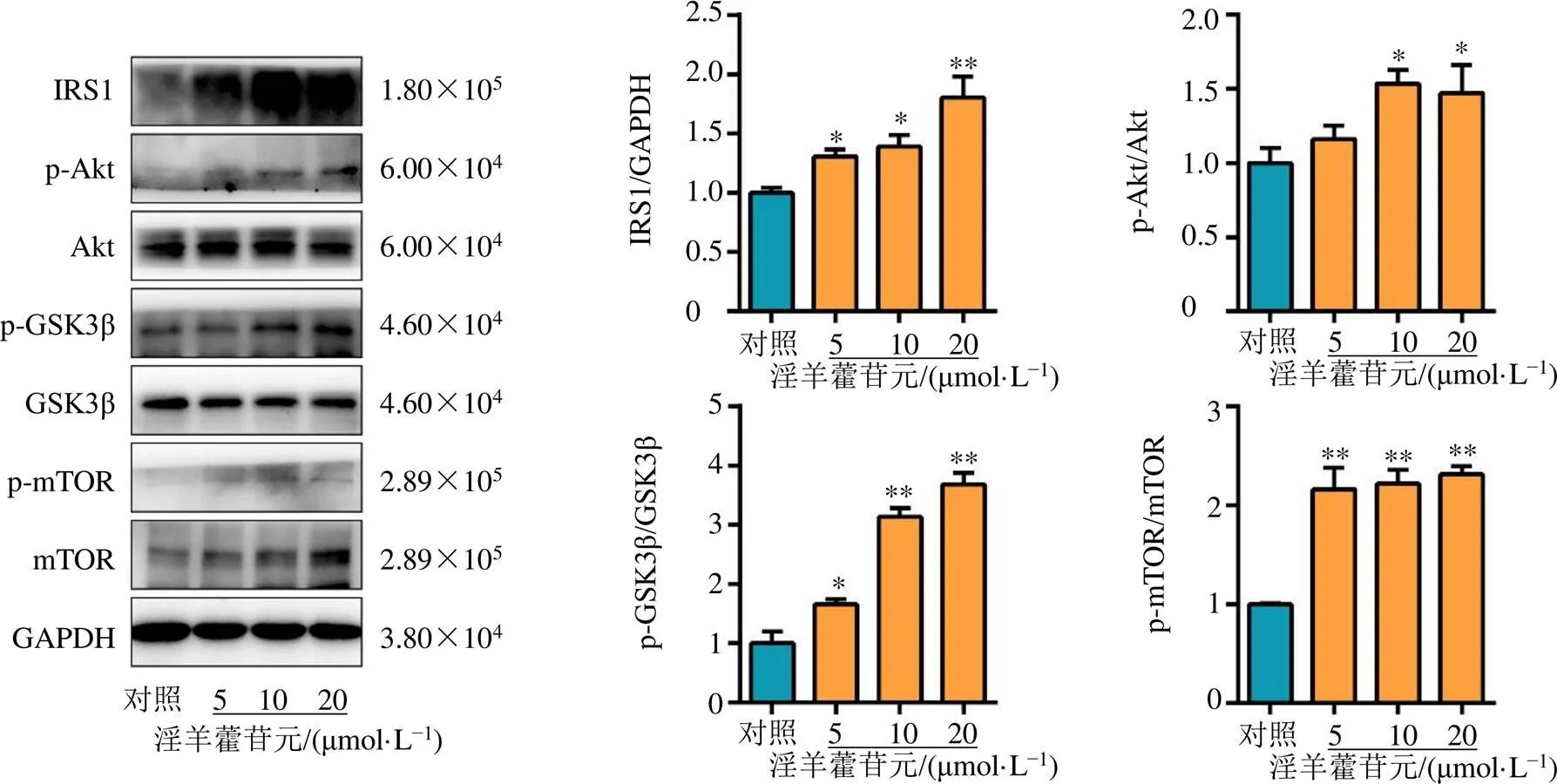
UCHL5在干细胞的增殖和分化进程中具有重要的生物学意义,可以通过调控IRS1/Akt/mTOR/ GSK3β通路促进细胞内的糖脂代谢,进而提高细胞的能量供应,并为干细胞增殖分化提供动力[8]。如图4所示,淫羊藿苷元可以促进骨髓细胞中IRS1蛋白表达,上调Akt的磷酸化,进而增加mTOR和GSK3β的磷酸化水平(<0.05、0.01),表明淫羊藿苷元能够激活IRS1/Akt/mTOR/ GSK3β通路,促进糖脂代谢的发生,进而为造血干细胞的增殖分化提供能量,发挥治疗血小板减少症的作用。
3.4 淫羊藿苷元对Hippo信号通路和细胞周期通路的调控作用
TNFAIP8可以通过抑制Hippo通路进而促进细胞增殖分化[9]。如图5所示,淫羊藿苷元能够促进骨髓细胞中Hippo通路上游MST1蛋白表达,同时促进下游LATS1蛋白表达,降低转录因子YAP1磷酸化水平并提高YAP1蛋白表达(<0.05、0.01),提示淫羊藿苷元可能通过TNFAIP8发挥抑制Hippo信号通路的作用,进而促进细胞增殖分化基因的表达,诱导造血干细胞增殖,从而发挥治疗血小板减少症的作用。
TNFAIP8能够促进Cyclin系列细胞周期蛋白的表达,激活细胞周期通路,发挥促进细胞增殖的作用。如图6所示,淫羊藿苷元能够上调骨髓细胞中Cyclin B1和Cyclin D1细胞周期蛋白表达(<0.01),表明淫羊藿苷元可以通过TNFAIP8激活Cyclin B1/Cyclin D1细胞周期通路,促进造血干细胞的增殖分化,进而发挥治疗血小板减少症的作用。
与对照组比较:*P<0.05 **P<0.01,图5~8同

图5 淫羊藿苷元能够激活原代细胞中的Hippo信号通路
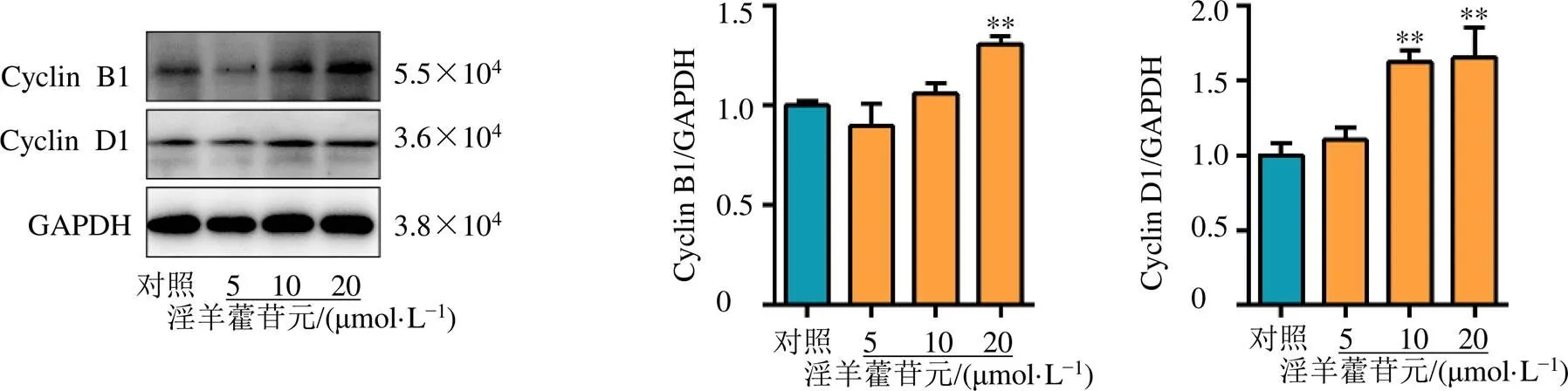
图6 淫羊藿苷元能够激活原代骨髓细胞中的Cyclin B1/Cyclin D1信号通路
3.5 淫羊藿苷元对NF-κB和JAK/STAT信号通路的调控作用
免疫性血小板减少症是自身免疫介导的血小板破坏和血小板生成缺陷的一类疾病。因此,可以通过抑制炎症相关通路的激活进而减少免疫介导的血小板破坏和生成缺陷,从而治疗血小板减少症。Visfatin可通过JAK/STAT和NF-κB通路调节免疫细胞的活动[11],因而推测淫羊藿苷元可能通过调节免疫细胞中JAK/STAT和NF-κB通路的功能,发挥治疗免疫性血小板减少症的作用。如图7所示,淫羊藿苷元能够下调IκBα以及NF-κB的磷酸化水平(<0.05),表明淫羊藿苷元通过Visfatin抑制NF-κB信号通路的激活,减少免疫介导的血小板破坏和生成缺陷,发挥治疗血小板减少症的作用。
JAK/STAT通路与免疫应答密切相关,如图8所示,淫羊藿苷元明显抑制JAK2以及STAT3蛋白表达,并下调其磷酸化水平(<0.05),表明淫羊藿苷元通过Visfatin抑制了JAK/STAT相关信号通路的激活,阻断免疫细胞的免疫反应,进而发挥治疗血小板减少症的作用。

图7 淫羊藿苷元能够激活原代骨髓细胞中的NF-κB信号通路
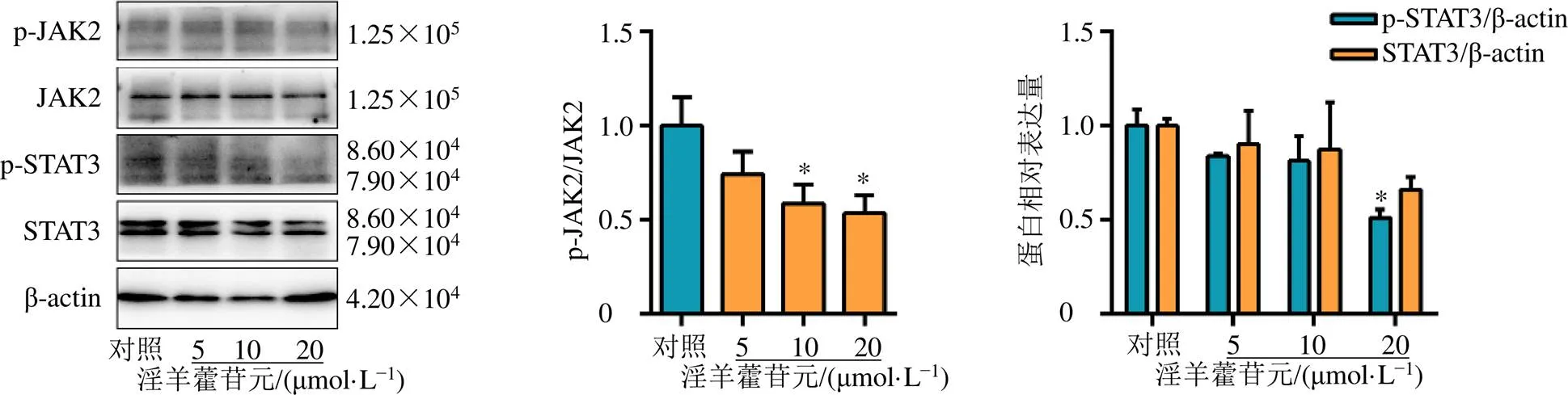
图8 淫羊藿苷元能够激活原代骨髓细胞中的JAK/STAT信号通路
3.6 基于流式细胞术探索淫羊藿苷元促进血小板形成的作用机制
为了进一步探索淫羊藿苷元抑制血小板减少症的作用机制,本研究分别使用IRS1/Akt/mTOR/ GSK3β、Hippo、NF-κB、JAK/STAT信号通路的抑制剂对骨髓细胞进行干预。如图9所示,淫羊藿苷元能够增加骨髓细胞中CD41单阳的巨核细胞比例(<0.01),表明淫羊藿苷元能够直接促进巨核细胞的分化进而促进血小板形成;Hippo通路抑制剂XMU-MP-1、NF-κB通路抑制剂Bay11-7082和JAK/STAT通路抑制剂AZD-1480与淫羊藿苷元同时使用时,不具有显著的协同增效作用;而IRS1/Akt/mTOR/GSK3β通路抑制剂MK-2206有效逆转了淫羊藿苷元促进巨核细胞分化的作用(<0.01),表明淫羊藿苷元可能主要通过激活IRS1/Akt/mTOR/GSK3β通路实现促进血小板形成的作用,而对Hippo、NF-κB、JAK/STAT等通路则表现出潜在的抑制作用。

与对照组比较:**P<0.01;与淫羊藿苷元组比较:##P<0.01
4 讨论
本研究结果表明,淫羊藿苷元通过作用于UCHL5、TNFAIP8、Visfatin靶点,进而激活IRS1/Akt/mTOR/GSK3β和细胞周期通路并抑制Hippo、JAK/STAT和NF-κB等通路,发挥促进巨核细胞分化并治疗血小板减少症的潜在作用。表明淫羊藿苷元不仅具有减少血小板免疫破坏的作用,还能够增强血小板的生成,即淫羊藿苷元可以从多角度治疗血小板减少症。
基于固相微球的药物靶点捕获与鉴定技术利用药物分子与靶点蛋白之间存在相互作用的特性,广泛用于药物靶点的发现;而基于生物信息学的靶点蛋白分析方法是依据药物小分子调控的信号通路网络图,首先明确小分子的功能,进一步根据小分子的功能寻找对应的靶点蛋白。为了快速有效地筛选到淫羊藿苷元的靶点蛋白,本研究首先根据结合组与竞争组的蛋白响应值进行初步筛选,进而根据蛋白功能利用KEGG通路富集方法对初步筛选的蛋白进行分类,明确淫羊藿苷元的主要作用信号通路,并基于此进一步寻找通路上游的蛋白,进行SPR互作分析验证。除本研究关注的UCHL5、TNFAIP8、Visfatin等靶点,其他功能靶点也可能参与了淫羊藿苷元的药理作用。氧化应激是制约细胞增殖的重要因素,过度氧化应激可诱发细胞衰老及DNA损伤,GSTK1蛋白主要发挥抗氧化作用,因此淫羊藿苷元也可能通过GSTK1蛋白调控细胞内的氧化应激状态对血小板及其前体细胞分化发挥作用;SAE1是参与细胞内蛋白质降解的关键蛋白,淫羊藿苷元同样可能通过结合SAE1进而促进与炎性反应相关蛋白的降解,保护血小板免受免疫介导的损伤。由此可见,淫羊藿苷元能够通过多靶点、多通路治疗血小板减少症。
综上所述,本研究初步阐明了淫羊藿苷元治疗血小板减少症的可能作用靶点与作用机制,为今后淫羊藿苷元的临床应用提供了数据支持和理论依据,同时对于治疗血小板减少症的创新药物研发也具有重要的参考意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 葛均波, 徐永健, 王辰. 内科学[M]. 北京: 人民卫生出版社, 2018: 614.
[2] Mazurov A V, Khaspekova S G, Vasiliev S A. Diagnostics of thrombocytopenias [J]., 2018, 90(7): 4-13.
[3] 中国药典 [S]. 一部. 2020: 340.
[4] 何丽君, 江金井, 陈豪, 等. 淫羊藿药理作用和临床应用的研究进展 [J]. 中医临床研究, 2020, 12(2): 17-20.
[5] 王辰, 张珂, 李婉, 等. 淫羊藿苷元微乳制剂对小鼠免疫性血小板减少性紫癜模型的治疗作用 [J]. 中国新药杂志, 2017, 26(5): 555-561.
[6] 曾克武, 廖理曦, 万彦军, 等. 基于靶点“钩钓”策略的肉苁蓉苯乙醇苷药理靶点鉴定及功效解析[J]. 中草药, 2018, 49(1): 178-183.
[7] Li Y Q, Guo R, Wang L L,. G-CSF administration results in thrombocytopenia by inhibiting the differentiation of hematopoietic progenitors into megakaryocytes [J]., 2019, 169: 113624.
[8] Ko Y M, Chang C Y, Chiou S J,. Ubiquitin-terminal hydrolase-L5 is required for high glucose- induced transforming growth factor-β receptor I expression and hypertrophy in mesangial cells [J]., 2013, 535(2): 177-186.
[9] Xie Y, Zhou F, Zhao X. TNFAIP8 promotes cell growth by regulating the Hippo pathway in epithelial ovarian cancer [J]., 2018, 16(6): 4975-4982.
[10] 李伟伟. ESD蛋白增强I型干扰素信号转导抑制口蹄疫病毒的复制 [D]. 北京: 中国农业科学院, 2016.
[11] Heo Y J, Choi S E, Jeon J Y,. Visfatin induces inflammation and insulin resistance via the NF-κB and STAT3 signaling pathways in hepatocytes [J]., 2019, 2019: 4021623.
[12] Oniki K, Kamihashi R, Tomita T,. Glutathione-transferase K1 genotype and overweight status in schizophrenia patients: A pilot study [J]., 2016, 239: 190-195.
[13] Stankovic-Valentin N, Melchior F. Control of SUMO and Ubiquitin by ROS: Signaling and disease implications [J]., 2018, 63: 3-17.
[14] Cohen-Sharir Y, Kuperman Y, Apelblat D,. Protein tyrosine phosphatase alpha inhibits hypothalamic leptin receptor signaling and regulates body weight[J]., 2019, 33(4): 5101-5111.
[15] Schäfer M, Granato D C, Krossa S,. GRP78 protects a disintegrin and metalloprotease 17 against protein- disulfide isomerase A6 catalyzed inactivation [J]., 2017, 591(21): 3567-3587.
Target identification and mechanism research on inhibiting thrombocytopenia of icaritin
WANG Yan-hang1, YE Xiao-ming1, YAO Lu1, SUN Cheng-hong2, YAO Jing-chun2, TU Peng-fei1, ZHANG Gui-min2, ZENG Ke-wu1
1. State Key Laboratory of Natural and Biomimetic Drugs, School of Pharmaceutical Sciences, Peking University, Beijing 100191, China 2. State Key Laboratory of Generic Manufacture Technology of Chinese Traditional Medicine, Lunan Pharmaceutical Group Corporation, Linyi 276006, China
To explore the direct target and mechanism of icaritin on treatment of thrombocytopenia.Primary bone marrow cells were isolated from BALB/c mice. Target proteins were captured and identified by icaritin-binding agarose and further confirmed with surface plasmon resonance (SPR). Western blotting was used to detect the regulation of icaritin on insulin receptor substrate 1 (IRS1)/protein kinase B (Akt)/mammalian target of rapamycin (mTOR)/glycogen synthase kinase 3β (GSK3β), Hippo, cell cycle, Janus kinase (JAK)/signal transducer and activator of transcription (STAT) and nuclear factor-κB (NF-κB) signaling pathways related proteins. The effect of icaritin on differentiation of megakaryocytes was clarified by flow cytometry.A total of 20 target proteins associated to proliferation and differentiation of hematopoietic stem cells were found. In addition, icaritin activated IRS1/Akt/mTOR/GSK3β, cell cycle signaling pathways, inhibited Hippo, JAK/STAT and NF-κB signaling pathways through potentially interacting with ubiquitin carboxyl-terminal esterase L5 (UCHL5), tumor necrosis factor α-induced protein 8 (TNFAIP8) and Visfatin to promote the differentiation of megakaryocytes.Icaritin treats thrombocytopenia through interacting with multiple target proteins including UCHL5, TNFAIP8, and Visfatin.
thrombocytopenia; icaritin; target identification; signaling pathway; megakaryocyte
R285.5
A
0253 - 2670(2021)17 - 5250 - 08
10.7501/j.issn.0253-2670.2021.17.017
2021-06-05
国家自然科学基金资助项目(81973505);国家自然科学基金资助项目(81773932);国家重点研发计划项目(2017YFC1702400,2019YFC1708902)
王岩航(1995—),博士,研究方向为中药作用靶点及药理机制。E-mail: 2011110102@pku.edu.cn
曾克武,沈阳药科大学66期药学(日语)专业校友,研究员,博士生导师,教育部青年长江学者,研究方向为中药作用靶点及药理机制。Tel: (010)82802859 E-mail: ZKW@bjmu.edu.cn
张贵民,研究员,博士生导师,研究方向为新药开发与制剂研究。E-mail: lunanzhangguimin@yeah.net
#共同第一作者:叶效明(1997—),硕士,研究方向为中药作用靶点及药理机制。E-mail: yexiaoming@pku.edu.cn
[责任编辑 李亚楠]
