覆盆子抗氧化和α-葡萄糖苷酶抑制活性成分研究
2021-09-06刘希达刘志惠翟建秀李嗣凯
刘希达,韩 娜,刘志惠,翟建秀,李嗣凯,殷 军
覆盆子抗氧化和α-葡萄糖苷酶抑制活性成分研究
刘希达,韩 娜,刘志惠,翟建秀,李嗣凯,殷 军*
沈阳药科大学中药学院,辽宁 沈阳 110016
研究华东覆盆子干燥果实中抗氧化与抑制α葡萄糖苷酶的活性成分。采用硅胶柱色谱、ODS柱色谱、凝胶柱色谱等多种色谱技术进行系统分离和纯化,利用1H-NMR、13C-NMR波谱数据鉴定化合物的结构。采用DPPH自由基清除和α葡萄糖苷酶抑制活性评价方法,评估化合物的抗氧化及α葡萄糖苷酶抑制活性。从覆盆子70%乙醇提取物的30%乙醇洗脱部位中分离得到16个化合物,分别鉴定为1,2,3,4,6-五没食子酰基-β--吡喃葡萄糖(1)、1,2,6-三没食子酰基-β--吡喃葡萄糖(2)、1-没食子酰基-β--吡喃葡萄糖(3)、原花青素B3(4)、银锻苷(5)、hovetrichoside C(6)、山柰酚-3--β--吡喃葡萄糖苷(7)、阿夫儿茶素-3-β--吡喃葡萄糖苷(8)、槲皮素(9)、methyl flavogallonate(10)、鞣花酸(11)、短叶苏木酚酸甲酯(12)、2,4,6-三羟基苯乙酮-6-β--吡喃葡萄糖苷(13)、没食子酸甲酯(14)、阿魏酸(15)、3,4′-二羟基苯乙酮(16)。化合物10和13为首次从悬钩子属植物中分离得到。化合物1~4、9~12、14具有较好的抗氧化活性,化合物1、2、4、11具有较好的α葡萄糖苷酶抑制活性,化合物1的抗氧化活性与α葡萄糖苷酶抑制活性最强。
覆盆子;抗氧化活性;α-葡萄糖苷酶抑制活性;1,2,3,4,6-五没食子酰基-β--吡喃葡萄糖;methyl flavogallonate;2,4,6-三羟基苯乙酮-6-β--吡喃葡萄糖苷
覆盆子为蔷薇科悬钩子属植物华东覆盆子Hu的干燥成熟果实,主要分布于我国江西、安徽、江苏、浙江和福建,具有益肾固精缩尿、养肝明目等功效。覆盆子的主要成分包括萜类、黄酮类、有机酸类和多糖等[1]。现代药理学研究表明,覆盆子的抗氧化以及降糖活性显著[2-3],且与其酚类化合物有关。为了进一步阐明覆盆子抗氧化和降糖的物质基础,本课题组前期对覆盆子70%乙醇提取物大孔树脂洗脱物进行了初步筛选,发现其30%乙醇洗脱部位具有良好活性,本研究对该部位的化学成分及生物活性进行探究,从中分离得到16个化合物,分别鉴定为1,2,3,4,6-五没食子酰基-β--吡喃葡萄糖(1,2,3,4,6-penta--galloyl-β-- glucoside,1)、1,2,6-三没食子酰基-β--吡喃葡萄糖(1,2,6-penta--galloyl-β--glucoside,2)、1-没食子酰基-β--吡喃葡萄糖(1--glaloyl-β--glucoside,3)、原花青素B3(procyanidin B3,4)、银锻苷(tiliroside,5)、hovetrichoside C(6)、山柰酚-3--β--吡喃葡萄糖苷(kaempferol-3-β-- glueopyranoside,7)、阿夫儿茶素-3-β--吡喃葡萄糖苷[7-β--glucopyranosyl-(−)-afzelechin,8]、槲皮素(quercetin,9)、methyl flavogallonate(10)、鞣花酸(ellagic acid,11)、短叶苏木酚酸甲酯(methyl brevilolin-carboxylate,12)、2,4,6-三羟基苯乙酮-6-β--吡喃葡萄糖苷(2,4,6-trihydroxy-acetophenone- 6-β--glucopyranoside,13)、没食子酸甲酯(methyl gallate,14)、阿魏酸(ferulic acid,15)、3,4′-二羟基苯乙酮(3,4′-dihydroxypropiophenone,16);体外活性结果显示化合物1~4、9~12、14具有较好的抗氧化活性,化合物1、2、4、11具有较好的α葡萄糖苷酶抑制活性,化合物1的抗氧化活性与α葡萄糖苷酶抑制活性最强,为其进一步开发和利用提供依据。
1 仪器与材料
Bruker Avance-600型核磁共振波谱仪、Bruker Avance-400型核磁共振波谱仪(瑞士Bruker Biospin公司);LC-10A高效液相色谱仪(日本Shimadzu公司);Sephadex LH-20凝胶柱(美国Pharmacia公司);柱色谱用硅胶G、GF254(100~200目,青岛海洋化工厂);色谱级甲醇(天津康科德科技有限公司);其他试剂均为分析纯(沈阳莱博试剂公司);ODS-A液相色谱柱(50 μm,日本YMC公司);α葡萄糖苷酶、对硝基苯基-α--吡喃葡萄糖苷(PNPG,上海麦克林生化科技有限公司);1,1-二苯基-2-三硝基苯肼(DPPH,美国Sigma公司);阿卡波糖(批号H19990205,北京拜耳医药保健有限公司);维生素C片(批号H21020713,东北制药集团沈阳第一制药有限公司)。
覆盆子购买自安国市义通中药材有限公司,经沈阳药科大学中药学院生药学教研室殷军教授鉴定为华东覆盆子Hu的干燥成熟果实。
2 提取与分离
取华东覆盆子干燥成熟果实6 kg,粉碎后用50 L 70%乙醇回流提取3次,2 h/次,合并提取液,减压浓缩得7.7 L覆盆子提取物;上样于D101型大孔吸附树脂柱,分别用水及30%、60%、90%乙醇进行梯度洗脱,得30%乙醇洗脱部位(115.0 g)、60%乙醇洗脱部位(330.0 g)和90%乙醇洗脱部位(45.1 g)。
30%乙醇洗脱部位经硅胶柱色谱分离,二氯甲烷-甲醇(20∶1→0∶100)梯度洗脱得到5个流分(Fr. 1~5)。Fr. 1(0.4 g)经硅胶柱色谱分离,二氯甲烷-甲醇(50∶1→1∶1)梯度洗脱得到5个流分(Fr. 1-1~1-5),其中亚流分Fr. 1-1经制备液相分离,以甲醇-水(60∶40)为流动相得到化合物9(3.3 mg)。Fr. 2(0.9 g)经Sephadex LH-20凝胶柱色谱,甲醇等度洗脱得到2个流分(Fr. 2-1~2-2),Fr. 2-1经过反复甲醇重结晶得到化合物10(56.0 mg),Fr. 2-2经制备薄层色谱,醋酸乙酯-甲醇-水(5∶1∶0.9)为流动相得到化合物15(10.0 mg)。Fr. 3(6.7 g)经硅胶柱色谱,二氯甲烷-甲醇-水(30∶1∶0.1→3∶1∶0.1)梯度洗脱后得到2个流分(Fr. 3-1~3-2),Fr. 3-1经Sephadex LH-20凝胶柱色谱,甲醇等度洗脱得到化合物4(6.3 mg),Fr. 3-2经Sephadex LH-20凝胶柱色谱,甲醇等度洗脱得到2个亚流分(Fr. 3-2-1~3-2-2),Fr. 3-2-1经过反复甲醇重结晶得到化合物5(16.5 mg),Fr. 3-2-2经薄层色谱制备[醋酸乙酯-甲醇-水(5∶1∶0.9)]得到化合物6(3.1 mg)和14(2.2 mg)。Fr. 4(20 g)经ODS柱色谱,甲醇-水(20∶80→40∶60)梯度洗脱,得到2个流分(Fr. 4-1~4-2),Fr. 4-1经Sephadex LH-20凝胶柱色谱,甲醇等度洗脱得到2个流分(Fr. 4-1-1~4-1-2),Fr. 4-1-1经制备液相分离纯化[甲醇-水(20∶80)]得到化合物11(2.2 mg,R=35.6 min)、13(3.0 mg,R=42.3 min)和16(11.5 mg,R=52.2 min),Fr. 4-1-2经制备液相分离纯化[甲醇-水(20∶80)]得到化合物1(3.6 mg,R=62.5 min)、2(2.1 mg,R=46.7 min)和3(1.9 mg,R=55.9 min),Fr. 4-2经Sephadex LH-20凝胶柱色谱,甲醇等度洗脱得到化合物12(1.4 mg)。Fr. 5(15 g)经ODS色谱柱分离,甲醇-水(10∶90→30∶70)梯度洗脱得到5个流分(Fr. 5-1~5-5),Fr. 5-1经ODS色谱柱分离,甲醇-水(0∶100→30∶70)梯度洗脱得到化合物7(1.6 mg)和8(2.6 mg)。
3 结构鉴定
化合物1:棕色粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, CD3OD):7.12(2H, s, 1-galloylH-2, 6), 7.06(2H, s, 2-galloylH-2′, 6′), 6.99(2H, s, 3-galloylH-2′, 6′), 6.96(2H, s, 4-galloylH-2′, 6′), 6.91(2H, s, 6-galloylH-2′, 6′), 6.24(1H, d,=8.3 Hz, H-1), 5.91(1H, t,=9.7 Hz, H-3), 5.62(2H, m, H-4), 4.51(1H, dd,=12.2, 1.9 Hz, H-5), 4.40(2H, m, H-6);13C-NMR(150MHz, CD3OD):167.9(1-galloyl-C-7′), 167.2(2-galloyl-C-7′), 166.9(3- galloyl-C-7′), 166.9(4-galloyl-C-7′), 166.2(5-galloyl- C-7′), 146.5(1-galloyl-C-4′), 146.4(2-galloyl-C-4′), 146.4(3-galloyl-C-4′), 146.3(4-galloyl-C-4′), 146.2(5-galloyl-C-4′), 140.7(1-galloyl-C-3′, 5′), 140.3(2-galloyl-C-3′, 5′), 140.2(3-galloyl-C-3′, 5′), 140.0(4-galloyl-C-3′, 5′), 139.9(5-galloyl-C-3′, 5′), 121.0(1-galloyl-C-1′), 120.3(2-galloyl-C-1′), 120.2(3- galloyl-C-1′), 120.2(4-galloyl-C-1′), 119.7(5-galloyl- C-1′), 110.6(1-galloyl-C-2′, 6′), 110.4(2-galloyl-C-2′, 6′), 110.4(3-galloyl-C-2′, 6′), 110.3(4-galloyl-C-2′, 6′), 110.3(5-galloyl-C-2′, 6′), 93.8(GlcC-1), 74.3(GlcC-5), 74.0(GlcC-3), 72.1(Glc-C-2), 69.8(Glc-C-4), 63.1(GlcC-6)。根据以上数据并结合文献报道[4],推断化合物1为1,2,3,4,6-五没食子酰基-β--吡喃葡萄糖。
化合物2:棕色粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 6.96(2H, s, 1-galloylH-2, 6), 6.91(2H, s, 2-galloylH-2, 6), 6.87(2H, s, 6-galloylH-2, 6), 5.89(1H, d,=8.4 Hz, H-1), 5.03(1H, t,=9.0 Hz, H-3), 4.43(1H, d,=12.0 Hz, H-4), 4.31(1H, dd,=12.2, 4.9 Hz, H-2), 4.22(1H, t,=6.6 Hz, H-5), 3.81(2H, m, H-6);13C-NMR(150MHz, DMSO-6): 165.7(1-galloyl- C-7′), 164.9(2-galloyl-C-7′), 164.1(6-galloyl-C-7′), 145.6 (1-galloyl-C-4′), 145.5 (2-galloyl-C-4′), 145.4 (6-galloyl-C-4′), 138.6(1-galloyl-C-3′, 5′), 138.6(2- galloyl-C-3′, 5′), 138.5(6-galloyl-C-3′, 5′), 119.3(1- galloyl-C-1′), 119.1(2-galloyl-C-1′), 118.9(6-galloyl- C-1′), 108.9(1-galloyl-C-2′, 6′), 108.7(2-galloyl-C-2′, 6′), 108.6(6-galloyl-C-2′, 6′), 92.1(GlcC-1), 74.7(Glc-C-5), 73.6(GlcC-3), 72.6(GlcC-2), 69.5(GlcC-4), 65.0(GlcC-6)。根据以上数据并结合文献报道[5],推断化合物2为1,2,6-三没食子酰基-β--吡喃葡萄糖。
化合物3:白色粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, D2O)δ: 7.18(2H, s, H-2, 6), 5.71(1H, d,=7.2Hz, GlcH-1), 3.89(1H, dd,=12.4, 1.5Hz, GlcH-3), 3.73(1H, dd,=12.5, 5.4Hz, GlcH-4), 3.61(3H, t,=7.1Hz, GlcH-6, 2), 3.48(1H, t,=9.0Hz, GlcH-5);13CNMR(150MHz, D2O): 169.4(C-7), 147.4(C-3, 5), 142.1(C-4), 121.9(C-1), 113.2(C-2, 6), 97.2(GlcC-1), 79.7(GlcC-3), 78.3(GlcC-5), 74.9(GlcC-2), 72.0(GlcC-4), 63.2(GlcC-6)。根据以上数据并结合文献报道[6],推断化合物3为1-没食子酰基-β--吡喃葡萄糖。
化合物4:黄色无定形粉末,紫外灯254nm下有暗斑,硅胶板薄层喷10%硫酸乙醇溶液显黄色。1H-NMR(600MHz, DMSO-6): 6.84(1H, d,=2.0Hz, H-2′), 6.77(1H, dd,=8.3, 2.1Hz,H-6′), 6.69(1H, d,=8.1Hz, H-5′), 6.60(1H, d,=2.1Hz, H-2′′′), 6.59(1H, dd,=8.2, 2.1Hz, H-6′′′), 6.57(1H, d,=8.2Hz, H-5′′′), 5.85(1H, s, H-6′′), 5.74(1H, d,=2.4Hz, H-6), 5.67(1H, d,=2.4Hz, H-8), 4.38(1H, d,=8.4Hz, H-2), 4.26(1H, d,=8.4Hz, H-2′′), 4.22(1H, m, H-3), 4.15(1H, d,=8.4Hz, H-4), 2.78(1H, dd,=16.2, 8.4Hz, H-4′′a), 2.33(1H, dd,=16.2, 8.4Hz, H-4′′b);13C-NMR(150MHz, DMSO-6): 159.5(C-9), 157.3(C-7), 154.6(C-5), 154.2(C-7′′), 153.5(C-9′′), 153.4(C-5′′), 144.8(C-3′), 144.6(C-3′′′), 144.2(C-4′′′), 144.0(C-4′), 129.1(C-1′′′), 128.9(C-1′), 118.8(C-6′), 117.6(C-6′′′), 115.3(C-5′′′), 114.9(C-2′), 114.6(C-5′), 114.3(C-2′′′), 108.4(C-8′′), 106.2(C-10), 105.8(C-10′′), 98.9(C-6)98.5(C-6′′), 95.5(C-8), 82.3(C-2), 81.4(C-2′′), 71.7(C-3), 67.0(C-3′′), 37.2(C-4), 29.0(C-4′′)。根据以上数据并结合文献报道[7],推断化合物4为原花青素B3。
化合物5:黄色无定形粉末,紫外灯254nm下有暗斑,硅胶板薄层喷10%硫酸乙醇溶液显黄色。1H-NMR(600MHz, DMSO-6): 7.99(2H, d,=8.8Hz, H-2′, 6′), 7.37(2H, d,=8.6Hz, H-2′′, 6′′), 7.34(1H, d,=16.0Hz, H-7′′), 6.86(2H, d,=8.8Hz, H-3′, 5′), 6.79(2H, d,=8.6Hz, H-3′′, 5′′), 6.39(1H, d,=2.1Hz, H-6), 6.15(1H, d,=2.1Hz, H-8), 6.11(1H, d,=15.9Hz, H-8′′), 5.45(1H, d,=6.1 Hz, GlcH-1), 5.24(1H, d,=5.7Hz, GlcH-3), 5.18(1H, d,=4.9Hz, GlcH-4), 4.27(1H, dd,=11.9, 2.1Hz, GlcH-2), 4.03(1H, dd,=11.8, 6.3Hz, GlcH-5), 3.20(2H, m, GlcH-6);13C-NMR(150MHz, DMSO-6): 177.4 (C-4), 166.1(C-9′′), 164.2(C-7), 161.1(C-5), 160.0(C-4′), 159.8(C-4′′), 156.4(C-2), 156.3(C-9), 144.6(C-7′′), 133.0(C-3), 130.8 (C-2′, 6′), 130.1(C-2′′, 6′′), 124.9(C-1′′), 120.7(C-1′), 115.7(C-3′, 5′), 115.0(C-3′, 5′), 113.6 (C-8′′), 103.8(C-10), 100.9(GlcC-1), 98.7(C-6), 93.6(C-8), 76.2(GlcC-2), 74.2(Glc-C-5), 74.1(GlcC-3), 69.9(GlcC-4), 62.9(GlcC-6)。根据以上数据并结合文献报道[8],推断化合物5为银锻苷。
化合物6:黄色无定形粉末,紫外灯254nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(400MHz, DMSO-6): 6.93(2H, t,=7.3 Hz,H-2′, 6′), 6.55(2H, d,=8.1 Hz, H-3′, 5′), 6.01(1H, s, H-5), 5.91(1H, s, H-7), 4.93(1H, d,=6.7Hz, GlcH-1), 3.65(1H, m, GlcH-3), 3.47(1H, m, GlcH-4), 3.25(4H, m, GlcH-2, 5, 6), 2.92(2H, m, H-b);13C-NMR(100MHz, DMSO-6): 192.6 (C-3), 171.9 (C-7a),168.8 (C-6), 156.8 (C-4), 156.7 (C-4′), 131.3 (C-2′, 6′), 124.2 (C-1′), 114.7 (C-3′, 5′), 105.5 (C-2), 101.8 (C-3a), 99.4 (GlcC-1), 96.0 (C-5), 91.8 (C-7), 77.2 (Glc-C-5), 76.8 (GlcC-3), 72.9 (GlcC-2), 69.3 (GlcC-4), 60.4 (GlcC-6), 40.4 (C-b)。根据以上数据并结合文献报道[9],推断化合物6为hovetrichosideC。
化合物7:黄色无定形粉末,紫外灯254nm下有暗斑,硅胶板薄层喷10%硫酸乙醇溶液显黄色。1H-NMR(600MHz, DMSO-6): 8.07(2H, d,=8.8Hz, H-2′, 6′), 6.86(2H, d,=8.8Hz, H-3′, 5′), 6.41(1H, d,=2.1Hz, H-8), 6.19(1H, d,=2.1Hz, H-6), 5.40(1H, d,=7.6Hz, GlcH-1), 5.19(1H, d,=4.7Hz, H-2), 4.86(1H, d,=5.7Hz, GlcH-3), 4.50(1H, d,=4.1Hz, H-3), 4.50(1H, d,=5.83Hz, GlcH-4), 3.66(1H, d,=3.5Hz, GlcH-2), 3.54(1H, ddd,=9.2, 7.5, 3.8Hz, GlcH-5), 3.47~3.44(1H, m, GlcH-6);13C-NMR(150MHz, DMSO-6): 177.9 (C-4), 165.0 (C-7), 161.6 (C-5), 160.4 (C-4′), 156.8 (C-9), 156.7 (C-2), 133.6 (C-3), 131.4 (C-2′, 6′), 121.3 (C-1′), 115.5 (C-3′, 5′), 104.2 (C-10), 102.1 (Glc, C-1), 99.2 (C-6), 94.1 (C-8), 76.2 (Glc-C-5), 73.5 (Glc-C-3), 71.6 (Glc-C-2), 68.3 (Glc-C-4), 60.6 (Glc-C-6)。根据以上数据并结合文献报道[10],推断化合物7为山柰酚-3--β--吡喃葡萄糖苷。
化合物8:黄色无定形粉末,紫外灯254nm下有暗斑,硅胶板薄层喷10%硫酸乙醇溶液显黄色。1H-NMR(600MHz, DMSO-6): 7.16(2H, d,=8.5Hz, H-2′, 6′), 6.75(2H, d,=8.5Hz, H-3′, 5′), 6.13(1H, d,=2.2Hz, H-8), 5.89(1H, d,=2.2Hz, H-6), 4.72(1H, d,=7.6Hz, GlcH-1), 4.55(1H, d,=7.9Hz, H-2), 3.84(1H, td,=8.3, 5.5Hz, H-3), 3.70~3.67(1H, m, GlcH-6a), 3.50(1H, m, GlcH-6b), 3.21(4H, dd,=15.8, 8.3Hz, GlcH-2~5), 2.93(1H, dd,=16.3, 5.5Hz, H-4), 2.40(1H, d,=8.5Hz, H-4);13C-NMR(150MHz, DMSO-6):156.9 (C-7), 156.6 (C-5), 156.3 (C-9), 155.0 (C-4′), 129.8 (C-1′), 128.6 (C-2′, 6′), 114.8 (C-3′, 5′), 101.4 (C-10), 100.6 (Glc- C-1), 96.1 (C-8), 95.0 (C-6), 81.1 (C-2), 76.9 (Glc- C-4), 76.5 (Glc-C-5), 73.2 (Glc-C-3), 69.5 (Glc-C-2), 66.1 (C-3), 60.5 (Glc-C-6), 28.0 (C-4)。根据以上数据并结合文献报道[11],推断化合物8为阿夫儿茶素-3-β--吡喃葡萄糖苷。
化合物9:黄色无定形粉末,紫外灯254nm下有暗斑,365nm下有蓝色荧光,硅胶板薄层喷10%硫酸乙醇溶液显黄色。1H-NMR(400MHz, DMSO-6): 12.48(1H, s, 5-OH), 10.76(1H, s, 3-OH), 9.57(1H, s, 7-OH), 9.34(1H, s, 4′-OH), 9.28(1H, s, 5′-OH), 7.67(1H, d,=2.2Hz, H-2′), 7.54(1H, dd,=8.5, 2.2Hz, H-6′), 6.88(1H, d,=8.5Hz, H-5′), 6.40(1H, d,=2.0Hz, H-6), 6.18(1H, d,=2.0Hz, H-8);13CNMR(100MHz, DMSO-6): 175.8 (C-4), 163.8 (C-7), 160.7 (C-5), 156.1 (C-9), 147.6 (C-4′), 146.7 (C-3′), 145.0 (C-2), 135.7 (C-3), 121.9 (C-1′), 119.9 (C-6′), 115.5 (C-5′), 115.0 (C-2′), 103.0 (C-10), 98.1 (C-6), 93.3 (C-8)。根据以上数据并结合文献报道[12],推断化合物9为槲皮素。
化合物10:淡黄色无定形粉末,易溶于甲醇,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 7.48(1H, s, H-5′), 7.09(1H, s, H-6′′), 3.44(3H, s, 7′′-OCH3);13C-NMR(150MHz, DMSO-6): 166.5 (C-7′′), 159.6 (C-7′), 157.8 (C-7), 148.2 (C-4′), 146.5 (C-4), 144.4 (C-5′′), 144.0 (C-3′′), 139.6 (C-3′), 138.6 (C-3), 137.8 (C-2′), 136.8 (C-2), 135.9 (C-4′′), 125.8 (C-1′′), 119.2 (C-6), 118.6 (C-2′′), 113.1 (C-1′), 112.0 (C-1), 110.4 (C-6), 109.6 (C-5), 107.9 (C-5′), 107.8 (C-6′′), 51.4 (-OCH3)。根据以上数据并结合文献报道[13],推断化合物10为methylflavogallonate。
化合物11:白色无定形粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 7.29(1H, s, H-3, 3′);13C-NMR(150MHz, DMSO-6): 160.6 (C-7, 7′), 149.4 (C-6, 6′), 139.5 (C-4, 4′), 136.4 (C-5, 5′), 113.8 (C-1, 1′), 111.0 (C-2, 2′), 108.4 (C-3, 3′)。根据以上数据并结合文献报道[14],推断化合物11为鞣花酸。
化合物12:淡黄色针状晶体,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 7.30(1H, s, H-7), 4.42(1H, dd,=7.8, 2.1Hz, H-9), 3.63(3H, s, 9b-OCH3), 2.98(1H, dd,=18.7, 7.8Hz, H-10b), 2.47(1H, dd,=18.8, 2.1Hz, H-10a);13C-NMR(150MHz, DMSO-6): 193.5 (C-11), 173.0 (C=O), 160.6 (C-8), 150.1 (C-6), 146.2 (C-2), 144.1 (C-4), 141.0 (C-5), 138.9 (C-3), 115.4 (C-7a), 113.3 (C-3a), 108.5 (C-7), 52.5 (-OCH3), 41.0 (C-9), 37.4 (C-10)。根据以上数据并结合文献报道[15],推断化合物12为短叶苏木酚酸甲酯。
化合物13:淡黄色针状晶体,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 6.01(1H, s, H-3), 5.79(1H, s, H-5), 4.88(1H, d,=7.1Hz, GlcH-1), 3.69(1H, GlcH-3), 3.50(1H, d,=5.2Hz, GlcH-4), 3.30(2H, GlcH-2, 5), 3.21(2H, m, GlcH-6), 2.59(3H, s, H-8);13C-NMR(150MHz, DMSO-6): 201.7 (C=O), 167.6 (C-4), 166.0 (C-2), 161.1 (C-6), 103.7 (C-1), 100.6 (GlcC-1), 97.1 (C-3), 95.1 (C-5), 77.1 (GlcC-5), 76.7 (GlcC-3), 73.1 (GlcC-2), 69.4 (GlcC-4), 60.4 (GlcC-6), 32.6 (-CH3)。根据以上数据并结合文献报道[16],推断化合物13为2,4,6-三羟基苯乙酮-6-β--吡喃葡萄糖苷。
化合物14:白色粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(400MHz, DMSO-6): 6.94(2H, s, H-2, 6), 3.74(3H, s, 7-OCH3);13C-NMR(100MHz, DMSO-6): 166.3 (C-7), 145.6 (C-3, 5), 138.4 (C-4), 119.3 (C-1), 108.5 (C-2, 6), 51.5 (-OCH3)。根据以上数据并结合文献报道[17],推断化合物14为没食子酸甲酯。
化合物15:无色针状结晶,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6):7.48(1H, d,=15.9Hz, H-8), 7.27(1H, d,=2.0Hz, H-2), 7.07(1H, dd,=8.1, 2.0Hz, H-6), 6.78(1H, d,=8.1Hz, H-5), 6.36(1H, d,=15.9Hz, H-7), 3.81(3H, s, -OCH3);13C-NMR(150MHz, DMSO-6): 168.5 (C-9), 149.5 (C-3), 148.3 (C-4), 144.9 (C-7), 126.2 (C-1), 123.2 (C-6), 116.1 (C-8), 115.9 (C-5), 111.5 (C-2), 56.1 (-OCH3)。根据以上数据并结合文献报道[18],推断化合物15为阿魏酸。
化合物16:白色无定形粉末,紫外灯254 nm下有暗斑,硅胶板薄层喷2% FeCl3乙醇溶液显蓝黑色。1H-NMR(600MHz, DMSO-6): 7.82(2H, d,=8.7Hz, H-2, 6), 6.82(2H, d,=8.8Hz, H-3, 5), 3.74(2H, t,=6.4Hz, H-8), 3.02(2H, t,=6.4Hz, H-9);13C-NMR(150MHz, DMSO-6): 197.5 (C-7), 163.0 (C-4), 131.0 (C-2, 6), 128.7 (C-1), 115.7 (C-3,5), 57.6 (C-8), 41.3 (C-9)。根据以上数据并结合文献报道[19],推断化合物16为3,4′-二羟基苯乙酮。
4 活性测试
4.1 化合物体外抗氧化活性的测定
覆盆子提取物及各洗脱部位用于测定的质量浓度为15.625~500.000 μg/mL,各单体化合物用于测定的浓度为15.625~500.000 μmol/L。参照文献方法[20]并进行适当改进,在96孔板中加入100 µL不同浓度的样品,再加入100 µL含0.2 mmol/L DPPH的甲醇溶液;空白组加入100 µL甲醇和100 µL DPPH自由基溶液;背景组加入100 µL样品和100 µL甲醇。避光放置20 min,测定517 nm处的吸光度()值,按照公式计算清除率。以维生素C为阳性对照药物,每个样品平行测试3次。覆盆子提取物和各洗脱部位的抗氧化活性见表1,16个单体化合物的抗氧化活性见表2。
清除率=1-(样品-背景)/空白
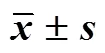
表1 覆盆子提取物和各洗脱部位的抗氧化活性(, n = 3)
与维生素C组比较:**<0.01,表2同
**< 0.01vitamin C group, same as table 2
4.2 化合物对α-葡萄糖苷酶抑制活性的测定
覆盆子提取物及各洗脱部位用于测定的质量浓度为15.625~500.000 μg/mL,各单体化合物用于测定的浓度为15.625~500.000 μmol/L。参照文献方法[21]并进行适当改进,在96孔板中加入20 μL不同浓度的样品、20 μL PBS溶液(0.1 mol/L)和20 μL α葡萄糖苷酶(1.3 U/mL);样品背景组加入20 μL样品和40 μL PBS溶液;空白组加入20 µL 2% DMSO、20 µL PBS溶液和20 µL α-葡萄糖苷酶;空白背景组加入20 µL 2% DMSO和40 µL PBS溶液;混匀后于37 ℃活化5 min,加入20 μL PNPG(2.5 mmol/L)于37 ℃反应15 min,再加入80 μL Na2CO3(0.2 mol/L)终止反应,测定405 nm处的值,按照公式计算抑制率。以阿卡波糖为阳性对照药物,每个样品平行测试3次。覆盆子提取物和各洗脱部位的α-葡萄糖苷酶抑制活性见表3,16个单体化合物的α-葡萄糖苷酶抑制活性见表4。
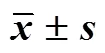
表2 16个单体化合物的抗氧化活性(, n = 3)
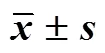
表3 覆盆子提取物和各洗脱部位的α-葡萄糖苷酶抑制活性(, n = 3)
与阿卡波糖组比较:**<0.01,表4同
**< 0.01acarbose group, same as Table 4
抑制率=1-(样品-样品背景)/(空白-空白背景)
5 讨论
本研究从覆盆子醇提物的30%乙醇洗脱部位中分离并鉴定了16个单体化合物,包括3个鞣质类化合物、6个黄酮类化合物、3个内酯类化合物和4个苯酚类化合物。其中化合物10和13为首次从悬钩子属中分离得到。由活性数据可知,30%乙醇洗脱部位的抗氧化活性及α葡萄糖苷酶抑制活性均为最强,表明经过不同比例的乙醇-水洗脱后,覆盆子抗氧化及抑制α葡萄糖苷酶的活性成分得到了有效富集。化合物1的清除DPPH自由基活性以及α葡萄糖苷酶抑制活性最强,其IC50分别为(2.36±1.08)、(2.41±0.11)μmol/L。本研究结果进一步丰富了覆盆子的化学物质组成和生物学活性信息,为覆盆子的开发利用提供了研究基础和依据。
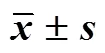
表4 16个单体化合物的α-葡萄糖苷酶抑制活性(, n = 3)
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang T T, Liu Y J, Yang L,. Extraction of antioxidant and antiproliferative ingredients from fruits ofHu by active tracking guidance [J]., 2017, 8(8): 1673-1680.
[2] Zhang T T, Jiang J G. Analyses on essential oil components from the unripe fruits ofHu by different methods and their comparative cytotoxic and anti-complement activities [J]., 2015, 8(4): 937-944.
[3] 谢欣梅, 庞晓斌, 李晓婷. 覆盆子酮对糖尿病模型小鼠的降血糖作用及其机制研究 [J]. 中国药学杂志, 2012, 47(23): 1899-1904.
[4] Santos R T D, Hiramoto L L, Lago J H G,. Anti-trypanosomal activity of 1,2,3,4,6-penta--galloyl- β--glucose isolated fromAndrews (Lamiaceae) [J]., 2012, 35(11): 2229-2332.
[5] Yakubu O F, Adebayo A H, Dokunmu T M,. Cytotoxic effects of compounds isolated from[J]., 2019, 24 (1): 145.
[6] Zhang Y J, DeWitt D L, Murugesan S,. Novel lipid-peroxidation- and cyclooxygenase-inhibitory tannins fromseeds [J]., 2004, 1(3): 426-441.
[7] Yang S Y, Tian W J, Pan Z R,. Polyphenols fromreactivate latent HIV [J]., 2020, 56(2): 318-322.
[8] Fernandes D A, Souza M S R, Teles Y C F,. New sulphated flavonoids and larvicidal activity ofK. Schum (Sterculiaceae) [J]., 2018, 23(11): 2784.
[9] Wu S B, Wen Y, Li X W,. Chemical constituents from the fruits ofand(Sonneratiaceae) [J]., 2009, 37(1): 1-5.
[10] 王洪庆, 赵春阳, 陈若芸. 乌桕叶化学成分研究 [J]. 中国中药杂志, 2007, 32(12): 1179-1181.
[11] Su J, Wu Z J, Shen Y H,. Flavonoids fromNitsche [J]., 2008, 22(15): 1355-1358.
[12] 赵凡, 戴湾, 李翎熙, 等. 血三七正丁醇部位化学成分的研究 [J]. 中成药, 2020, 42(9): 2346-2350.
[13] Fang X Y. Chemical constituents from the leaves of[J]., 2018, 27(1): 40-50.
[14] da Silva S L, Calgarotto A K, Chaar J S,. Isolation and characterization of ellagic acid derivatives isolated fromSW aqueous extract with anti-PLA2 activity [J]., 2008, 52(6): 655-666.
[15] 肖洪明, 祖灵博, 李石平, 等. 掌叶覆盆子化学成分的研究 [J]. 中国药物化学杂志, 2011, 21(3): 220-226.
[16] Sidana J, Neeradi D, Choudhary A,. Antileishmanial polyphenols from[J]., 2013, 125(4): 765-775.
[17] 尚小雅, 李帅, 王映红, 等. 红绒毛羊蹄甲的化学成分研究 [J]. 中国中药杂志, 2006, 31(23): 1953-1955.
[18] 杨学东, 徐丽珍, 杨世林. 蝉翼藤茎中有机酸成分的研究[J]. 中国中药杂志, 2001, 26(4): 258-260.
[19] Lee M W, Tanaka T, Nonaka G I,. Phenolic compounds on the leaves ofvar.[J]., 1992, 15(3): 211-214.
[20] Brand-Williams W, Cuvelier M E, Berset C. Use of a free radical method to evaluate antioxidant activity [J].-, 1995, 28(1): 25-30.
[21] Matsui T, Ueda T, Oki T,. alpha-Glucosidase inhibitory action of natural acylated anthocyanins. 1. Survey of natural pigments with potent inhibitory activity [J]., 2001, 49(4): 1948-1951.
Active components of antioxidation and αglucosidase inhibitory from
LIU Xi-da, HAN Na, LIU Zhi-hui, ZHAI Jian-xiu, LI Si-kai, YIN Jun
School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
To investigate the active components which have antioxidant and αglucosidase inhibitory activities of dry fruits from.The fraction was separated and purified by silica gel column chromatography, ODS column chromatography, gel column chromatography. The structures of compounds were identified by1H-NMR and13C-NMR spectral data. DPPH radical scavenging and α-glucosidase inhibitory activity evaluation methods were used to assess the antioxidant and α-glucosidase inhibitory activities of compounds.Sixteen compounds were isolated from 30% ethanol elution site of the ethanolic extract from. The structures of these compounds were identified by spectroscopic analysis as 1,2,3,4,6-penta--galloyl-β--glucoside (1), 1,2,6-penta--galloyl-β--glucoside (2), 1--glaloyl-β--glucoside (3), procyanidin B3(4), tiliroside (5), hovetrichoside C (6), kaempferol-3-β--glueopyranoside (7), 7-β--glucopyranosyl-(−)-afzelechin (8), quercetin (9), methyl flavogallonate (10), ellagic acid (11), methyl brevilolin-carboxylate (12), 2,4,6-trihydroxy-acetophenone- 6-β--glucopyranoside (13), methyl gallate (14), ferulic acid (15), and 3,4′-dihydroxypropiophenone (16).Compounds 10 and 13 are firstly isolated from the genus. Compounds 1—4, 9—12, and 14 have good antioxidant effects, compounds 1, 2, 4, and 11 have good inhibitory activity of αglucosidase. Compound 1 has the best antioxidant activity and inhibitory activity of α-glucosidase.
Hu; antioxidant activity; αglucosidase inhibitory activity; 1,2,3,4,6-penta--galloyl-β--glucoside; methyl flavogallonate; 2,4,6-trihydroxy-acetophenone- 6-β--glucopyranoside
R284.1
A
0253 - 2670(2021)17 - 5226 - 07
10.7501/j.issn.0253-2670.2021.17.014
2021-06-27
刘希达(1996—),男,硕士。E-mail: 441590920@qq.com
殷 军(1965—),女,沈阳药科大学51期中药、1992级硕士生药学专业及1999级博士天然药物化学专业校友,双博士、教授、博士生导师,辽宁省特聘教授,辽宁省百千万人才“百人”层次,中国药典委员会委员,辽宁省药学会中药与天然药物专业委员会主任委员,曾获全国优秀药师、国家中医药管理局中医药科技进步奖等多项奖励。Tel: (024)43520717 E-mail: yinjun826@sina.com
[责任编辑 李亚楠]
