矮紫杉中紫杉烷类成分及其抗肿瘤活性研究
2021-09-06孙业青程子芪冯宝民
卢 轩,孙业青,程子芪,冯宝民
矮紫杉中紫杉烷类成分及其抗肿瘤活性研究
卢 轩,孙业青,程子芪,冯宝民*
大连大学生命科学与生物技术学院,辽宁 大连 116622
研究矮紫杉cv. Nana中紫杉烷类化合物成分及其抗肿瘤活性,以期发现红豆杉资源的替代品种。采用高通量测序技术进行转录组测序,并采用分子对接的方式初步预测矮紫杉具有产生紫杉烷类化合物的能力。采用硅胶、Sephadex LH-20和HPLC等色谱方法进行分离纯化,并根据理化性质及波谱学数据鉴定结构。采用噻唑蓝(MTT)法、流式细胞术、Western blotting等方式,以肺癌NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR、胃癌AGS细胞以及肝癌HepG 2细胞为模型,对所分离鉴定的部分化合物进行体外抗肿瘤活性评价。从分子层面上验证矮紫杉具有代谢产生紫杉烷类化合物的能力,在此基础上从矮紫杉中分离得到6个紫杉烷类化合物,分别鉴定为紫杉醇(taxol,1)、三尖杉宁碱(cephalomannine,2)、巴卡亭III(baccatin III,3)、2-去乙酰氧基紫杉宁J(2-deacetoxytaxinine J,4)、2-去乙酰氧基-13-去乙酰去桂皮酰-紫杉宁J(2-deacetyloxy-13-deacetyldecinnamyl-taxinine J,5)、2-去乙酰氧-5α-羟基紫杉宁J(2-deacetoxy-5α-hydroxytaxinine J,6)。化合物1~3对目标细胞株均具有良好的抗肿瘤活性。栽培品种矮紫杉具有代谢产生紫杉烷类化合物的能力,可以在一定程度上作为红豆杉替代资源使用。
矮紫杉;紫杉醇;三尖杉宁碱;巴卡亭III;2-去乙酰氧基紫杉宁J;2-去乙酰氧基-13-去乙酰去桂皮酰-紫杉宁J;2-去乙酰氧-5α-羟基紫杉宁J;资源替代;分子模拟;抗肿瘤活性
紫杉烷类化合物是一类广谱、高效、不良反应较小的天然抗肿瘤药物,是治疗晚期卵巢癌、晚期乳腺癌、非小细胞癌、肺癌、食道癌等疾病的重要药物[1]。紫杉烷类化合物的结构特点就是骨架类型多,取代基多而且几乎都是含氧功能基团,紫杉烷类化合物为二萜类化合物,按其骨架可分为9大类,包括五元环、六元环、七元环、八元环、十元环和十二元环等[2]。其主要植物来源为红豆杉,目前世界上共有天然野生红豆杉属植物11种,大部分分布在在温带地区以及热带地区,还有少数一部分分布在北美洲。天然红豆杉生长周期长、生长条件要求苛刻,在我国被列为稀有和濒危植物资源,且紫杉醇及其衍生物的含量低,无法满足临床需求[3]。因此寻找替代资源仍为一个研究热点。矮紫杉cv. Nana为东北红豆杉的变种,具有株形矮、分枝多、生长快等特点[4],可大量栽培,对于矮紫杉化学成分的研究目前较少,根据化学成分种属同源理论,推测矮紫杉可能作为红豆杉替代资源使用。
紫杉二烯合酶作为紫杉烷类化合物生物合成的第一个关键酶,它的主要功能为催化牦牛儿基牦牛儿基焦磷酸(GGPP)环化生成紫杉烯[taxa-4(5),11(12)-diene],此步反应的目的是生成紫杉醇化合物的独特骨架结构,因此紫杉二烯合酶为目前用于判断前体复合物能否合成紫杉醇的关键酶[5]。在植物体内,如果含有紫杉二烯合酶那么就可以表明植物中具有紫杉醇生物合成途径基因的同源基因,这是一个强有力的基因证据[6]。因此本实验首先对矮紫杉中紫杉二烯合酶基因进行研究,在此基础上进行模拟分子对接,初步判断矮紫杉是否具有代谢产生紫杉烷类化合物的能力。进而采用经典色谱方法从矮紫杉95%乙醇提取物中分离得到6个紫杉烷类化合物,分别鉴定为紫杉醇(taxol,1)、三尖杉宁碱(cephalomannine,2)、巴卡亭III(baccatin III,3)、2-去乙酰氧基紫杉宁J(2-deacetoxytaxinine J,4)、2-去乙酰氧基-13-去乙酰去桂皮酰-紫杉宁J(2-deacetyloxy-13- deacetyldecinnamyl-taxinine J,5)、2-去乙酰氧-5α-羟基紫杉宁J(2-deacetoxy-5α- hydroxytaxinine J,6)。由于三尖杉宁碱和巴卡亭III与紫杉醇具有相同的母核结构,且具有构成活性的关键基团之一的四元环,因此选取三尖杉宁碱和巴卡亭III这2个化合物与紫杉醇做对照进行抗肿瘤活性研究。以肺癌NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR、胃癌AGS细胞以及细胞HepG2肝癌为模型,通过MTT法检测对不同人源性肿瘤细胞增殖的抑制作用,采用流式细胞术检测对不同人源性肿瘤细胞凋亡的促进作用,通过Western blotting检测凋亡相关标志物的表达水平观测对肿瘤细胞Cleaved-caspase 3表达的影响。
1 仪器与材料
LC-20AR 型高效液相色谱仪(日本岛津公司);Bruker 500 HMz核磁共振仪(德国Bruker公司);IKA RV8/BH 10旋转蒸发仪(德国IKA集团);VARIOSKAN FLASH型多功能全波长酶标仪(美国Thermo Fisher公司);柱色谱硅胶(200~300目,青岛海洋化工公司);GF254/H薄层色谱硅胶(青岛海洋化工公司);Sephadex LH-20凝胶(GE Healthcare公司)。
样品采自大连大学校内,经《中国植物志》比对鉴定为矮紫杉cv. Nana。对照品紫杉醇购自Solarbio公司,质量分数大于98%,实验用肺癌NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR、胃癌AGS细胞以及肝癌HepG2细胞,购于中国科学院上海细胞库,MTT试剂盒(杭州联科生物技术股份有限公司),所用试剂为分析纯和色谱纯。
2 基因测序与分子模拟
利用高通量测序技术对红豆杉属的近缘属中的代表植物东北红豆杉、大连大学校园内矮紫杉进行转录组测序,得到其中紫杉二烯合酶[taxa- 4(5),11(12)-diene synthease,TS]基因的同源基因。随后将测序2组TS通过DNAman翻译为氨基酸序列,加上一组文献报道的序列[7]共3组,经序列对比共有5个不同氨基酸。在此基础上进行同源模建和初步分子对接,通过叠合建模蛋白A、B、C和模板蛋白的结构,根据模板蛋白的结合位点确定了蛋白A、B、C潜在结合位点,根据已知条件可设置Grid Box坐标以及盒子大小,并采用Autodock vina.1.1.2进行分子对接。将exhaustiveness参数调整为20,其目的为增加计算的准确性。无特别注明情况,其他参数均设置为默认值。最后,选取结合能打分最高的构象用Free Meastro 11.9进行结作图分析。结果见表1和图1。结果表明,矮紫杉中紫杉二烯合酶序列与东北红豆杉略有差异,但是不影响其与底物GGPP结合的能力,据此推测矮紫杉具有代谢产生紫杉烷类化合物的能力。
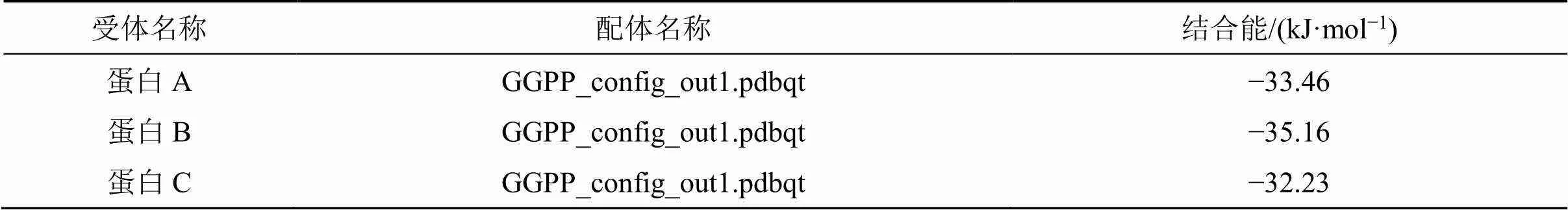
表1 蛋白A~C与GGPP结合能
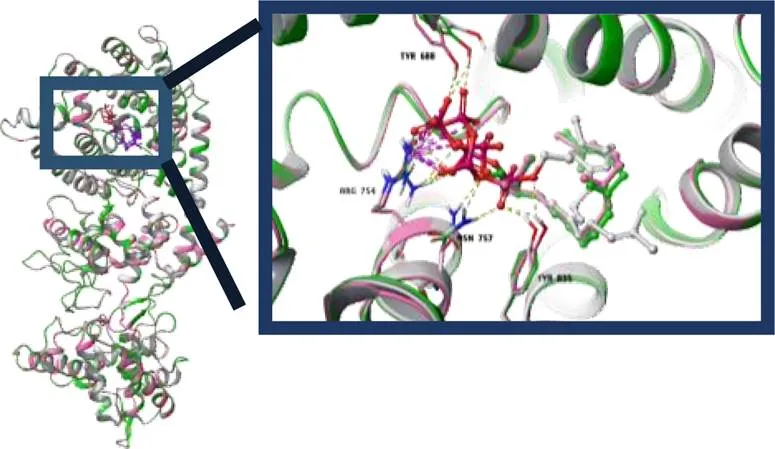
图1 蛋白A、B、C与小分子结合的叠合
3 提取与分离
矮紫杉枝叶干燥粉碎(1.8 kg),95%乙醇超声提取3次,每次30 min,得乙醇提取物(150.8 g)。依次使用等体积石油醚、二氯甲烷萃取,二氯甲烷层萃取液减压浓缩得浸膏(45.2 g)。
二氯甲烷层浸膏(45.2 g)经硅胶柱色谱(200~300目)分离,二氯甲烷-甲醇(100∶0→100∶100)梯度洗脱,得到203个流分。根据薄层色谱结果,将各流分合并为17个子流分(Fr. G1~G17),结合高效液相色谱分析结果,其中Fr. G6、G7含紫杉烷类化合物最多。
进一步采用Sephadex LH-20凝胶色谱(甲醇)对G6、G7进行分离得146个流分(Fr. N1~N146),其中N7、N12、N15含有紫杉烷类化合物最多。采用制备型高效液相色谱对N7、N12、N15进行分离纯化,检测波长227、274 nm,进样量为200 μL,体积流量4.0 mL/min,采用LC-20AR检测器,Ultimate XB-C18色谱柱,N7在乙腈-水(45∶55)的条件下经分离纯化得化合物1(15 mg)、2(26 mg)、3(21 mg),N12在乙腈-水(45∶55)的条件下经分离纯化得化合物4(8 mg),N15在乙腈-水(45∶55)的条件下经分离纯化得化合物5(18 mg)、6(14 mg)。
4 结构鉴定
化合物1:白色针型晶体(甲醇),紫外254 nm处有明显暗色斑点。1H-NMR (500 MHz, CDCl3): 1.15 (3H, s), 1.24 (3H, s), 1.69 (3H,s), 1.79 (3H, s) 是4个甲基信号为紫杉烷类化合物特征峰;2.24 (s, 3H), 2.39 (3H,s) 是2个乙酰基信号;1.88 (1H, m, 6β-H), 2.36 (2H, m, H2-14), 2.55 (1H, m, H-6α), 3.80 (1H, d,= 6.5 Hz, H-3), 4.20 (1H, d,= 8.2 Hz, H-20a), 4.31 (1H, d,= 8.3 Hz, H-20b), 4.40 (1H, dd,= 8.7, 7.8 Hz, H-7), 4.79 (1H, s, H-2′), 4.95 (1H, d,= 9.0 Hz, H-5), 5.67 (1H, d,= 6.6 Hz, H-2), 5.79 (1H, d,= 8.6 Hz, H-3′), 6.23 (1H, t,= 8.7 Hz, H-13), 6.27 (1H, s, H-10), 6.99 (1H, d,= 8.6 Hz, NH), 7.61 (2H, d,= 6.9 Hz, Ar-H-23), 7.74 (2H, d,= 7.2 Hz, Ar-H-24), 8.13 (2H, d,= 7.4 Hz, Ar-H-25);13C-NMR (125 MHz, CDCl3): 172.7 (C-1′), 73.2 (C-2′), 55.0 (C-3′), 167.0 (C-5′), 79.0 (C-1), 74.9 (C-2), 45.6 (C-3), 81.2 (C-4), 84.4 (C-5), 35.7 (C-6), 72.2 (C-7), 58.6 (C-8), 203.6 (C-9), 75.60 (C-10), 133.2 (C-11), 142.0 (C-12), 72.4 (C-13), 35.6 (C-14), 43.2 (C-15), 21.8 (C-16), 26.9 (C-17), 14.8 (C-18), 9.6 (C-19), 76.5 (C-20), 167.1 (C-21), 129.1 (C-22), 130.2 (C-23, 27), 128.7 (C-24, 26), 133.6 (C-25), 170.4 (C-28), 22.6 (C-29), 171.3 (C-30), 20.9 (C-31), 133.6 (C-32), 127.1 (C-33, 37), 128.8 (C-34, 36), 128.4 (C-35), 138.0 (C-38)。203.64是C-9位游离羧基的特征信号,170.4和171.3是乙酰基的碳信号,22.6和20.9是2个乙酰基上的甲基信号,21.8和26.9是2个角甲基信号,再与文献报道的紫杉醇[8]对照,两者基本相同,故确定化合物1为紫杉醇。
化合物2:白色针状晶体(甲醇),紫外254 nm处有明显暗紫色斑点。1H-NMR (500 MHz, CDCl3): 1.15 (3H, s), 1.26 (3H, s), 1.68 (3H, s), 1.80 (3H, s) 是紫杉烷类化合物特征性的4个甲基信号,2.25 (3H, s), 2.36 (3H, s) 这2个信号表示为乙酰基再于化合物1比较时发现再苯环少了一个氢信号,同时又增加2个裂分的甲基信号:1.73 (3H, d,= 6.1 Hz, CH3-4′′), 1.76 (3H, m, CH3-2′′), 1.88 (1H, m, H-6β), 2.24 (1H, m, H-14β), 2.34 (1H, m, H-14α), 2.55 (1H, m, H-6α), 3.79 (1H, d,= 6.5 Hz, H-3), 4.19, 4.30 (each 1H, d,= 8.4/8.2 Hz, 20-H2), 4.40 (1H, dd,= 13.2, 7.8 Hz, H-7), 4.71 (1H, d,= 2.0 Hz, H-2′), 4.94 (1H, d,= 9.2 Hz, H-5), 5.62 (1H, d,= 8.6 Hz, H-3′), 5.67 (1H, d,= 6.2 Hz, H-2), 6.21 (1H, t,= 8.7 Hz, H-13), 6.28 (1H, s, H-10), 6.44 (1H, d,= 6.9 Hz, H-3′′), 6.50 (1H, d,= 8.8 Hz, NH), 7.34 (1H, m, Ar-H), 7.41 (4H, d,= 2.9 Hz, Ar-H), 7.51 (2H, t,= 7.4 Hz, Ar-H), 7.62 (1H, t,= 6.6 Hz, Ar-H), 8.13 (2H, d,= 7.0 Hz, Ar-H);13C-NMR (125 MHz, CDCl3): 79.1 (C-1), 74.9 (C-2), 45.6 (C-3), 81.1 (C-4), 84.4 (C-5), 35.6 (C-6), 72.2 (C-7), 58.6 (C-8), 203.6 (C-9), 75.5 (C-10), 133.1 (C-11), 142.1 (C-12), 72.3 (C-13), 35.6 (C-14), 43.2 (C-15), 21.8 (C-16), 26.9 (C-17), 14.8 (C-18), 9.6 (C-19), 76.5 (C-20), 171.2 (C-21), 170.3 (C-22), 22.6 (C-23), 20.9 (C-24), 167.0 (C-25), 172.8 (C-1′), 73.4 (C-2′), 54.9 (C-3′), 12.5 (6′-CH3), 169.0 (C-5′), 138.1 (C-6′), 131.9 (C-7′), 14.0 (C-8′)。将以上数据与文献报道[9]对照,二者基本一致,故确定化合物2为三尖杉宁碱。
化合物3:白色针状结晶(甲醇),紫外254 nm处有明显暗斑,5%硫酸乙醇溶液显蓝紫色1H-NMR (500 MHz, CDCl3): 8.16 (2H, d,= 7.5 Hz, Ph-H), 7.61 (1H, t,= 7.4 Hz, Ph-H), 7.51 (2H, t,= 7.3 Hz, Ph-H), 6.14 (1H, d,= 10.3 Hz, H-10), 5.56~5.48 (1H, m, H-7), 5.40 (1H, s, H-2), 5.36 (1H, s, H-5), 5.31 (1H, s, H-13), 5.13 (1H, d,= 12.4 Hz, H-7), 4.68 (1H, s), 3.70 (1H, d,= 11.1 Hz, H-20a), 3.63 (1H, d,= 7.5 Hz, H-20b), 2.99 (1H, dd,= 18.5, 13.0 Hz, H-3), 2.74 (1H, d,= 19.5 Hz, H-6a), 2.48 (1H, d,= 12.6 Hz, H-6b), 2.14 (3H, s, CH3CO), 2.11 (3H, s, CH3CO), 2.02 (6H, s), 1.29 (3H, s, CH3), 1.26 (3H, s, CH3);13C-NMR (400 MHz, CDCl3): 204.76 (C-9), 170.98 (10-OAc C=O), 170.13 (4-OAc C=O), 84.20 (C-5), 80.13 (C-4), 79.65 (C-1), 76.89 (C-20), 75.92 (C-10), 74.85 (C- 2), 71.93 (C-7), 68.12 (C-13), 58.82 (C-8), 45.09 (C-3), 42.02 (C-15), 38.13 (C-14), 35.10 (C-6), 26.14 (C-17), 22.23 (4-OAc Me), 20.45 (10-OAc Me), 19.08 (C-16), 15.89 (C-18), 9.23 (C-19)。将以上数据与文献[10]进行对照,二者基本一致,故确定化合物3为巴卡亭III。
化合物4:白色粉末状固体(甲醇)。1H-NMR (500 MHz, CDCl3) 具有特征信号0.88 (3H, s, 19-CH3),1.10 (3H, s, 16-CH3),1.63 (3H, s, 17-CH3),2.34 (3H, s, 18-CH3) 为紫杉烷类化合物特征甲基信号,1.7, 1.98, 2.03, 2.08 (3H, s) 为4个特征乙酰氧基质子信号。其1H-NMR (500 MHz, CDCl3) 信号归属为: 1.00 (1H, m, H-14α), 1.80 (1H, m, H-2), 1.89 (1H, m, H-1), 0.88 (3H, s, H-18), 2.72 (1H, m, H-15β), 3.03 (1H, d,= 3.2 Hz, H-4), 5.04 (1H, brs, H-20), 5.41 (1H, brs, H-20), 5.59 (1H, m, H-6), 5.68 (1H, dd,= 11.4, 2.1 Hz, H-8), 5.84 (1H, dd,= 8.4, 7.0 Hz, H-12), 5.96 (1H, d,= 11.4 Hz, H-10), 6.28 (1H, d,= 11.5 Hz, H-11), 6.56 (1H, d,= 16.4 Hz, H-2′), 7.37 (1H, m, H-7′), 7.42 (1H, m, H-6′), 7.47 (1H, m, H-5′), 7.79 (1H, d,= 16.1 Hz, H-3′), 1.10 (3H, s, H-16), 1.63 (3H, s, H-17), 1.72 (3H, s, 13-OAc), 1.94 (2H, m, H-7), 1.99 (3H, s, 10-OAc), 2.05 (3H, s, 8-OAc), 2.08 (3H, s, 7-OAc), 2.34 (3H, s, H-18);13C-NMR (125 MHz, CDCl3): 50.7 (C-1), 31.9 (C-2), 40.2 (C-3), 39.4 (C-4), 135.0 (C-5), 137.2 (C-6), 70.7 (C-7), 15.3 (C-8), 74.9 (C-9), 71.7 (C-10), 20.9 (C-11), 37.5 (C-12), 21.4 (C-13), 31.2 (C-14), 146.2 (C-15), 34.6 (C-17), 70.1 (C-18), 13.2 (C-19), 116.1 (C-21), 116.25 (C-22), 118.3 (C-24), 145.9 (C-25), 138.1 (C-26, 28), 134.1 (C-27), 129.0 (C-29, 31), 130.7 (C-30), 170.4 (C-34), 21.0 (C-35), 170.9 (C-38), 20.0 (C-39), 27.2 (C-40), 170.0 (C-42), 27.2 (C-43), 169.4 (C-46), 27.2 (C-47)。以上数据与文献报道一致[11],故鉴定化合物4为2-去乙酰氧基紫杉宁J(2-deacetoxytaxinine J)。
化合物5:白色粉末状固体(甲醇)。其1H-NMR (CDCl3, 500 MHz) 特征信号0.81 (3H, s, 19-CH3), 1.51 (3H, s, 16-CH3), 1.63 (3H, s, 17-CH3), 2.28 (3H, s, 18-CH3),: 1.97, 2.01, 2.05 (Each 3H, s) 为紫杉烷类化合物特征信号。其1H-NMR (CDCl3, 500 MHz) 信号归属为: 0.81 (3H, s, H-19) 0.90 (3H, s, H-17) 1.51 (3H, s H-16) 1.97, 2.01, 2.05 (Each 3H, s, OAc), 2.28 (3H, s, H-18) 2.93 (1H, m,= 15.3, 11.5, 8.6 Hz, H-14β) 3.23 (1H, d,= 5.4 Hz, H-2) 4.34 (2H m, H-5, et H-13) 4.80 (1H, s, H-20) 5.13 (1H, s, H-20) 5.62 (1H, dd,= 12.0, 5.0 Hz, H-7) 5.77 (1H, d,= 11.0 Hz, H-9) 6.18 (1H, d,= 11.0 Hz, H-10)13C-NMR (125 MHz, CDCl3): 68.51 (C-1), 35.8 (C-2), 38.8 (C-3), 37.20 (C-4), 134.8 (C-5), 150.1 (C-6), 12.53 (C-7), 70.0 (C-9), 73.5 (C-10), 46.7 (C-11), 26.9 (C-12), 39.6 (C-13), 26.1 (C-14), 16.8 (C-15), 72.7 (C-16), 35.7 (C-17), 142.2 (C-18), 112.5 (C-19), 165.4 (C-20), 32.51 (C-23), 170.0 (C-26), 21.51 (C-27), 170.4 (C-30), 21.16 (C-31), 170.0 (C-34), 21.0 (C-35) 。以上数据与文献报道[12]一致,故鉴定化合物5为2-去乙酰氧基-13-去乙酰去桂皮酰-紫杉宁J。
化合物6:白色透明晶体(甲醇)。1H-NMR (500 MHz, CDCl3): 1.76 (1H, m, H-1), 1.74 (1H, m, H-2α), 1.92 (1H, m, H-2β), 3.22 (1H, d,= 5.2 Hz, H-3), 4.33 (1H, d,= 3.5 Hz, H-5), 1.68 (1H, m, H-6β), 5.70 (1H, dd,= 11.5, 5.7 Hz, H-7), 5.84 (1H, d,= 11.3 Hz, H-9), 6.31 (1H, d,= 11.4 Hz, H-10), 5.76 (1H, dd,= 10.6, 5.5 Hz, H-13), 1.14 (1H, dd,= 15.5 Hz, H-14α), 2.80 (1H, ddd,= 15.4, 11.3, 8.6 Hz, H-14β), 1.60 (3H, s, H-16), 1.00 (3H, s, H-17), 2.23 (3H, s, H-18), 0.81 (3H, s, H-19), 2.06 (3H, s, CH3CO), 2.07 (3H, s, CH3CO), 2.08 (3H, s, CH3CO), 4.87 (1H, d,= 1.5 Hz, H-20β), 5.21 (1H, d,= 1.3 Hz, H-20α),13C-NMR (125 MHz, CDCl3) 信号归属为: 39.6 (C-1), 26.9 (C-2), 35.50 (C-3), 151.4 (C-4), 73.3 (C-5), 36.2 (C-6), 69.7 (C-7), 46.7 (C-8), 76.7 (C-9), 72.3 (C-10), 136.0 (C-11), 137.7 (C-12), 70.0 (C-13), 32.3 (C-14), 38.9 (C-15), 26.2 (C-16), 32.2 (C-17), 15.9 (C-18), 12.5 (C-19), 112.6 (C-20)。以上数据与文献报道一致[13],鉴定化合物6为2-去乙酰氧-5α-羟基紫杉宁J。
5 体外抗肿瘤活性评价
紫杉醇是目前公认的天然抗肿瘤药物,其具有广谱的抗癌作用。由于三尖杉宁碱和巴卡亭III与紫杉醇具有相同的母核结构,且具有构成活性的关键基团之一的四元环。因此,本研究选取三尖杉宁碱和巴卡亭III这2个化合物与紫杉醇做对照进行抗肿瘤活性研究,所有活性测试中紫杉醇作为阳性药。目前研究可知,紫杉烷类化合物具有较高抗肿瘤选择性及对多种肿瘤细胞尤其是对有抗药性的人体肿瘤细胞有较高生物活性,主要用于卵巢癌、乳腺癌的治疗,并对食道癌、膀胱癌、淋巴癌、前列腺癌、恶性黑色素癌及胃肠道癌疗效显著。因此本研究选择肺癌NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR、胃癌AGS细胞以及肝癌HepG2细胞进行抗肿瘤活性研究。
5.1 对不同人源性肿瘤细胞增殖的抑制作用
采用MTT法[14],测试化合物1~3在不同质量浓度(0、1、10、100 μg/mL)下对NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR、AGS细胞以及肝癌HepG2细胞增殖的抑制作用。使用多功能酶标仪,测定在450 nm处的吸光度()值,按照公式计算半数抑制浓度(IC50),结果见表2。实验结果显示化合物1~3对不同人源性肿瘤细胞均具有良好的选择一致性。
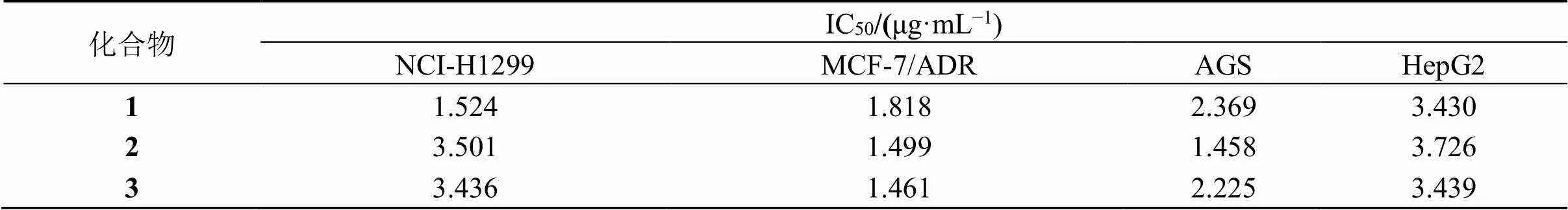
表2 化合物1~3的IC50
5.2 对不同人源性肿瘤细胞凋亡的促进作用
采用Annexin-V FITC/PI双染法通过流式细胞术[15],测试化合物1~3在不同质量浓度下(0、10、100 μg/mL)对NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR以及HepG2细胞凋亡的抑制作用。观察记录数据,结果见图2~4。在不同肿瘤细胞中,化合物均促进细胞凋亡,与对照组相比,凋亡率随着浓度的增加而上升。
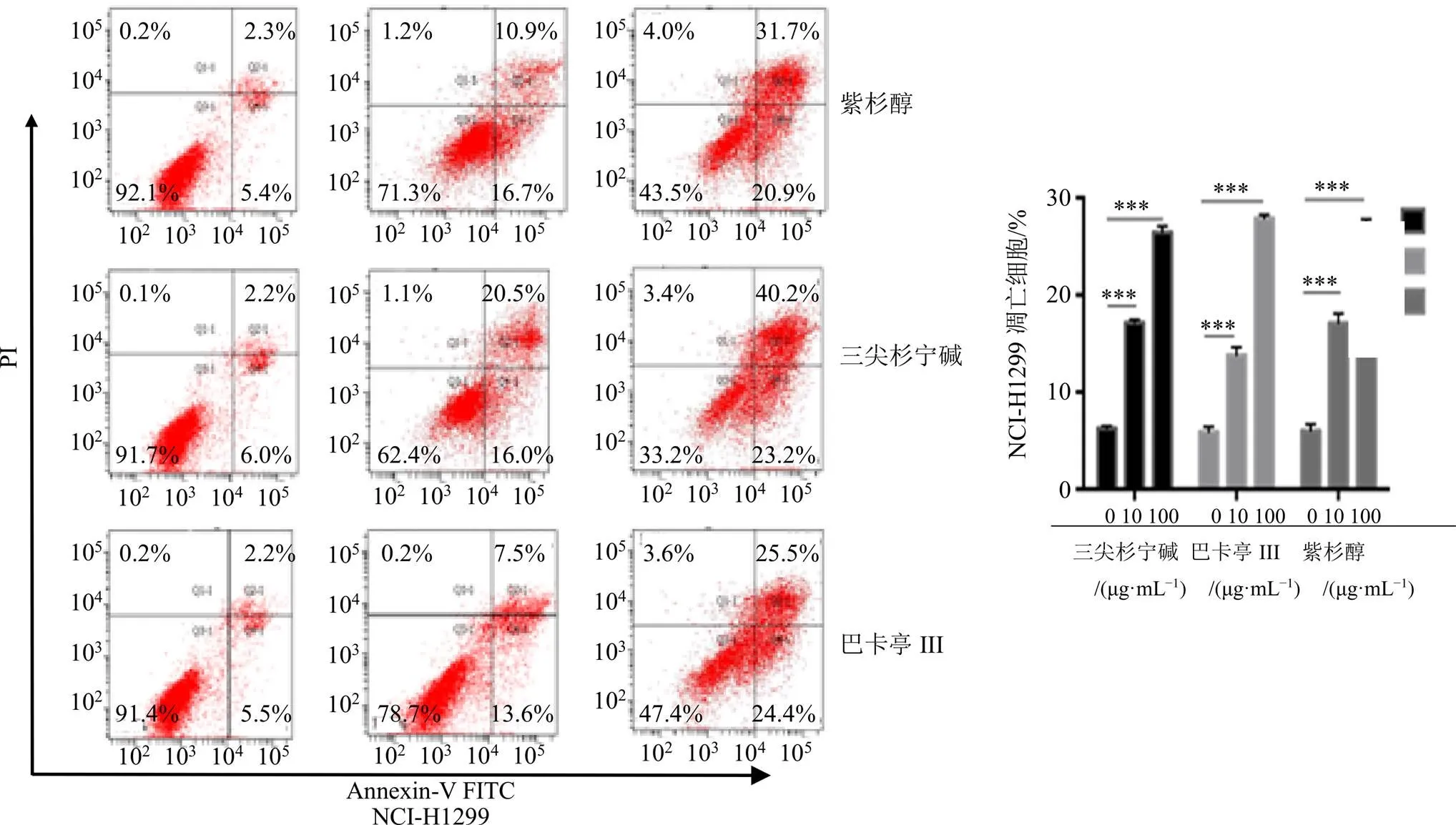
与对照组比较,*P<0.05; **0.05<P<0.01; ***P<0.01,下同
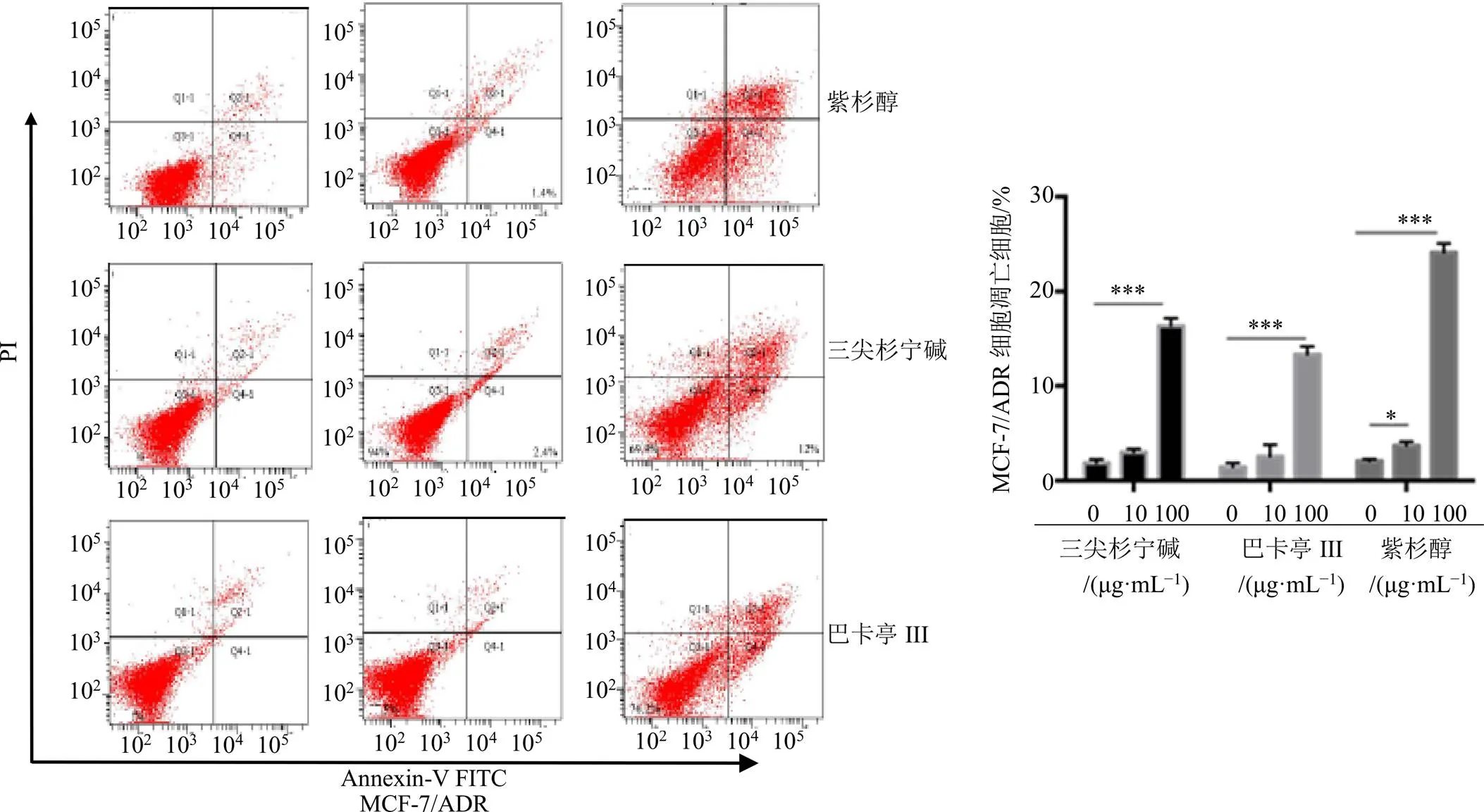
图3 化合物1~3诱导MCF-7/ADR细胞凋亡
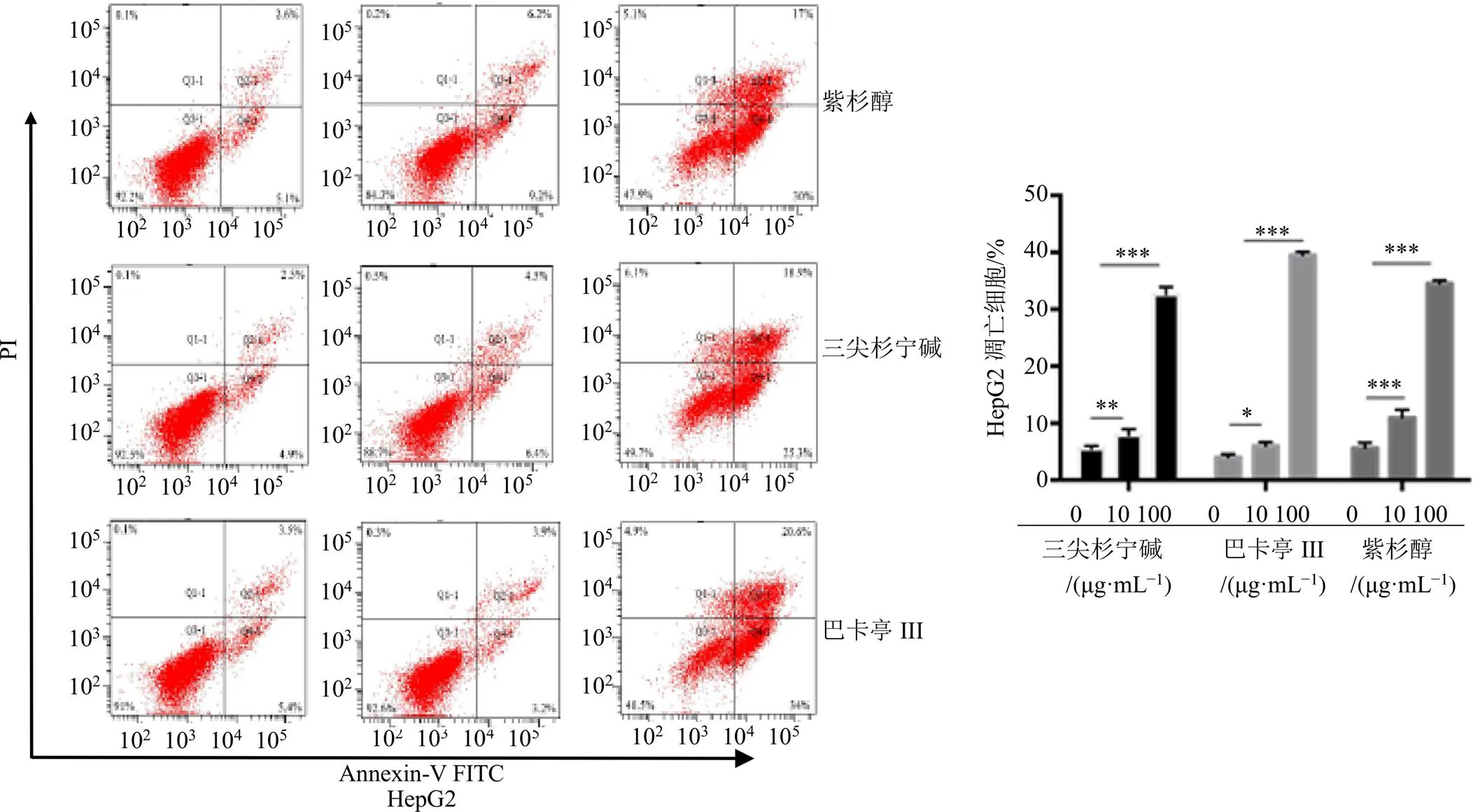
图4 化合物1~3诱导HepG2细胞发生凋亡
5.3 对肿瘤细胞Caspase-cleaved 3表达的影响
采用蛋白质印记法(Western blotting)[16],测试化合物1~3在不同质量浓度下(0、10、100 μg/mL)对NCI-H1299细胞、乳腺癌耐药株MCF-7/ADR以及HepG2细胞凋亡相关蛋白的影响。结果见图5~7。Caspase-cleaved3蛋白表达水平增高且与化合物干预剂量呈一定正相关性,提示化合物促肿瘤细胞凋亡。所有数据采用GraphPad Prism 5.0进行统计。
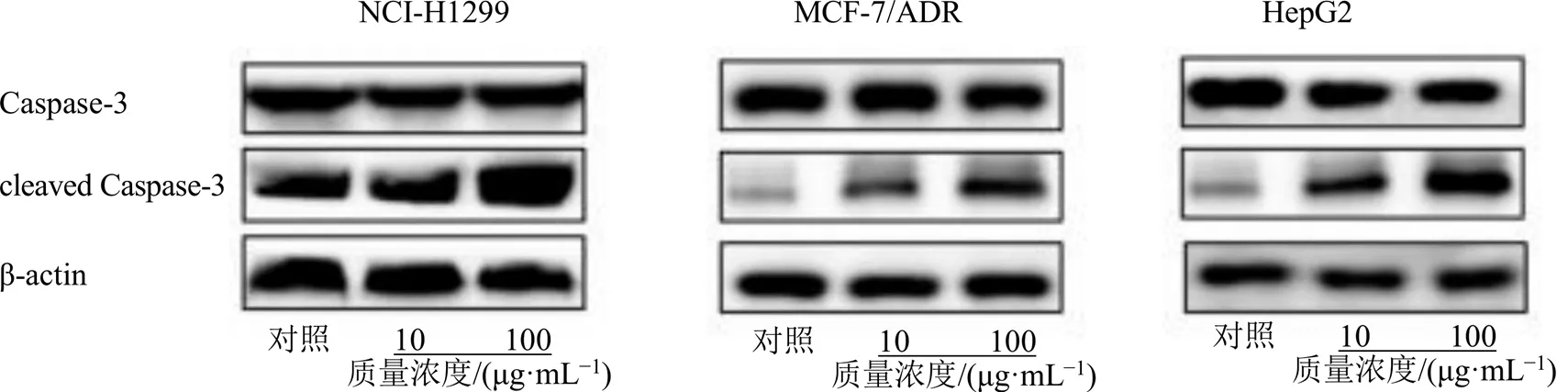
图5 紫杉醇诱导肿瘤细胞凋亡
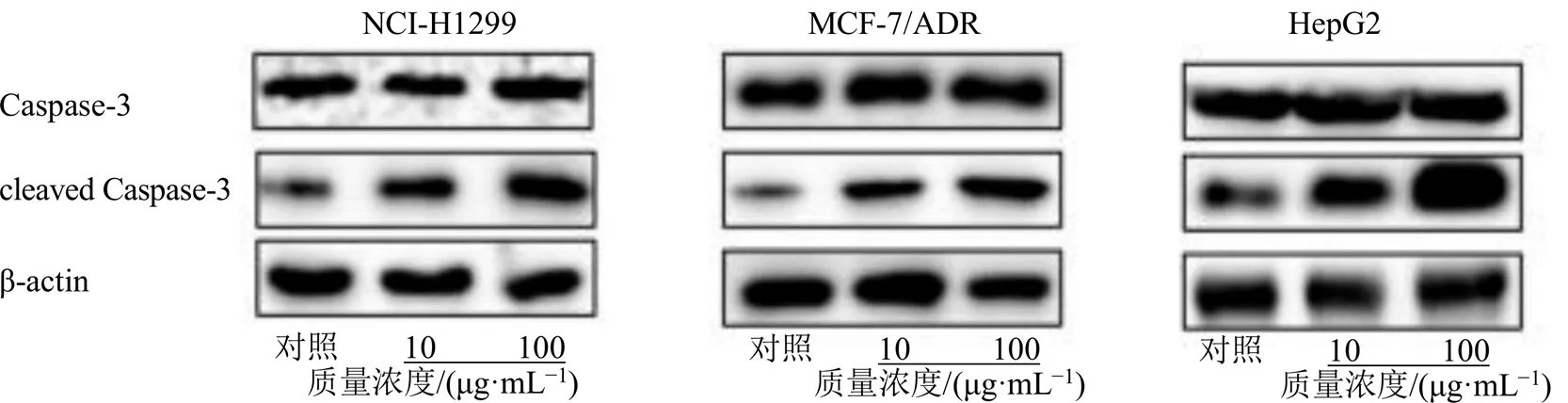
图6 三尖杉宁碱诱导肿瘤细胞凋亡

图7 巴卡亭III诱导肿瘤细胞凋亡
6 讨论
本课题通过分析东北红豆杉、大连大学校园内矮紫杉转录组数据完成对这些植物中候选TS基因预测,采用同源模建及分子对接初步验证目标蛋白与底物GGPP的结合能力,根据结合能打分可知,矮紫杉中的的紫杉二烯合酶与东北红豆杉非常相似,其活性位点几乎无差异,从分子层面上推测矮紫杉具有代谢产生紫杉烷类化合物的能力。而后首次从矮紫杉中分离得到6个紫杉烷类化合物,分别鉴定为紫杉醇(1)、三尖杉宁碱(2)、巴卡亭III(3)、2-去乙酰氧基紫杉宁J(4)、2-去乙酰氧基-13-去乙酰去桂皮酰-紫杉宁J(5)、2-去乙酰氧-5α-羟基紫杉宁J(6)。并对3种化合物1~3进行抗肿瘤作用研究。
诱导肿瘤细胞凋亡是癌症治疗的一个主要的策略,本课题采用不同质量浓度紫杉醇类化合物1~3(0、10、100 g/mL)刺激NCI-H1299、AGS、HepG2、MCF-7/ADR细胞。通过MTT检测分离提取到的化合物对肿瘤细胞毒性的影响,结果显示紫杉烷类化合物抑制细胞增殖,对肿瘤细胞具有毒性作用。此外,采用流式细胞仪发现通过紫杉烷类化合物均能在不同程度上促进肿瘤细胞凋亡。通过Western blotting检测凋亡相关标志物的表达水平观测结果显示,化合物能够提高Cleaved-caspase3蛋白表达水平,且呈浓度依赖性。从而可以推测紫杉烷类化合物诱导细胞凋亡可能是通过Cleaved-caspase3信号通路实现的。本研究内容对寻找红豆杉替代资源提供理论支持,具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Spencer C M, Faulds D. Paclitaxel. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic potential in the treatment of cancer [J]., 1994, 48(5): 794-847.
[2] 杨春, 孔令义, 汪俊松. 加拿大红豆杉中紫杉烷类成分的研究进展及药源危机解决方法探讨 [J]. 中国中药杂志, 2014, 39(11): 1961-1971.
[3] Shi Q W, Oritani T, Kiyota H,. Taxane diterpenoids fromand[J]., 2000, 54(8): 829-834.
[4] 王关林, 方宏筠, 胡风庆, 等. 东北矮紫杉组织、细胞培养及其紫杉醇生成的研究 [J]. 中国农业科学, 2001, 34(4): 373-378.
[5] 戴露丹. 紫杉醇中间体紫杉二烯的合成生物学研究 [D]. 武汉: 华中科技大学, 2017.
[6] 肖颖, 赵冬, 王刚. 紫杉醇生物合成途径及其相关酶的研究进展 [J]. 河北师范大学学报, 2006, 30(2): 222-228.
[7] 王伟, 石青, 朱平, 等. 中国红豆杉紫杉烯合酶cDNA的分离、表达和鉴定 [J]., 2002, 44(2): 181-187.
[8] Wani M C, Taylor H L, Wall M E,. Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from[J]., 1971, 93(9): 2325-2327.
[9] Zhang J Z, Fang Q C, Liang X T,. Taxoids from the barks of[J]., 1995, 40(3): 881-884.
[10] Shigemori H, Wang X X, Yoshida N,. Taxuspines X-Z, new taxoids from Japanese yew[J]., 1997, 45(7): 1205-1208.
[11] 张嫚丽. 东北红豆杉、飞机草的化学成分研究及土木香中活性成分的微生物转化研究 [D]. 石家庄: 河北医科大学, 2010.
[12] Hall A M, Tong X J, Chang C J. Taxoids FromTaxusx media “dark green spreader” [J]., 1997, 10(3): 165-172.
[13] Chattopadhyay S K, Sharma R P. A taxane from the Himalayan yew,[J]., 1995, 39(4): 935-936.
[14] 李雅静, 张洁. 银杏内酯B对肺癌细胞增殖和凋亡的影响 [J]. 中国医院药学杂志, 2021, 41(4): 342-347.
[15] 陈灏, 呼芳竹, 邓煜瑶, 等. 蛋氨酸脑啡肽联合紫杉醇对肺癌细胞A549增殖和凋亡的影响 [J]. 中国免疫学杂志, 2020, 36(16): 1978-1982.
[16] 王若石, 蔡钧. 茶多酚联合顺铂对肺癌细胞A549增殖和凋亡的影响 [J]. 中国现代医学杂志, 2018, 28(28): 28-32.
Taxanes incv. Nana and its anti-tumor activities
LU Xuan, SUN Ye-qing, CHENG Zi-qi, FENG Bao-min
College of Life Science and Biotechnology, Dalian University, Dalian 116622, China
To study the anti-tumor activity of taxanes isolated fromvar and its anti-tumor activities, with a view to discovering alternative varieties of.High-throughput sequencing technology is used for transcriptome sequencing, and molecular docking was used to preliminarily predict that thevar has the ability to produce taxanes. The chemical constituents were isolated from the total alkaloids of the twigs and leaves ofby using silica gel, Sephadex LH-20, and HPLC chromatographic methods Furthermore, the cytotoxicity of some compounds against NCI-H1299 (human lung cancer cell line), MCF-7/ADR (human breast cancer drug-resistant cell line),AGS (human gastric cancer cell line), and HepG2(human liver cancer cell line)were tested by MTT, Flow Cytometry and Western blot methods.At the molecular level, it was verified that thevar has the ability to metabolize and produce taxanes, and on this basis. Six taxanes were isolated from thevar, and they were identified as taxol (1), cephalomannine (2), baccatin III (3), 2-deacetoxytaxinine J (4), 2-deacetyloxy-13-deacetyldecinnamyl-taxinine J (5), and 2-deacetoxy-5α-hydroxytaxinine J (6).The cultivarhas the ability to metabolize and produce taxanes, which can be used as an alternative resource forto a certain extent.
cv. Nana; taxol; cephalomannine; baccatin III; 2-deacetoxytaxinine J; 2-deacetyloxy-13- deacetyldecinnamyltaxinine J; 2-deacetoxy-5α-hydroxytaxinine J; resource replacement; molecular simulation; anti-tumor activity
R284.1
A
0253 - 2670(2021)17 - 5210 - 08
10.7501/j.issn.0253-2670.2021.17.012
2021-07-03
辽宁省“百千万人才工程”择优资助项目
卢 轩(1984—),男,山东青岛人,副教授,博士,硕士生导师,主要从事天然活性物质的研究工作。Tel: 18042615621 E-mail: luxuan_232@163.com
冯宝民(1975—),男,吉林集安人,沈阳药科大学1997届天然药物化学专业硕博连读校友,教授,博士,硕士研究生导师;2010年入选教育部新世纪人才;2011年入选“辽宁省百千万人才工程”百层次人选;2015年当选辽宁省特聘教授;2015年获第十届辽宁省青年科技奖。E-mail: fbmdlu@163.com
[责任编辑 时圣明]
