晚期ALK融合阳性非小细胞肺癌治疗全程管理1例
2021-09-05白赫男韩雨牛意张明晖
白赫男 韩雨 牛意 张明晖
1 病例资料
患者男性,42岁,体表面积1.66 m2。因“间断咳嗽、胸闷2个月,确诊肺腺癌1天”于2015年7月3日就诊于我科。2015年5月患者无明显诱因出现间断咳嗽,伴胸闷、气短,时有心悸,无咯血,无胸痛,于当地诊所抗炎治疗无好转(具体不详),2015年6月18日于外院行胸部计算机断层扫描(computed tomography, CT)提示:左肺炎症病变并局部肺组织膨胀不全,纵隔淋巴结肿大,左侧胸腔积液,心包积液。2015年6月19日行胸部增强CT:左肺下叶占位,较大层面大小2.9 cm×2.3 cm,考虑肺癌并阻塞性炎症,纵膈及左肺门多发淋巴结转移,左侧气胸及左侧包裹性积液。心脏彩超:心包少量积液。后患者就诊于北京大学肿瘤医院,行支气管镜检查提示左肺下叶癌,左主支气管隆起型病变。2015年7月2日病理回报:(左下叶基底段活检1块)非小细胞癌,考虑腺癌。既往否认结核病史、传染病及其他病史等。否认吸烟、饮酒史。查体:左肺呼吸音减弱,未闻及明显干湿啰音。初步诊断:左肺下叶腺癌 T1bN2M1a IV期,体力状况(performance status, PS)评分1分。
入院后腹部增强CT及头部增强磁共振成像(magnetic resonance imaging, MRI)未见转移征象,胸腔彩超提示左侧胸腔积液,深约11.6 cm。评估无化疗禁忌,2015年7月8日始于我科行多西他赛+顺铂方案化疗2周期(多西他寒100 mg、d1;顺铂120 mg,分3天输注;q3w),并予胸腔穿刺引流,胸水中查到肿瘤细胞,给予重组人血管内皮抑制素胸腔内注射配合胸部热疗控制积液。2015年7月15日基因检测回报(中国医学科学院肿瘤医院):未检测到表皮生长因子受体(epidermal growth factor receptor, EGFR)第18、19、20、21号外显子突变;未显示KRAS基因第2号外显子12、13密码子突变。荧光原位杂交技术(fluorescence in situ hybridization, FISH)结果显示:ALK(2p23)染色体易位。患者因经济原因拒绝调整为克唑替尼治疗。化疗2个周期后评估疗效:胸部及上腹部增强CT提示胸腔积液增多,心包积液,左肺下叶原发病灶较前增大(2.9 cm×2.3 cm→3.8 cm×3.4 cm),纵隔淋巴结肿大,左侧肾上腺新发病灶,考虑转移。疗效评估:疾病进展(progressive disease, PD)。2015年8月19日调整为培美曲塞+卡铂方案化疗(培美曲塞800 mg、d1;卡铂500 mg、d2;q3w)。2个周期后评估疗效:胸闷、咳嗽症状好转,胸部及上腹部增强CT提示左下肺实性占位较前略小(3.8 cm×3.4 cm→3.4 cm×3.0 cm),左侧包裹性胸腔积液较前减少,纵隔淋巴结肿大,左侧肾上腺实性占位未见明显改变。疗效评估:疾病稳定(stable disease, SD)。继续原方案化疗4个周期,自觉胸闷、咳嗽症状继续好转,6个周期后于2016年1月4日评效,复查胸部及上腹部增强CT提示肺部病灶较前缩小(3.4 cm×3.0 cm→2.8 cm×1.9 cm),右侧胸腔积液及心包积液消失,左侧胸腔积液减少,纵隔淋巴结肿大,左侧肾上腺占位未见明显改变。疗效评估:SD。2016年1月5日继续培美曲塞二钠单药维持化疗3个周期(培美曲塞二钠800 mg、d1,q3w)。于2016年3月24日复查胸部及上腹部增强CT提示肺部病灶较前缩小(2.8 cm×1.9 cm→2.6 cm×1.4 cm),左侧胸腔积液少量包裹性积液,纵隔淋巴结肿大,左侧肾上腺占位未见明显改变。疗效评估:部分缓解(partial remission, PR)(图1)。继续培美曲塞单药维持1个周期,无进展生存期(progression-free survival,PFS)超过9个月。

图 1 含培美曲塞方案化疗前及9个周期治疗后CT图像。A:化疗前CT图像(2015年8月17日):左侧包裹性胸腔积液;B:化疗前CT图像(2015年8月17日):纵隔淋巴结肿大,左肺下叶占位(3.8 cm×3.4 cm);C:9个周期化疗后CT图像(2016年3月24日):左侧包裹性胸腔积液减少;D:9个周期化疗后CT图像(2016年3月24日):纵膈肿大淋巴结缩小,左肺下叶占位缩小(2.6 cm×1.4 cm)。Fig 1 CT images before and after 9 cycles of pemetrexed chemotherapy. A: CT images before chemotherapy (17-Aug-2015): left enveloped pleural effusion; B: CT images before chemotherapy (17-Aug-2015): mediastinal lymph node enlargement, left inferior lobe occupying space (3.8 cm×3.4 cm); C: CT images after 9 cycles of chemotherapy (24-Mar-2016): left enveloping pleural effusion was reduced; D: CT images after 9 cycles of chemotherapy (24-Mar-2016): mediastinal enlarged lymph node was reduced, left lower lobe area of the lung was reduced (2.6 cm×1.4 cm). CT:computed tomography.
经与患者充分沟通,2016年4月9日开始口服克唑替尼靶向治疗(250 mg, bid),治疗第1周,出现“恶心、呕吐”症状,常见不良反应事件评价标准(common terminology criteria for adverse events, CTCAE)2级,调整给药时间,由空腹给药改为餐后给药,嘱患者进食清淡、易消化食物,少量多餐,少吃甜食及易产气食物,1周后消化道反应耐受。治疗第4周化验提示肝酶水平增高,CTCAE 1级,给予保肝治疗,至第8周,肝酶水平升高达CTCAE 3级,诊断克唑替尼相关性药物性肝损伤,给予停药,加用注射用还原型谷胱甘肽及注射用甘草酸二胺静脉输注治疗。治疗第9周肝酶水平降至CTCAE 2级,继续口服克唑替尼治疗,剂量不变。此后患者治疗过程顺利。治疗期间定期复查,2016年6月15日复查胸及上腹部增强CT,提示肺部病灶较前缩小(2.6 cm×1.4 cm→1.8 cm×0.7 cm),左侧胸腔积液减少,纵隔淋巴结缩小,左侧肾上腺占位略缩小。疗效评估:PR。至2019年6月25日复查胸及上腹部平扫CT,提示左肺部病灶较前缩小(1.3 cm×0.6 cm),左侧胸腔积液、纵隔淋巴结肿大较前好转,左侧肾上腺占位无明显变化。疗效评估:维持PR(图2)。2019年8月初患者出现头晕,逐渐加重,并出现双下肢乏力、活动不灵,2019年8月6日于我院门诊复查头部MRI(图3)提示:颅内多发异常信号,转移瘤可能性大(转移病灶大于3处)。疗效评估:PD(PFS为40个月)。2019年8月10日-2019年8月30日行头部放疗,具体:CT定位后行适行放疗,照射全脑30 Gy/2.5 Gy/12 f,局部病灶加量15 Gy/3 Gy/5 f。期间给予脱水降颅压治疗。同时行二次基因检测,因肿瘤组织取材困难,完善血液检测,提示未见EGFR、ALK、KRAS、ROS1、MET、ERBB2、BRAF、RET基因突变或融合。2019年9月4日始口服三代ALK-TKI恩沙替尼治疗(225 mg, po, qd)。治疗第2周化验提示肝酶水平增高,CTCAE 1级,加用注射用还原型谷胱甘肽联合注射用甘草酸二胺静脉输注治疗。治疗第4周患者转氨酶降至正常。后续患者服用恩莎替尼治疗过程顺利。治疗期间定期评估疗效,患者头晕、双下肢活动不灵症状缓解,2020年1月20日复查头MRI(图3)及胸、腹部增强CT,疗效评估:SD。至2020年8月12日,疗效评估:SD(图4)。截至2021年3月1日,仍维持恩沙替尼治疗,PFS超过18个月。
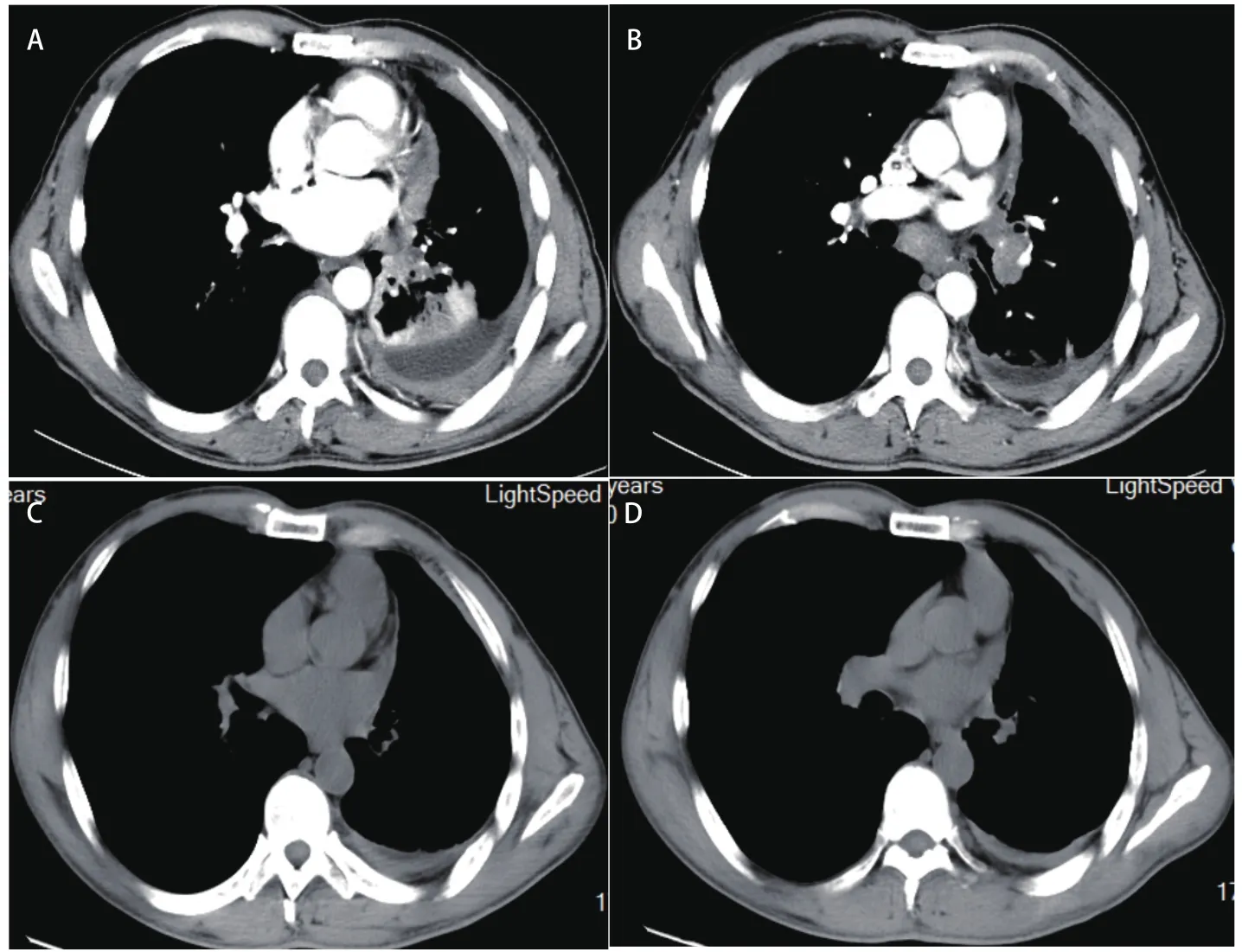
图 2 克唑替尼治疗前后CT图像。A:克唑替尼治疗前CT图像(2016年3月24日):左侧包裹性胸腔积液;B:克唑替尼治疗前CT图像(2016年3月24日):纵隔淋巴结肿大,左肺下叶占位(2.6 cm×1.4 cm);C:克唑替尼治疗后CT图像(2019年6月25日):左侧包裹性胸腔积液较前减少;D:克唑替尼治疗后CT图像(2019年6月25日):纵隔淋巴结肿大较前缩小,左肺下叶小病灶(1.3 cm×0.6 cm)缩小。Fig 2 CT images before and after crizotinib treatment. A: CT images before crizotinib treatment (24-Mar-2016): left encapsulated pleural effusion;B: CT images before crizotinib treatment (24-Mar-2016): mediastinal lymphadenopathy, left lung lower lobe space occupying (2.6 cm×1.4 cm);C: CT images after crizotinib treatment (25-Jun-2019): left encapsulated pleural effusion was reduced ; D: CT images after crizotinib treatment(25-Jun-2019): mediastinal lymph node enlargement was reduced, small lesion in the lower lobe of the left lung (1.3 cm×0.6 cm) was reduced.

图 3 头MRI所示转移瘤情况。A:头MRI(2019年8月6日):左侧基底节区,左侧脑室体旁转移瘤;B:头MRI(2019年8月6日):左侧额叶皮层,左侧顶叶皮层,左侧脑室体旁转移瘤;C:头MRI(2020年1月20日):左侧基底节区缩小,左侧脑室体旁转移瘤缩小;D:头MRI(2020年1月20日):左侧额叶皮层,左侧顶叶皮层,左侧脑室体旁转移瘤缩小。Fig 3 Brain MRI showing metastatic tumors. A: brain MRI (6-Aug-2019):metastatic tumor in left basal ganglia region, metastatic tumor near the body of the left lateral ventricle; B: brain MRI (6-Aug-2019):metastatic tumor in left frontal cortex, metastatic tumor in left parietal cortex, metastatic tumor near the body of the left lateral ventricle;C: brain MRI (20-Jan-2020): metastatic tumor in left basal ganglia region was reduced, metastatic tumor near the body of the left lateral ventricle was reduced; D: brain MRI (20-Jan-2020): metastatic tumor in left frontal cortex was reduced, metastatic tumor in left parietal cortex was reduced, metastatic tumor near the body of the left lateral ventricle was reduced. MRI: magnetic resonance imaging.

图 4 恩沙替尼治疗期间CT图像。A:CT(2019年11月13日):左侧少量胸腔积液;B:CT(2019年11月13日):纵隔淋巴结,左肺下叶小病灶;C:CT(2020年08月20日):左侧胸腔积液同前;D:CT(2020年08月20日):纵隔淋巴结同前,左肺下叶病灶同前。Fig 4 CT images during treatment with ensartinib. A: CT (13-Nov-2019): a small pleural effusion on the left; B: CT (13-Nov-2019): mediastinal lymph node, small lesion in the lower lobe of the left lung; C: CT (20-Aug-2020): the small pleural effusion on the left was as same as before; D: CT(20-Aug-2020): the mediastinal lymph node was as same as before, the small lesion in the lower lobe of the left lung was as same as before.
2 讨论
2007年ALK基因被发现为肺癌治疗的潜在靶点[1],作为继EGFR第二常见的驱动基因变异,ALK相关靶向药物的研发也异常迅猛。2014年PROFILE1014研究[2]提示,克唑替尼组对比化疗组中位PFS为10.9个月 vs 7.0个月,克唑替尼组显出明显优势,该研究奠定了克唑替尼治疗ALK融合突变阳性肺癌患者的一线治疗地位,后续二代、三代ALKTKI的出现,使大多数ALK融合突变阳性的肺癌患者在生存质量及生存期方面得到了很大改善[2-6]。前期曾有病例报道,经过治疗的ALK阳性患者总生存期能够超过7年,比如法国的IFCT-1302 CLINALK研究[7]中患者的中位OS为89.6个月;日本WJOG9516L研究[8]中克唑替尼序贯阿来替尼中位OS达到88.44个月。此外一项来自美国UCCC的回顾性研究[9]分析提示,一线克唑替尼序贯后代ALK-TKI治疗患者的中位OS达到了86个月。随着ALK-TKI如雨后春笋般推陈出新,克唑替尼一线治疗的中位PFS仍显不够长,通常治疗10个月后,50%的患者会出现耐药,治疗12个月后,41.4%的患者可能发生脑转移[10]。在2019年欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)年会上,阿来替尼组中位PFS定格在34.8个月,对于基线无脑转移的患者,中位PFS更是高达38.6个月。如今,美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南、中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)肺癌指南已将阿来替尼推荐至一线治疗,而且为优先选择[11,12]。
对于患者在一线全身治疗期间发现ALK重排,NCCN建议可选择完成化疗计划(包括维持治疗),亦可选择中断化疗,直接给予阿来替尼、布加替尼、色瑞替尼或克唑替尼治疗[13]。2014年及2018年PROFILE1014研究中克唑替尼组和化疗组总生存期未见显著的统计学差异。一线应用ALK-TKI确实在PFS方面有明显获益,但OS获益并不明确,这可能也是NCCN指南并未摒弃一线应用化疗的原因之一。
病例报道中患者三线应用克唑替尼PFS较长。2016年的一项荟萃分析[14]检索了多个数据库涵盖约6,086篇文献,意在对比在一线及二线应用克唑替尼的获益情况,该分析提示对于晚期ALK阳性NSCLC患者,一线应用克唑替尼可能比二线应用克唑替尼更获益(PFS为11.28个月 vs 8.12个月),而三线及后线应用克唑替尼的文献报道及数据较少。该患者前期因经济原因未能一线直接加用ALK-TKI治疗,先给予紫杉醇+顺铂方案化疗,后调整为培美曲塞+卡铂方案化疗,疗效达到PR且在维持PR的情况下改为克唑替尼治疗,三线应用克唑替尼PFS达到40个月,远远超出PROFILE1014研究中克唑替尼一线治疗中位PFS的10.9个月[2]。关于影响克唑替尼PFS的因素,前期曾有回顾性研究提示ALK融合阳性患者先应用含培美曲塞方案化疗,后行ALK-TKI治疗后可获得更久的PFS[15,16],而应用不包含培美曲塞的含铂类方案化疗,后续给予ALK-TKI治疗,PFS却并无优势[16-18]。这也许可以作为该患者PFS延长原因的探讨方向。ALK融合突变分为7个亚型,分别为V1、V2、V3a/b、V5a/b、V5’、V7以及Non-EML4-ALK亚型。其中V1、V2、V3占比较高,分别为43%、6%及40%[19]。2016年韩国的一项回顾性研究[20]提示,一线应用含有培美曲塞的方案化疗,ALK阳性患者PFS更具优势,进一步细分融合突变亚型,V1类型则表现出更优异的PFS。这一亚型是ALK融合突变类型占比最多的亚型。该研究中的多变量分析证明分型为V1类型是一线应用培美曲塞治疗延长PFS的唯一显著预测因素。值得注意的是,V1亚型同样是应用克唑替尼效果较好、继发耐药概率(尤其是继发ALK G1202R突变概率)较低的亚型[19,21]。2017年我国一项回顾性研究提示,ALK阳性肺腺癌患者一线应用含培美曲塞方案化疗,客观缓解率(objective response rate, ORR)和疾病控制率 (disease control rate, DCR)均高于阴性患者[22],同样提示培美曲塞本身对ALK阳性患者更敏感。该患者三线应用克唑替尼的PFS相对较长,具体原因及机制有待进一步基础及临床研究的验证。
近些年来,中国原研ALK-TKI恩沙替尼研究数据不断发布,为ALK阳性NSCLC的治疗带来新的选择。恩沙替尼对ALK野生型及17个ALK突变型的抑制图谱分析结果显示,该药对所有ALK突变型均有明显的抑制作用,半抑制浓度(half maximal inhibitory concentration,IC50)<4 nmol/L,其中对野生型ALK融合和继发F1174、C1156Y、L1196M、S1206R、T1151等突变位点显示出了强烈的抑制作用,IC50均小于0.4 nmol/L;而对G1202突变体的抑制能力则相对较弱,IC50值为3.8 nmol/L[23,24]。在前期报道的I期/II期研究中,恩沙替尼在ALK阳性患者中整体ORR为60%,DCR为81.7%,其中14例基线合并脑转移患者ORR为64.3%,DCR为92.9%,提示该药对合并脑转移的患者可能更敏感。恩沙替尼主要不良反应为皮疹(56%)、恶心(36%)、瘙痒 (28%)、呕吐(26%)和疲劳(22%)[23]。2019年10月关于恩沙替尼II期研究[25]数据再次肯定了恩沙替尼的安全性及效果,提示恩沙替尼可能成为潜在的一线治疗方案选择。相信不久的将来会有更多的数据更新为我们带来惊喜。
