不同抗原修复条件对肠癌MMR蛋白免疫组织化学染色效果的影响
2021-09-04李梅龙卫国钟安菁
李梅,龙卫国,钟安菁
(江苏大学附属医院,镇江212001)
随着内镜检查的普及,肠癌的发病率与检出率逐年提升,已成为威胁我国国民健康的第三大恶性肿瘤。约有15%的结直肠癌是由微卫星不稳定性(microsatellite instability,MSI)途径发生的,而DNA错配修复(MMR)基因的表达缺失、引起DNA复制过程中错配积累是MSI发生的原因[1]。MMR蛋白家族有许多成员,目前发现且已知对临床治疗有指导意义的主要包括以下4个:PMS2、MSH2、MSH6和MLH1,其常用检测方法为PCR法和免疫组织化学染色。因后者具有特异性强、敏感性高、快捷、易于推广等特点,已广泛应用于临床病人MSI的筛查。但由于免疫组织化学染色是个多环节、多因素影响的技术,其稳定可靠的染色结果依赖于个性化的优秀的染色方案和良好的质量控制。对于日常甲醛固定石蜡包埋的组织,其恰当的抗原修复,更是直接决定实验的成败。故笔者结合本室的实际情况,对50例肠癌标本MMR蛋白采用三种不同的抗原修复条件行免疫组化检测,探讨其最佳的染色条件。
材料与方法
1 材料
收集2018年~2019年经病理确诊的结直肠癌手术根治标本50例,要求入选病例为浸润癌,不包括原位癌和高级别上皮内瘤变。一抗PMS2、MSH2、MSH6、MLH1购于北京中杉(克隆号依次为:EP51、RED2、EP49、ES05);二抗及显色剂分别购于徕卡公司和罗氏公司;抗原修复液:柠檬酸缓冲液(pH 6.0)、EDTA缓冲液(pH 9.0)购于北京中杉,CC1缓冲液购于罗氏公司,余下试剂均购于迈新公司;BenchMark XT全自动免疫组织化学染色机购于罗氏公司。
2 方法
50例样本每例各切片3张,3μm厚,65℃烘片1h。将切片分别以3种不同修复条件进行抗原修复后进行染色。①柠檬酸缓冲液高温高压法:切片经二甲苯脱蜡、梯度酒精至水化、蒸馏水洗;以pH6.0柠檬酸缓冲液121℃高压,喷气计时2min,室温5min,自来水冲淋高压锅外壁,直至室温;PBS(pH7.2~7.4)洗2min×3次; 3%双氧水室温孵育10min,去除组织内源性过氧化物酶;非免疫羊血清室温孵育20min,降低非特异性染色;甩去血清,每张切片滴加100μl一抗,4℃过夜;取出切片,室温放置20min,使组织恢复至常温,PBS冲洗,2min×3次;每张切片滴加100μl二抗,室温孵育20min,PBS冲洗,2min×3次;DAB显色,室温5min;自来水冲洗,苏木精复染,梯度酒精脱水,二甲苯透明,中性树胶封固。②EDTA高温高压法:二甲苯脱蜡、梯度酒精至水化,蒸馏水洗;以pH9.0 EDTA缓冲液121℃高压,喷气计时2min,室温5min,自来水冲淋高压锅外壁,直至室温;余下操作同柠檬酸高温高压法。③CC1缓冲液BenchMark XT机法: pH8.5 CC1修复液100℃ 60min;一抗37℃孵育32min;二抗HRP-Multimer 37℃ 孵育8min;DAB显色37℃ 8min;苏木精复染,清洁切片,脱水透明封固。
结 果
MMR蛋白表达于肿瘤细胞的细胞核,其阳性对照可选用组织自身的内对照,即正常肠粘膜上皮细胞、淋巴细胞、肿瘤间质细胞等(核阳性着色)。
50例肠癌标本分别用不同抗原修复条件进行免疫组织化学染色后发现:44例标本中,在内对照均存在的情况下,3种抗原修复条件下的肿瘤细胞均表达MMR蛋白,但阳性强度从BenchMark XT机法、柠檬酸缓冲液高温高压法和EDTA缓冲液高温高压法依次增强,阳性数依次增多(图A1—A3);4例出现PMS2或(和)MLH1表达缺失,判为MSI-H;1例MSH2使用BenchMark XT机法出现假阴性(图B1—B3),1例PMS2肿瘤与非肿瘤细胞质弥漫性染色,定位错误,无法判读。
讨 论
MSI结直肠癌的筛查不仅具有提示预后、指导治疗等临床意义,而且有助于Lynch综合征患者的检出,为患者家族成员的肿瘤预防提供重要信息。PCR方法检测肿瘤MSI状态作为最早确立的鉴别MSI结直肠癌的分子手段[2],虽然具有很高的敏感性,但其费用较高,且需要一定的组织量。相比之下,使用免疫组化法检测具有经济、便利、稳定,所需组织量少,活检标本亦可检测,且检测结果与切除标本检测结果一致[3],能够为癌症晚期,不宜手术的患者在进行新辅助治疗前提供指导方向。另外,通过4种MMR蛋白的免疫组织化学染色结果观察,可以直接提示发生错配修复蛋白的类型,为Lynch综合征的确诊明确指向。但是,免疫组织化学染色结果受组织固定、染色条件、抗体克隆号不同等因素的影响[4],不同实验室间易造成一定的偏差。为此,本人结合科室现状,对染色条件中的抗原修复这一影响因素进行比较分析,以优化出适合本室的MMR蛋白检测条件。
恰当的抗原修复是免疫组织化学染色成功的重要前提。自20世纪90年代开始,抗原修复技术得以长足发展和广泛应用,数百种蛋白得以在福尔马林固定,石蜡包埋的组织中表达,为科学家们进行回顾性研究提供了可能。福尔马林属于交联性固定剂,可以造成蛋白质的交联,即在氨基酸分子间形成亚甲基桥,从而造成部分或大部分抗原结合位点的封闭。在进行免疫组织化学染色时,则需要断开醛键,打开蛋白之间的交联,重新暴露出抗原决定簇,以利于抗体的结合。目前常用的抗原修复方法有酶修复和热修复两种,后者因操作简便,适用于大多数抗原,被广泛使用。
影响抗原热修复的主要因素有:修复液的pH值、修复温度和修复时间。①当修复时间一定时,修复液的pH值是影响抗原修复效果的重要因素。修复液的pH值应根据抗体性质选择,有些抗体如CD20、CK(pan)等对修复液的pH无严格要求,在酸性和碱性修复条件下均可良好表达;而cyclin D1、HMB45等部分抗体,修复效果则随pH值增加而逐渐上升,更适宜用碱性的修复液。从本实验结果可以看出,MMR蛋白显然属于后者,同为高温高压修复,时间均为喷气计时2min,且其余染色操作完全一致的情况下,应用pH 9.0 的EDTA缓冲液修复的切片,染色效果更优于pH 6.0 柠檬酸缓冲液修复的切片。原因可能是EDTA与组织中的Ca2+形成螯合剂,可消除甲醛固定产生的不利因素[5]。②当选择相同或相近pH值的修复液时,修复温度和时间不同,其染色效果也相去甚远。在BenchMarkXT机染法与EDTA缓冲液高温高压法的比较中,其修复液pH值分别为8.5和9.0,酸碱度十分接近,但因为修复的温度和时间不同,最终应用EDTA缓冲液高温高压法修复的染色效果明显优于BenchMarkXT机染法。笔者认为,这是因为机器在通过加热块给组织修复时,温度一般在98℃~100℃,不能达到高压锅内的121℃,致使抗原暴露不充分。虽然BenchMarkXT染机法的热修复时间有60min,而EDTA缓冲液高温高压法修复时间仅仅为喷气计时2min,但是对于一些较难表达的核抗原,其修复温度影响更明显,原因可能是MMR蛋白对加热温度较为敏感,高温高压更有利于醛键的断裂,蛋白交联的打开,组织内抗原决定簇的充分暴露。可见,在抗原修复这一环节上,不同的修复液、不同的修复温度、不同的修复时间都会对最终的染色结果产生较大影响,有针对性地改善抗原修复条件,可以大大改善相关抗原的阳性表达效果,明显降低假阴性的概率[6]。
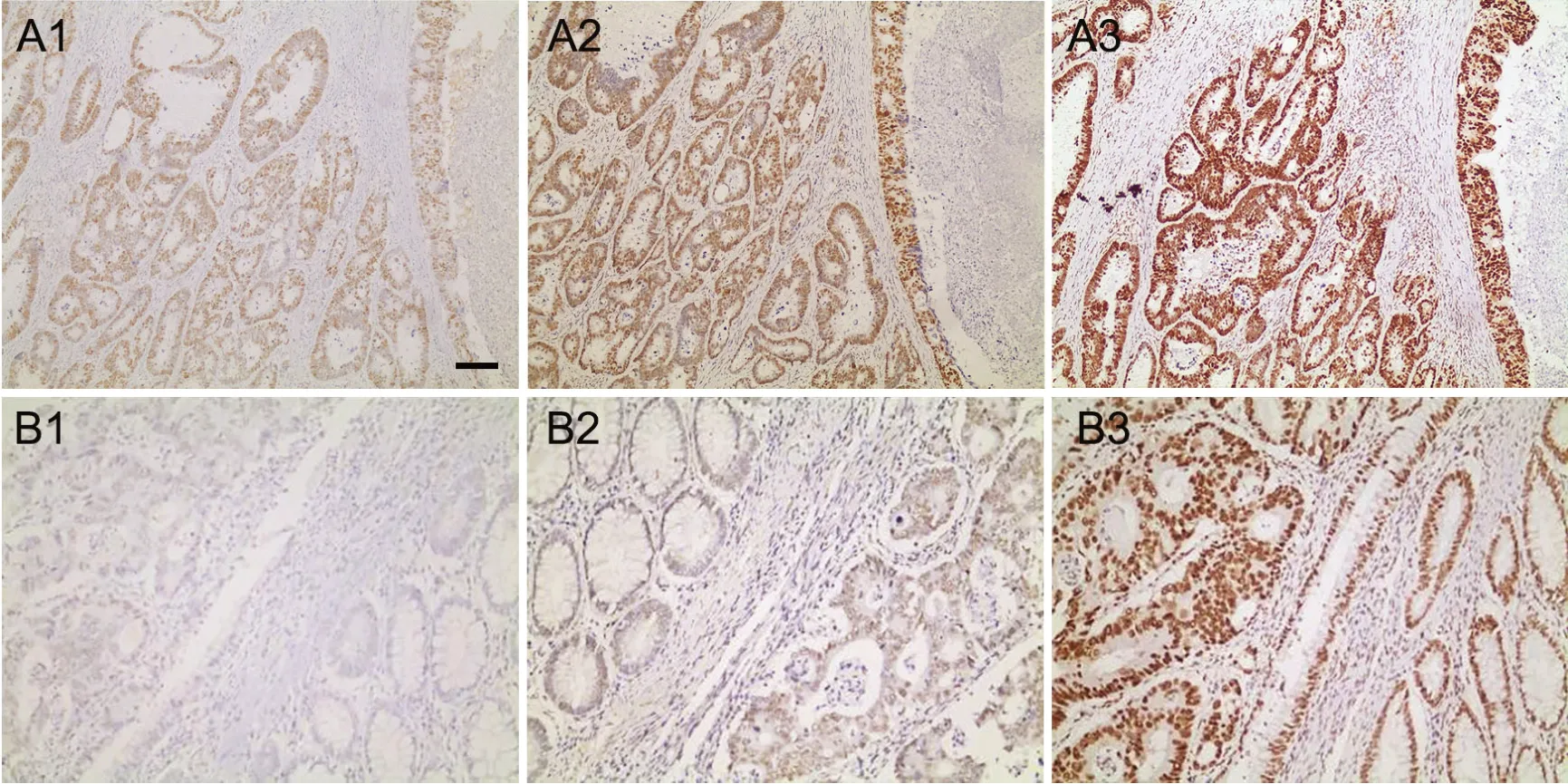
图1 不同抗原修复条件对MMR蛋白免疫组织化学染色效果影响的比较。A,MSH6免疫组织化学染色:A1,BenchMarkXT机法,肿瘤细胞弱到中等强度阳性,周边间质细胞弱阳性染色;A2,柠檬酸缓冲液高温高压法,肿瘤细胞、间质细胞及淋巴细胞均有中等程度的阳性表达;A3,EDTA缓冲液高温高压法,肿瘤细胞弥漫强阳性,内对照阴性,对比清晰。B,MSH2免疫组织化学染色:B1,BenchMarkXT机法,肿瘤细胞与内对照正常黏膜基底细胞、间质细胞均阴性;B2,柠檬酸缓冲液高温高压法,肿瘤细胞及周边正常腺体弱阳性;B3,EDTA缓冲液高温高压法:肿瘤细胞弥漫阳性,且信号强度明显优于柠檬酸缓冲液高温高压法染色,基底部正常腺体强阳。比例尺,20μmFig.1 Comparison of the effects of different antigenic retrieval conditions on the immunohistochemical staining results of MMR protein. A, immunohistochemical staining of MSH6: A1, tumor cells were weakly to moderately positive and peripheral stromal cells were weakly positive in sections treated with the BenchMarkXT machine method; A2, tumor cells, mesenchymal cells and lymphocytes were all moderately positive in sections treated with the citric acid buffer high-temperature and high-pressure method; A3, the tumor cells were diffusely and strongly positive and the internal control was negative in sections treated with the EDTA buffer high-temperature and high-pressure method, and the contrast was clear. B, immunohistochemical staining of MSH2: B1, tumor cells, normal mucosal basal cells and interstitial cells were negative in sections treated with the BenchMarkXT machine method;B2, tumor cells and surrounding normal glands were weakly positive in sections treated with the citric acid buffer high-temperature and high-pressure method; B3, tumor cells were diffusely positive in sections treated with EDTA buffer high-temperature and high-pressure method, and the signal intensity was stronger than that in sections treated with the citric acid buffer high-temperature and high-pressure method, and the normal glands at the base were strongly positive. Scale bar, 20μm
在肠癌MMR蛋白检测时,还应重视组织内对照:只有当内对照(肿瘤间质细胞、肠黏膜上皮细胞、淋巴细胞等)细胞核阳性而癌细胞全阴时,方能表明该蛋白缺失。当内对照阴性或着色明显低于肿瘤细胞时,结果难以判读,此时,可以尝试更换抗原修复条件,重新复做,避免因抗原暴露不充分而误判。特别是在全自动免疫组织化学染色仪广泛使用的今天,机染虽以高效、稳定、可重复性高等优点,为病理技术的标准化提供了基础,但是,在带来便利的同时,也迎来了新的挑战,如程序的设定、抗原修复液及修复温度的选择等。一般机器染色只支持一种pH的抗原修液,修复的温度最高为100℃,虽能满足大部分抗原的需要,但仍有些抗原因暴露不足,导致结果出现假阴性。本实验中出现的1例MSH2假阴性可能与此相关。
检测MMR蛋白表达情况通常可有效地反映肿瘤MSI状态[7],而只有从影响染色的多重因素着手,建立起适合本科室的个性化的染色条件,丰富病理医生的判读经验,减少各个环节的主观人为因素,才能为患者提供可靠的检测结果。同时,现阶段明确的四种PMS2、MSH2、MSH6和MLH1基因编码的蛋白只占MMR蛋白的大多数,尚有其它类型导致错配修复蛋白表达缺失的MMR基因有待于进一步探索。
