秸秆生物质炭DOM光谱特征及其与Cu2+的相互作用
2021-09-03李婉秋施暖暖MariosDrosos李恋卿潘根兴南京农业大学农业资源与生态环境研究所江苏南京210095
李婉秋,施暖暖,Marios Drosos,李恋卿,潘根兴 (南京农业大学农业资源与生态环境研究所,江苏 南京 210095)
土壤是支撑人类生存和发展的重要自然资源,随着中国工业、农业现代化的快速发展,工业“三废”的排放、化肥和农药的过量施用等问题,土壤重金属污染问题日益突出[1].铜(Cu)是动植物生长发育的重要微量元素,但是过量的 Cu会对动植物体造成危害[2-3],作为农田土壤的主要重金属污染物之一,Cu在我国耕地土壤中的点位超标率高达 2.1%[4].有机物质可通过吸附、沉淀、络合等作用影响土壤中Cu的迁移转化[5-6].罗春岩等[7]的研究发现,施用有机肥可以使砖红壤中的Cu、Pb由不稳定的可交换态和碳酸盐结合态向稳定的有机结合态和残渣态转化.溶解性有机质(DOM)是有机质中较活跃的组分[8],对 Cu在土壤中的转化起着重要的影响作用.Guo等[9]研究堆肥过程中的DOM与Cu的结合特性,发现类蛋白质组分比类腐殖质组分优先和 Cu结合.Araujo等[10]研究表明,施用牛粪增加了土壤中的DOM,从而促进Cu的迁移.近年来,生物质炭作为一种新型的环境功能材料不仅被广泛用于改良土壤,提高土壤肥力和农作物产量,其在土壤重金属污染修复方面也发挥着重要作用[11-12].由于生物质炭的DOM含有丰富的羧基、酚羟基等活性有机官能团,具有较高的芳香性,可以显著影响重金属的迁移转化特性.Dong等[13]发现甜菜残渣和巴西胡椒木生物质炭DOM中的羧基可以促进Cr(VI)还原为Cr(III)、As(III)氧化为 As(V),DOM 中的半醌自由基也参与了As(III)氧化的过程.Kim等[14]研究表明,300℃热解的污泥和水稻秸秆生物质炭含有大量的DOM,不仅促进了土壤中Fe的还原溶解,还可通过与磷酸盐的竞争解吸作用增强As在土壤中的迁移性.显然,在施用生物质炭前对生物质炭中DOM的性质进行研究极为重要.生物质炭中DOM的含量和组成在很大程度上受生物质炭的原料、热解温度等因素的影响[15-17].目前,大量研究集中于不同热解温度的生物质炭DOM组分的变化及其络合重金属特性的报道.Mukherjee等[18]研究表明,伽马草(Tripsacum floridanum)和橡木在 250℃热解的生物质炭比650℃释放更多的 DOM.Jamieson等[19]发现,与350℃相比,600℃制备的黄桦木和糖枫木生物质炭的 DOM 具有更高的芳香性和平均分子量.Xing等[20]研究发现随着热解温度升高,污泥生物质炭DOM中的类蛋白质和类腐殖质组分对Cu的络合亲和力均降低,其中500℃生物质炭DOM中类腐殖质组分与Cu亲和力较强,而类蛋白质组分在300℃生物质炭DOM中与Cu结合最快.已有学者研究了不同原料生物质炭DOM的特性,例如Zhang等[21]研究表明,300℃和500℃的玉米秸秆炭的DOM含量均比猪粪炭高,但关于原料对生物质炭中 DOM与 Cu相互作用特征的影响的比较研究仍然缺乏,因此有必要对不同原料制备的生物质炭的 DOM进行深入研究.
紫外-可见光谱以及荧光激发-发射矩阵(EEM)光谱结合平行因子(PARAFAC)分析可通过将复杂的 EEM 光谱分解成单独的荧光组分来定性和定量描述DOM的荧光组分[22],表征DOM的组成和性质.张海洋等[23]通过紫外-可见和三维荧光光谱分析发现随着秸秆的分解周期增长,秸秆源 DOM 的芳香性、腐殖化程度及分子量增加,类酪氨酸、类腐殖酸和类富里酸组分逐渐积累.Wei等[24]从菜籽饼生物质炭DOM中识别出3种类型的类腐殖质组分和1种类蛋白质组分,发现各组分与Cu的结合能力均较低.Guo等[25]利用 EEM-PARAFAC方法从沼液DOM 中鉴定出陆地源类腐殖质、微生物源类腐殖酸、类富里酸组分以及两种类色氨酸组分,并结合荧光猝灭实验进一步发现沼液DOM可以与Fe3+形成极其稳定的络合物.此外,利用同步荧光光谱的二维相关光谱(2D-COS)方法可定性的分析DOM与重金属的结合位点和顺序等特征.Huang 等[26]利用2D-COS方法分析发现Cd与DOM的结合首先出现在类蛋白质和类富里酸组分中,而类蛋白质和类腐殖酸组分对Cu的亲和力更强.
本研究以玉米、水稻和花生秸秆生物质炭为研究对象,利用紫外-可见光谱、三维荧光光谱和同步荧光光谱的二维相关分析等多种光谱分析技术,研究不同秸秆原料生物质炭DOM的组成及其与Cu2+的相互作用特性,以期为研究秸秆生物质炭对环境中重金属迁移特性的影响提供理论依据.
1 材料与方法
1.1 生物质炭的制备
将干燥且粉碎好的玉米秸秆、水稻秸秆和花生秸秆装入不锈钢罐中,封好后放于马弗炉内,先升温至 450℃后保持该温度 2h,然后在炉内冷却至室温,磨细过100目筛待用.
1.2 DOM提取与分析
将过100目筛的生物质炭与超纯水按1:20(m: v)的固/液比混合,在 220r/min和 25℃下振荡 24h后,于4000×g下离心30min,上清液通过0.45μm滤膜过滤,得到生物质炭DOM溶液,避光保存在4℃下以进行后续实验.使用 TOC分析仪(AnalytikJena,multi N/C3100)测定溶解性有机碳(DOC)含量,计算样品的DOM含量.玉米秸秆、水稻秸秆和花生秸秆生物质炭的DOM依次记作MSB-DOM、RSB-DOM和PSB-DOM.
1.3 DOM和Cu2+的络合滴定实验
为了使内滤效应最小化,将所有DOM溶液稀释至10.0mg/L[27].使用0.1mol/L NaOH或HCl溶液将溶液pH值调节至7.0±0.05,以避免沉淀.滴加不同量的0.1mol/L Cu(NO3)2溶液到50mL DOM溶液中,生成一系列的滴定样品,溶液中Cu2+的最终浓度为0、5、10、15、20、30、40、50、75、100μmol/L,为了避免浓缩效应,添加的 Cu2+溶液不超过 50μL.随后,将滴定的溶液在 25℃下避光摇动 24h,以确保达到络合平衡,最后对该溶液进行三维荧光、同步荧光和紫外-可见光谱分析.实验设3个平行样品.

1.4 光谱测定
对于紫外-可见光谱分析,使用紫外-可见分光光度计以1nm的间隔扫描200~800nm波长范围内的吸收光谱,以超纯水为空白.
SUVA254常被用来表征DOM的芳香化程度[28],计算公式如下:
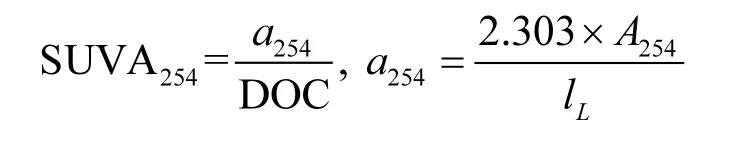
式中:a254是样品在波长254nm处的吸收系数,m-1; A254是波长254nm处的吸光度;lL是比色皿的长度,m.
紫外光谱可分为波长低于190nm或190nm左右的局部激发带(LE),190~240nm 之间的苯环吸收带(Bz),波长高于 240~250nm 的电子转移带(ET).用253nm和220nm处吸光度的比值来表示EET/EBz,与芳香环上的取代基的种类和取代程度有关[29].
DOM样品的荧光光谱使用荧光光谱仪(F97Pro,上海棱光)进行测定.三维荧光光谱扫描的激发(Ex)波长范围为200~450nm(增量为 5nm),发射(Em)波长范围为 250~550nm(增量为 1nm),扫描速度为2400nm/min,激发和发射狭缝均为 5nm.同步荧光光谱的激发波长在 250~550nm 范围内,恒定偏移量Δλ=60nm,激发和发射狭缝宽度为 5nm,扫描速度设定为240nm/min.以超纯水为空白.
1.5 平行因子(PARAFAC)分析和络合模型
应用PARAFAC建模来识别生物质炭DOM的荧光组分,使用 Matlab R2019b中的 drEEM 和N-Way工具箱运行并验证PARAFAC模型[22].鉴于不同DOM的三维荧光光谱之间存在显著差异,分别使用每种生物质炭DOM络合滴定的30个样品进行PARAFAC分析.数据集使用2至7个组分的模型拟合,通过裂半分析、残差分析和目测确定了最佳组分数,并获得各组分的最大荧光强度(Fmax),表示 DOM组分的相对含量.
使用改进后的Stern-Volmer络合模型[30]来确定Cu2+与DOM中单个荧光组分的络合能力,该方法基于总配体结合的比例与荧光强度之间存在线性关系,并且假设金属离子与配体形成 1:1的络合物.改进的Stern-Volmer方程表示如下:
式中:F0和 F分别代表在不添加 Cu2+和不同Cu2+浓度CM(mol/L)时DOM组分的荧光强度.KM表示DOM与Cu2+之间的络合稳定性常数,f是络合能力,代表参与Cu2+络合的荧光团比例,KM和f都是从线性拟合获得的参数.
1.6 二维相关(2D-COS)分析
为了研究Cu2+与DOM结合的位点、顺序,使用不同浓度的Cu2+作为外部扰动,对络合后的DOM样品的同步荧光光谱进行 2D-COS分析.2D-COS分析是根据 Noda和 Ozaki[31]的方法,使用“2D Shige”软件进行分析.
1.7 数据分析
使用SPSS 20.0软件进行统计分析,通过单向方差分析(ANOVA)分析数据,并使用Duncan多范围检验进行显著性差异检验,所有显著性水平均为 0.05(P<0.05).所有图形均由 Origin 2020和 Matlab R2019b软件绘制.
2 结果与讨论
2.1 秸秆生物质炭DOM含量及紫外-可见光谱特征分析
由表1可知,3种生物质炭DOM的含量范围为3.14~8.13mg/g,其中 PSB的DOM 含量最高,分别为RSB和MSB的2.4和2.6倍.由紫外-可见光谱参数可知,RSB-DOM和PSB-DOM的SUVA254值显著高于 MSB-DOM(表 1),SUVA254与芳香族化合物和腐殖质中碳的C=C键和C=O键有关[28],通常与DOM分子量呈正相关[32].表明RSB和PSB的DOM中存在更多的芳香族化合物或大分子有机物,分子量相对更大.此外,SUVA254还可以表征DOM的亲疏水性特征,当 SUVA254>4L/(mg·m)时,表示主要为疏水性组分,尤其是芳香物质,而 SUVA254<3L/(mg·m)则表示亲水性组分的比重较大[33].在本研究中,3种DOM的SUVA254值均小于3,表明DOM主要由亲水性物质组成,芳香性相对较低.赵敏等[34]的研究也发现在一定裂解温度下的楠竹和柏木生物质炭DOM均呈现较高的亲水性.同时,这3种DOM的EET/EBz值表现 为 :PSB-DOM>RSB-DOM>MSB-DOM,表 明PSB-DOM的芳香结构中可能含有更多的含氧官能团[35],其次是RSB-DOM,而在MSB-DOM芳香结构中的含氧官能团较少.

表1 生物质炭DOM的紫外-可见光谱参数Table 1 UV-Visible spectral parameters of biochar DOM
2.2 秸秆生物质炭DOM的荧光组分分析
由图 1可知,MSB和 RSB-DOM 中的 C1(λEx/λEm=340/399nm 和 λEx/λEm=310/425nm),PSB-DOM中 的 C1(λEx/λEm=320/390nm)和 C2(λEx/λEm= 320(350)/440nm)均属于可见区类富里酸物质[36-37],这与Yang等[38]研究中来自污泥生物质炭DOM的M峰类似,类富里酸组分与羟基、羧基相关,腐殖化程度较低.此外,PSB-DOM中C2的荧光峰位置与C1相比,可能发生了红移,表明其可能具有更复杂的结构,芳香性和疏水性更强.MSB和RSB-DOM的C3分别位于 λEx/λEm=380(310)/442nm,385(270)/453nm 处,均为陆源类腐殖质组分,属于较短波长类腐殖酸组分,其分子结构比类富里酸组分复杂[39],分子量和腐殖化程度介于类富里酸组分和较长波长类腐殖酸组分之间.MSB、RSB和PSB-DOM 中的 C4组分(λEx/λEm=355(395)/500nm、355(410)/510nm 和 275(405)/493nm)均属于类腐殖质C峰,其位于更长的激发和发射波长处,可能具有高分子量、较高的芳香性和疏水性等特征,结构更为复杂[26,40].RSB-DOM 的C5(λEx/λEm=295/371nm)是一种类似于色氨酸的类蛋白质组分[26,41],分子结构与其他组分相比较简单,属于DOM中可生物的降解部分[42].

图1 通过EEM-PARAFAC分析鉴定的DOM的荧光组分Fig.1 Fluorescence components of DOM identified by EEM-PARAFAC analysis
利用 PARAFAC方法进一步分析生物质炭DOM 中各荧光组分的定量信息(图 2).如图 2所示,除 RSB-DOM 含有少量的类色氨酸组分外,生物质炭DOM的荧光组分主要由类富里酸和类腐殖酸物质组成,这与其他研究的结论一致,Zhang等[21]发现,玉米秸秆炭和猪粪炭的DOM主要包含类腐殖酸和类富里酸组分.同种原料生物质炭DOM中各荧光组分的分布均有显著差异,MSB和 RSB-DOM 中 C1的 Fmax显著高于其他组分,占总组分的 55.03%和54.93%,C3组分的 Fmax占比分别为 31.31%和17.62%;PSB-DOM中C2、C1的Fmax显著高于C4,分别占总组分的 44.86%和 41.43%.三种生物质炭DOM中 C4组分的 Fmax都较低,占比仅为13.66%~14.40%,表明类富里酸组分在生物质炭DOM中占主导地位,而较长波长的类腐殖酸组分的含量相对较低.此外,RSB-DOM中还含有13.05%的类色氨酸组分 C5.不同原料相比,虽然在 MSB-DOM 中 C1和C3的Fmax均显著高于RSB,C4组分的Fmax则表现为 PSB-DOM 显著高于其他两种生物质炭.不同秸秆生物质炭DOM组分的差异可能与原料的有机物质组成不同有关.研究表明花生秸秆和玉米秸秆的木质素含量比水稻秸秆高[43],而纤维素、半纤维素和木质素等有机物质的热分解特性存在差异,半纤维素在 220~315℃内分解,产物主要为酮类和呋喃类,纤维素分解温度为315~400℃,主要热解为呋喃类和脱水糖类,而木质素分解温度范围相对较宽(200~500℃),主要产物为酚类[44-46].此外,原料中的无机矿物也对生物质的分解有影响.有研究表明,与水稻秸秆相比,花生秸秆的Ca含量较高[47],Ca可以通过抑制纤维素的分解[24,48],降低左旋葡萄糖的生成[49].

图2 生物质炭DOM中荧光组分的最大荧光强度(Fmax)(a)和比例(b)Fig.2 Maximum fluorescence intensity (Fmax) (a) and proportion (b) of fluoresence components in biochar DOM
2.3 秸秆生物质炭DOM组分与Cu2+的相互作用
由图3可知,除RSB-DOM的C5组分外,所有类腐殖质组分的荧光强度均随 Cu2+添加量的增加呈现下降趋势,表明 Cu2+对类富里酸和类腐殖酸组分均有明显的猝灭作用,其中组分C4在添加Cu2+后显著猝灭,与未添加 Cu2+相比,在 100μmol/L 的 Cu2+浓度下,MSB-DOM、RSB-DOM和PSB-DOM中C4的Fmax分别降低了51.9%、46.2%和59.0%,明显高于C1、C2及 C3的猝灭比例(18.3~35.5%、27.5~30.9%和38.3~54.5%),表明较长波长的类腐殖酸组分 C4与Cu2+有更强的结合能力,并且C4与Cu2+的结合能力表现为 PSB-DOM>MSB-DOM> RSB-DOM,这些荧光组分间猝灭程度的不同可能是由于组分与 Cu2+的结合的官能团种类和数量不同等原因造成的[50].
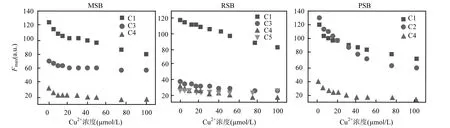
图3 生物质炭DOM组分滴加Cu2+后的荧光猝灭曲线Fig.3 Fluorescence quenching curves of biochar DOM components with the addition of Cu2+
与大多数组分发生荧光猝灭不同,RSB-DOM中C5的Fmax表现为在Cu2+浓度<50μmol/L时降低而在高浓度时增加(图 3),表明类蛋白质和类腐殖质组分与Cu2+的结合机制存在差异[51].C5的Fmax增加可能是由于高浓度的 Cu2+引起类蛋白质组分的三维结构发生了变化,进而可能导致荧光的量子产率发生改变;或通过与无机或其他有机成分之间相互作用,类蛋白质物质可能发生了荧光猝灭[41,52].
2.4 秸秆生物质炭 DOM 组分与 Cu2+的络合参数特征
利用改进的Stern-Volmer方程进一步拟合络合的条件稳定常数(logKM)及结合荧光团比例(f),结果如表 2所示.三种生物质炭DOM 组分的 F0/(F0-F)与1/CM之间均具有良好的线性关系(R2=0.88-0.99),表明该方程较好地描述了荧光猝灭过程.由于RSB-DOM中的类色氨酸组分(C5)没有随Cu2+浓度增加呈下降的趋势,未能对其结合特征进行建模.由表可知,三种生物质炭 DOM 的组分与 Cu2+结合的logKM值总体表现为:PSB-DOM>MSB-DOM>RSB-DOM.MSB和RSB-DOM中C3和C4的logKM高于C1,PSB-DOM中C4的logKM高于C1和C2,表明 Cu2+与类腐殖酸组分的络合亲和力比类富里酸组分强,这可能与类腐殖酸物质的芳香性和腐殖化程度较高有关[27].在不同的 DOM 中,MSB和RSB-DOM 组分的 logKM值均为:C3>C4,表明较短波长的类腐殖酸组分比较长波长组分的络合稳定性更高.而PSB-DOM中的logKM值则表现为C1>C2,表明较短波长的类富里酸组分比较长波长的组分优先与Cu2+结合,这种差异可能是由于DOM的异质性和光谱特性的不同所致[51,53].
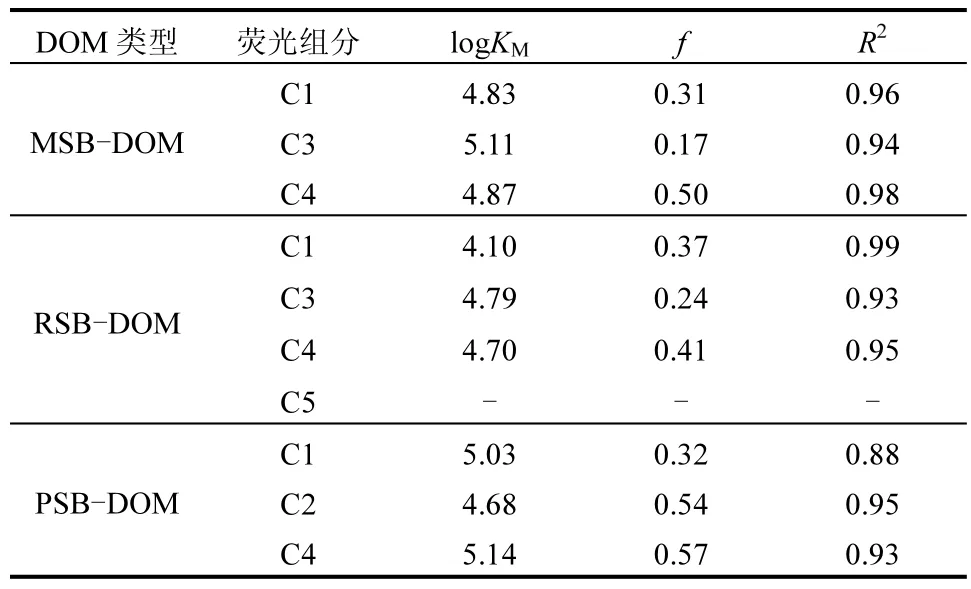
表2 生物质炭DOM的荧光组分与Cu2+的结合参数Table 2 Binding parameters of Cu2+ and fluorescence components of biochar DOM
从结合荧光团比例来看,MSB和RSB-DOM中组分C3的logKM值高于C1和C4,但f值却呈现相反趋势,这可能是由于C3与Cu2+相互作用形成了多齿复合物[54],或可能是 C3的含氧官能团较少的原因.C4的f值在不同DOM中始终最高,可能与C4的腐殖化程度高、有机配体比C1和C3多有关.已有研究表明芳香结构可通过提供重金属的结合位点参与阳离子-π的相互作用[55].此外,PSB-DOM 中类富里酸及类腐殖酸组分的 f值均高于 MSB和RSB-DOM,说明PSB-DOM中荧光组分与Cu2+的络合能力较强,这可能与PSB-DOM的芳香性较强、且芳香结构中含氧官能团较多的因素有关.
2.5 二维相关光谱(2D-COS)分析
DOM与Cu2+络合的同步荧光光谱的二维相关分析谱图见图4.同步荧光光谱可根据250~300nm、300~380nm 和 380~500nm 三个波长范围内的峰来表示类蛋白质、类富里酸和类腐殖酸组分[56].如4a-4c所示,三种 DOM 的主要自峰分别位于 342、346和 358nm处,所有交叉峰均为正交叉峰,这表明三种DOM中对应区域的荧光强度均随着Cu2+浓度的增加而降低;3个自峰均代表了类富里酸组分,且自峰的强度顺序为:PSB>MSB>RSB,表明与其他组分相比,类富里酸组分对 Cu2+浓度的变化有较高的敏感性,并且PSB-DOM较容易受到Cu2+的影响.
异步光谱图能够反映出添加重金属离子后不同位点荧光强度的变化特征,进而揭示DOM与重金属离子的络合位点与顺序.图4d显示,MSB-DOM与Cu2+结合的异步图在对角线左上方的343/387(410、469)nm处存在3个负交叉峰,322/343nm处有1个正交叉峰,根据Noda的规则[57],MSB-DOM 与 Cu2+的结合亲和力的顺序为 387nm→410nm→322nm→469nm→343nm,即短波类腐殖酸→短波类富里酸→长波类腐殖酸→长波类富里酸.RSB-DOM 的异步图谱(图 4e)显示,对角线上方出现 3个负交叉峰:350/412(434、460)nm,1个正交叉峰在330/350nm处,与 Cu2+的结合顺序为 460nm→434nm→412nm→330nm→350nm;PSB-DOM 的异步图谱(图 4f)显示,在对角线左上方的 359/419(466)、294/320nm 处的交叉峰为负,在320/359nm有1个正交叉峰,Cu2+的络合 顺 序 为 419nm→466nm→320nm→359nm→294nm,即短波类腐殖酸→长波类腐殖酸→短波类富里酸→长波类富里酸→类蛋白质.由此可见,三种生物质炭的DOM均表现出类腐殖酸比类富里酸组分优先与 Cu2+发生相互作用.有研究表明,由于类腐殖质的高芳香性,其与 Cu2+的反应比类蛋白质组分更快[58-59].此外,在 EEM-PARAFAC 分析中, PSBDOM中没有鉴定出类蛋白质组分,而在2D-COS分析中观察到类蛋白质位点与 Cu2+结合,表明 2DCOS分析的敏感度较高.

图4 生物质炭DOM与Cu2+络合的同步/异步二维相关图Fig.4 Synchronous and asynchronous 2D correlation maps for biochar DOM complexed with Cu2+
3 结论
3.1 生物质炭中DOM的含量和性质因原料不同而存在差异.PSB的DOM含量显著高于MSB和RSB;三种秸秆生物质炭的DOM主要为亲水物质,具有较低的芳香性,其中 RSB-DOM 的芳香性、分子量相对较大,PSB-DOM 芳香结构中的含氧官能团含量相对较高.
3.2 PARAFAC分析鉴定显示,三种DOM的组分主要以类富里酸和类腐殖酸为主,仅在 RSB-DOM 中分离出类色氨酸组分.
3.3 DOM组分与Cu2+络合顺序均为:类腐殖酸>类富里酸.PSB-DOM 中的类腐殖质组分与 Cu2+的络合能力和亲和力均高于MSB-DOM和RSB-DOM.
