基于改良ASM1的SNAD工艺启动和优化
2021-09-03王朝朝闫立娜殷耀兵武新娟殷春雨李思敏河北工程大学能源与环境工程学院河北省水污染控制与水生态修复技术创新中心河北邯郸05608北京工业大学环境与能源工程学院北京004河北工程大学材料科学与工程学院河北邯郸05608
王朝朝,高 鹏,闫立娜,殷耀兵,张 欢,武新娟,殷春雨,马 骏,李思敏* (.河北工程大学能源与环境工程学院,河北省水污染控制与水生态修复技术创新中心,河北 邯郸 05608;.北京工业大学环境与能源工程学院,北京004;.河北工程大学材料科学与工程学院,河北 邯郸 05608)
近年来研究发现,在单级反应器内可以实现同步亚硝化-厌氧氨氧化耦合异养反硝化(SNAD)工艺,即在微氧条件下,首先通过氨盐氧化菌(AerAOB)积累NO2--N,然后利用厌氧氨氧化菌(AnAOB)去除NH4+-N和NO2--N,最后生成的NO3--N通过反硝化菌(DNB)去除[1-2].由于自养与异养功能微生物耦合使SNAD工艺呈现脱氮性能良好、运行能耗低等显著优点,使其成为污水生物脱氮领域的研究热点[3-4].
目前,研究人员已经通过采用不同类型的反应器处理多种废水,实现了 SNAD工艺的启动[3,5-9];并且通过分子生物学技术对 SNAD工艺解析发现,该工艺的主要功能菌分别为 Nitrosomonas (AerAOB),Candidatus Jettenia (AnAOB),和Denitrisoma(DNB)[5];此外,关于 SNAD 工艺优化调控的研究发现,进水 C/N 比(0.0~2.0)增加,SNAD 工艺对氮素的去除负荷得到不断强化,且在进水C/N比为1.0左右时,系统内自养与异养脱氮功能菌趋于最优耦合状态[10-11].然而,SNAD工艺内种群结构多样、菌群关系复杂,致使该工艺启动过程耗时较长;此外,采用C/N比优化时,SNAD工艺反应过程与功能菌群动态解析难度加大,致使SNAD工艺推广应用受到极大限制.
随着计算机技术快速发展,水处理数学模型也趋于成熟[12].活性污泥模型(ASM)作为应用工具,不仅可以模拟污水处理过程和结果,而且可以解析微生物的动态变化[13].研究表明,通过向ASM1模型中加入厌氧氨氧化反应过程构建改良 ASM1模型,可以有效模拟厌氧氨氧化反应过程的系列工艺[14-15].同时,可以通过改良ASM1模型探究环境因素、控制条件等对工艺脱氮性能及微生物菌群结构的影响[16-18].然而,关于SNAD工艺启动模型的构建、菌群动态解析及其优化控制的研究却鲜有报道.
本研究采用UMSB-MBR反应器启动SNAD工艺,并基于改良ASM1模型,拟构建SNAD工艺数学模型,并对模型进行校正和检验;通过模型分析,考察 SNAD工艺启动过程中运行效能与微生物功能菌群动态变化;通过模型预测,考察不同C/N比条件下SNAD工艺运行效能及功能菌群的变化趋势,以期为SNAD工艺的快速启动和优化控制提供理论指导与技术支持.
1 材料与方法
1.1 实验材料和方法
1.1.1 实验装置 采用微氧升流式膜生物反应器(UMSB-MBR),如图1所示,其有效容积为4.5L,反应器柱体部分外设置水浴套筒保持反应器的温度维持在(33±1)℃;反应器底部设置曝气头调节反应器内 DO;进水由高位水箱补入反应器内;通过MBR膜组件排入产水箱实现产水,MBR膜组件的运行通量为 2.5~15L/(m2·h);配水中投加碳酸氢钠,将 pH 值调节为(7.5±0.3);反应器设置回流(由反应器上部至底部)控制反应器内上升流速.反应器具体运行条件如表1所示.

图1 UMSB-MBR反应器装置Fig.1 Schematic diagram of the UMSB-MBR reactor

表1 不同阶段运行参数Table 1 Operating parameters during different phases
1.1.2 实验用水和接种污泥 实验采用人工合成废水,其主要底物包括:NH4+-N、NO2--N和COD(分别为氯化铵、亚硝酸钠和乙酸钠),其他底物组分详见表2.反应器内共进行2次污泥接种,初始接种为厌氧氨氧化颗粒污泥(共计1L, MLSS为30g/L),取自稳定运行 3a的处理养牛废水的中式厌氧氨氧化工艺反应器;CANON工艺启动时,补充接种污泥为河北省邯郸市东部污水处理厂氧化沟工艺中的活性污泥(共计500mL,MLSS为3750mg/L).
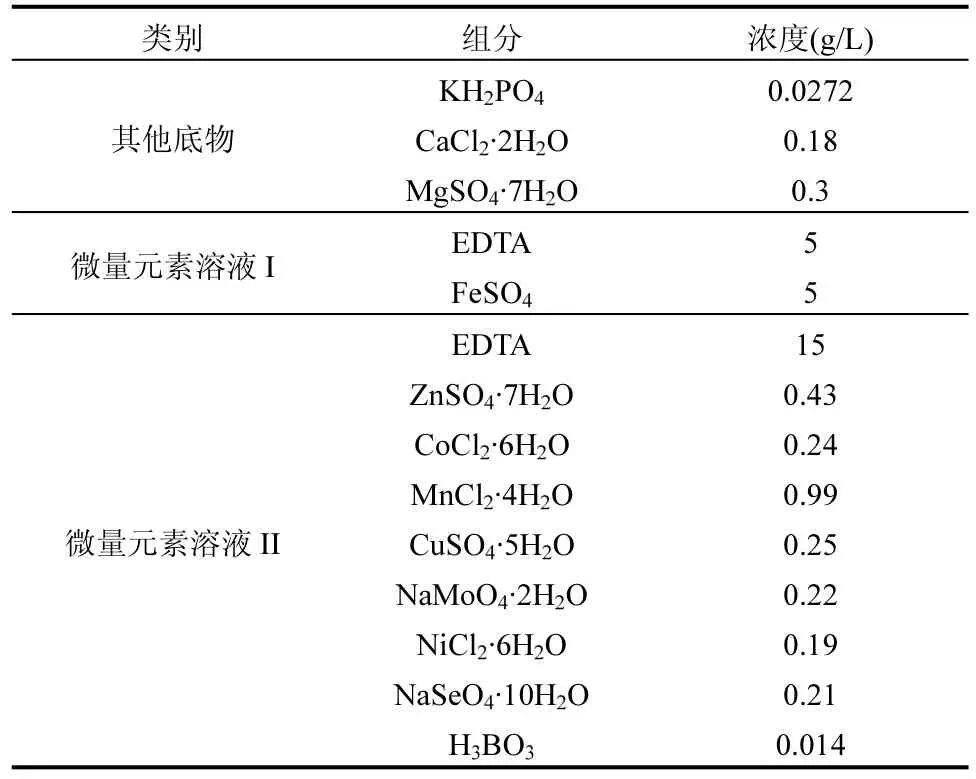
表2 合成废水的其他成分和微量元素Table 2 The other components and the trace elements in thesynthetic wastewater
1.1.3 分析方法 COD、NH4+-N、NO3--N、NO2--N、TN、MLSS和MLVSS根据标准方法测量;总氮(TN)通过NH4+-N、NO2--N和NO3--N累加表示[19];pH值,DO和温度通过便携式水质监测仪(WTW Multi 3420i, Germany)测定.
1.2 模型的构建
1.2.1 模型的选择 模型以加入厌氧氨氧化反应的改良ASM1模型为基础,主要工艺包括:厌氧氨氧化工艺、CANON工艺和SNAD工艺;根据微生物分子生物测序分析,主要功能微生物包含:好氧氨氧化菌(AerAOB)、厌氧氨氧化菌(AnAOB)、异养反硝化菌(DNB)和亚硝酸盐菌(NOB)[5];主要降解反应包括:水解过程和AerAOB、AnAOB、NOB和DNB的生长和衰减过程[16],通过以上部分构建数学模型.该模型共涉及13种组分、12种反应、12组化学计量学矩阵、31个计量学参数和 7项转化速率公式,如表3~7所示[16].

表3 模型的组分定义Table 3 Definition of components in the model

表4 模型的动力学速率方程Table 4 Kinetic rate equations in the model

表5 模型的动力学和化学计量学参数Table 5 Kinetic and stoichiometric parameters in the model

续表5

表6 模型的化学计量学矩阵Table 6 Stoichiometric matrix in the model

表7 微生物对氨氮、亚硝酸盐和硝酸盐的转化速率公式Table 7 Formulas of transformation rates of ammonia nitrogen, nitrite and nitrate by different microorganisms
1.2.2 模型的构建和校正 将实验装置和运行方案在AQUASIM 2.0软件中进行构建[16].采用两个恒定容积的完全混合反应器串联,同时设置曝气完全混合器,通过扩散连接调节反应器内溶解氧环境;通过污泥回流连接,并设置污泥回流量为100%实现反应器MBR膜产水,具体流程如图2所示.根据实验的运行方案,调节工艺模拟流程的变量,根据开关参数的方式,依次基于前阶段模型的基础上,构建了SNAD工艺数学模型.

图2 AQUASIM中模型工艺流程Fig.2 The process flow diagram of the model in AQUASIM
AQUASIM软件具有参数灵敏度分析和参数的校正功能.首先通过参数灵敏度分析,得到参数与底物变化的关系程度;然后基于实验数据,根据灵敏度由大到小,通过参数校正功能进行参数校正;校正后的模型对实验进行模拟,通过对比模拟与实验的结果,检验模型的有效性.校正后的模型参数和数值如表8所示[27].

表8 模型参数的校正和数值Table 8 Corrections and values of the model parameters
1.3 计算公式
进水TN负荷(NLR)、NH4+-N去除率(ARE)、TN去除率(NRE)、TN去除负荷(NRR)、COD去除率(CRE)、ΔNO2--N/ΔNH4+-N 和 ΔNO3--N/ΔNH4+-N、厌氧氨氧化反应脱氮贡献率(Eanammox)和反硝化反应脱氮贡献率(Edenitrification)其计算方法如下:

式 中 :NH4+-NInf、 TNInf、 CODInf、 NO3--NInf和NO2--NInf分别为进水的氨氮、总氮、COD、硝态氮和亚硝态氮的浓度,mg/L;NH4+-NEff、TNEff、CODEff、NO3--NEff和NO2--NEff分别为出水的氨氮、总氮、COD、硝态氮和亚硝态氮的浓度,mg/L;(7,8,9和10)#SS分别为水解反应、异养DNB的有氧生长反应、异养DNB的利用亚硝酸盐缺氧生长反应和异养DNB的利用硝酸盐缺氧生长反应的化学计量学矩阵COD系数;(3,5和10)#SNO3分别为NOB的生长反应、AnAOB的生长反应和异养 DNB的利用硝酸盐缺氧生长反应的化学计量学矩阵NO3--N系数.
2 结果与讨论
2.1 启动过程性能变化和模型检验
本实验用时 179d,历经厌氧氨氧化工艺和CANON工艺,成功启动了 SNAD工艺,解析了启动过程运行策略对效能的影响[2,28],并建立了启动过程的数学模型,模型和实验工艺性能数据如图 3所示,模型与实验性能数据具有很好的吻合性,表明校正后的模型对启动过程具有良好代表性.
厌氧氨氧化工艺过程性能变化如图 3(阶段I~VI)所示.接种第 1d,厌氧氨氧化的脱氮性能羸弱,ARE和 NO2--N去除率仅为44.74%和47.45%;经过8d的恢复培养,ARE和NO2--N去除率提高至94.86%和 98.11%,NRR 逐步增至 0.194kg/(m3·d).这是由于在厌氧和低底物浓度的条件下,接种污泥品质良好,脱氮性能得到快速恢复[29].阶段II和III中,进水NLR分别达到0.36和0.46kg/(m3·d),改变初期脱氮性能被削弱.通过稳定运行后,NRE分别达到81.28%和 84.51%,NRR分别逐步增大为 0.301和0.397kg/(m3·d).阶段 IV~VI,分别缩短 HRT 至 12.04,8.05和6.03h,调整初期性能趋势与阶段Ⅱ和Ⅲ相同,稳定运行后,NRE均达到80%以上,NRR逐步增大至1.484kg/(m3·d)(阶段Ⅵ).同时在阶段 VI时,ΔNO2--N/ΔNH4+-N比为1.29近似于理论比值1.32,ΔNO3--N/ΔNH4+-N比为0.234近似于理论比值0.26,整体趋势在理论比值上下波动,基本符合厌氧氨氧化反应规律[30].
CANON工艺过程性能变化如图3(VII~XI阶段)所示.启动的第1d,由于补充接种污泥中AerAOB浓度低而且不适应环境,导致AnAOB底物NO2--N严重缺失,NRE和ARE分别仅为0.36%和1.80%.经过8d运行,由于AerAOB逐步适应环境,NRE和ARE分别上升到 13.72%和 16.69%,NRR提高至0.0603kg/(m3·d),脱氮性能缓慢上升.阶段 VIII和 IX中,随着 DO的提高,NRE依次上升到 55.20%和78.13%,在AerAOB和AnAOB协同的作用下脱氮性能不断提高,表明提高 DO促进了 AerAOB的富集[2,31].接种污泥中可能会涉及 NOB,NOB会与AnAOB竞争底物(NO2--N),研究发现 DO 在 0.2~0.4mg/L时,既可以促进 AerAOB的富集,又可被AnAOB适应,同时有效抑制NOB[32].所以,阶段X和XI中调节 DO 保持在 0.2~0.4mg/L,分别缩短 HRT至 8.02和 6.05h,运行初期由于氮负荷(0.63和0.84kg/(m3·d))的冲击,脱氮性能被削弱.经过运行后,NRE分别提升至63.12%和70.62%,NRR最终达到 0.592kg/(m3·d),ARE 可达到 90%以上,并且ΔNO3--N/ΔNH4+-N比值在 0.11附近,符合CANON工艺的化学方程参数比值,实现了 AnAOB和AerAOB协同脱氮[7].
SNAD工艺过程性能变化如图3(阶段XII)所示.相较阶段XI,第1d的出水NO2--N和NO3--N浓度分别下降了21.99和7.68mg/L,这是由于反硝化的进行;通过 29d的运行,NRE趋于 87.66%,ARE达到94%左右.表明了DNB同AnAOB和AerAOB协同脱氮除碳,完成了SNAD工艺的启动[6].
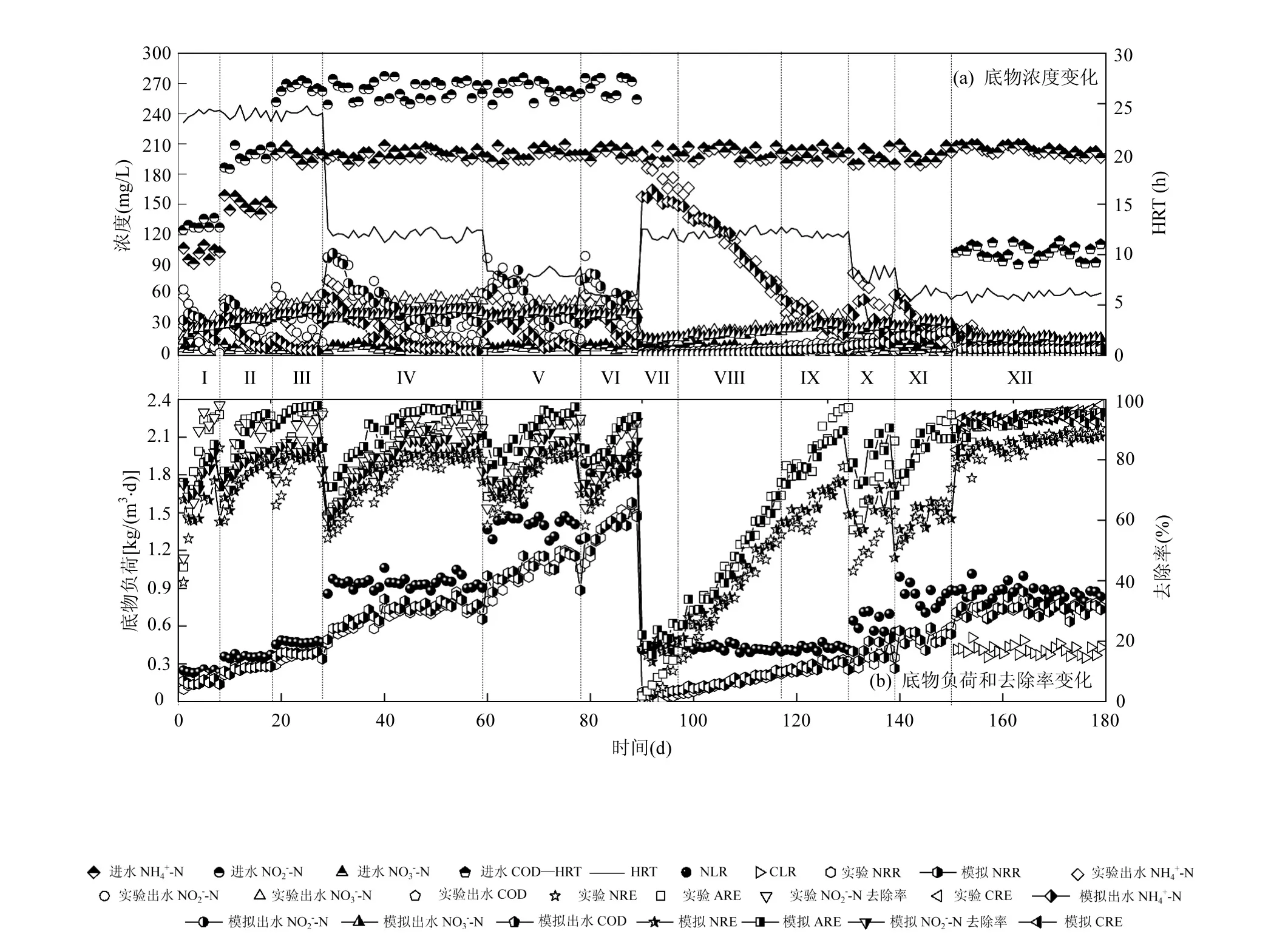
图3 SNAD工艺启动过程不同阶段的运行性能Fig.3 The start-up performance of the SNAD process during different operational phases
2.2 SNAD工艺启动过程微生物变化
2.2.1 SNAD工艺启动过程功能菌浓度变化 基于校正后的水处理数学模型,其功能菌浓度的变化如图 4所示.厌氧氨氧化工艺中,初始 AnAOB、AerAOB、DNB和 NOB浓度很低,分别为 121.40,50.00,50.00和 196.30mg/L,这是由于颗粒污泥经过运输导致部分功能菌处于休眠.通过提高氮负荷的方式,AnAOB浓度分别在 I~VI末期分别增长到203.60,403.50,698.60,2428.00,4003.00和5137.00mg/L,同时AnAOB的增长速率与氮负荷增大幅度成正比[2].CANON 工艺时,补充接种污泥,致使初始AerAOB、DNB和 NOB浓度变为 58.41,114.4和25.21mg/L.阶段VII~IX中,随DO的升高,AnAOB浓度阶段末分别为 5122,5100和 5210mg/L,表明AnAOB生长受到一定抑制;DO促进AerAOB生长不断富集至84.90,236.50和 394.80mg/L;阶段X和XI中,随氮负荷的增加,AnAOB和AerAOB不断生长,同时 AerAOB的增长速率不断增大分别为16.556和23.155mg/(L·d),表明在微氧环境,缩短HRT加快AerAOB的增殖速率[33].SNAD工艺启动,因有机物的加入,DNB菌迅速富集到 87.40mg/L,同时AnAOB和 AerAOB进一步生长,NOB浓度趋于0mg/L, AnAOB、AerAOB和DNB互不影响实现协同脱氮.
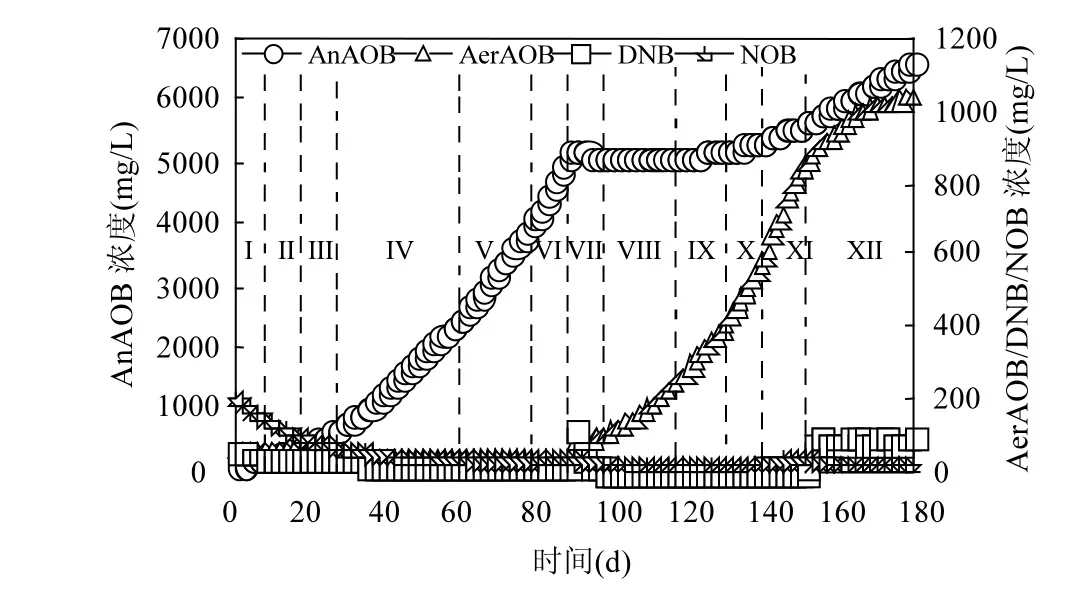
图4 SNAD工艺启动过程不同阶段的功能菌浓度Fig.4 Functional bacteria concentration of the SNAD process during different operational phases
2.2.2 SNAD工艺启动过程功能菌活性变化 基于模型,表征了功能菌转化速率的变化如图 5所示.厌氧氨氧化工艺过程, RAN_NH4,RAN_NO2和RAN_NO3逐步增大,表明AnAOB活性随着氮负荷的增大不断增强[11]; RNOB_NO2,由 0.0087kg N/(m3·d) 增 加 到0.03392kg N/(m3·d),表明NOB 具有一定的活性,这是由于接种的污泥中具有一定浓度的 NOB,同时进水中有微量的DO[33].CANON工艺过程,初期AnAOB活性呈现断崖式下降 RAN_NH4, RAN_NO2和RAN_NO3分别仅为 0.033,0.037 和 0.005kg N/(m3·d),这是由于AerAOB浓度和活性均很低,降解产物NO2--N严重不足,同时微氧的环境对 AnAOB活性产生一定抑制[34];阶段 VII~IX,由于 DO 的提高,RAN_NH4分别在阶段末增大至0.058,0.154和0.248kg N/(m3·d),系统内的NO2--N生成浓度逐渐增多,致使AnAOB活性不断增强,在阶段IX末期 RAN_NH4,RAN_NO2和 RAN_NO3分别达到 0.179,0.202和 0.025kg N/(m3·d);RNOB_NO2由 0.015kg N/(m3·d)增大至 0.029kg N/(m3·d),由于DO的增多NOB活性得到一定的增强[35].SNAD工艺启动过程中, RAN_NH4, RAN_NO2,RAN_NO3和 RAOB_NH4分别稳定在 0.358,0.403,0.049和 0.392kg N/(m3·d),表明AnAOB和AerAOB活性得到稳定;由于有机物的摄入DNB活性得到增强,RDNB_NO2和RDNB_NO3分别增大至 0.0035 和 0.039kg N/(m3·d).综上所示, SNAD工艺启动中AnAOB、AerAOB和DNB均具有较强的活性,互不干扰活性实现协同脱氮机理.

图5 SNAD工艺启动过程不同阶段功能菌的转化速率Fig.5 Transformation rates of functional bacteria of the SNAD process during different operational phases
2.3 SNAD工艺的优化
2.3.1 不同 C/N 比条件下工艺性能的变化 研究表明提升 C/N比,会对系统内不同功能菌产生不同的影响,进而影响SNAD工艺的性能[10].通过模型模拟了C/N比对SNAD工艺性能的影响如表9所示.当 C/N 比为 0.5时,CLR 为 0.40kg/(m3·d),经过 30d模拟运行后,NRE、ARE和CRE分别达到87.72%、95.00%和 93.42%;C/N比由 0.5开始每次累加 0.5,进行一次模拟,CLR分别增至0.80,1.20,1.60,2.00和2.40kg/(m3·d),脱氮性能 NRE由 90.03%逐步增长至93.64%,同时除碳性能CRE逐步增长并稳定在98%左右.表明C/N比由0.5增至3.0时,SNAD工艺的脱氮除碳性能得到强化.
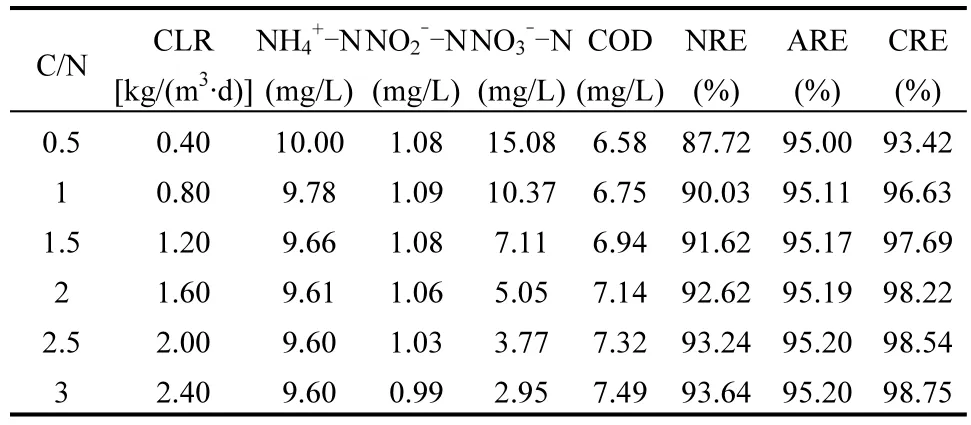
表9 不同C/N比条件下SNAD工艺的性能Table 9 The performance of the SNAD process during different C/N ratios
通过实验的方式检验模拟趋势,结合 SNAD工艺C/N比为0.5的启动实验,分别改变C/N比为1.5和 3.0运行实验,检验模拟的趋势,其脱氮除碳性能如图6所示.阶段XIII中进水CLR达到1.25kg/(m3·d)左右,经过10d左右的运行NRE、ARE和CRE分别达到 91.63%、95.42%和 97.77%;阶段 XIV 中,进水CLR 提 高 至 2.61kg/(m3·d)左 右,NRE 升 高 至92.87%,ARE维持在94%左右,SNAD工艺脱氮性能不断提高.随C/N比的提高,SNAD工艺的脱氮除碳的性能逐步提高,与 SNAD工艺模型模拟出来的趋势相同[14].

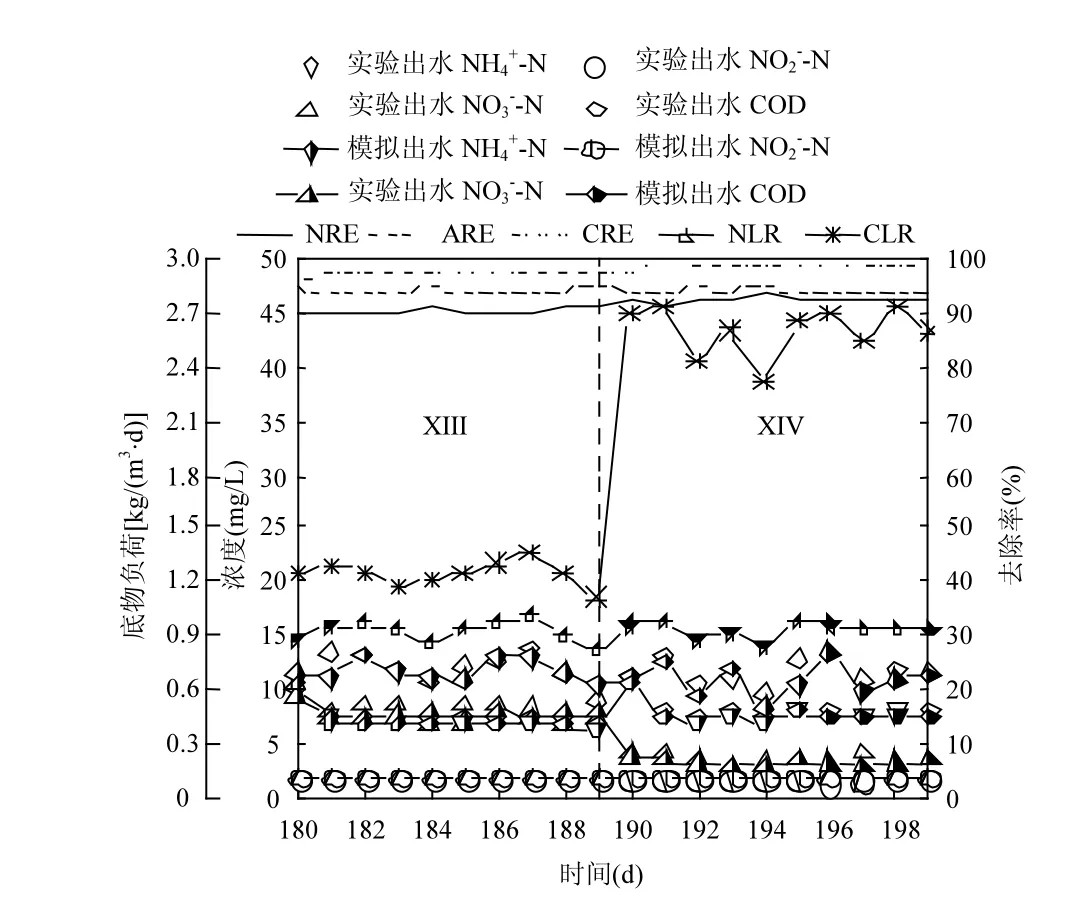
图6 C/N比为1.5和3.0时SNAD工艺模拟和实验性能Fig.6 The simulation and experimental results of the SNAD process at the C/N ratio of 1.5 and 3.0, respectively
2.3.2 不同 C/N比条件下功能菌浓度的变化 C/N比的改变,会对SNAD工艺内功能菌生长产生影响,具体变化如图 7(a)所示.SNAD 工艺中,随 C/N比的提高,系统内功能菌总体浓度不断升高,由C/N比0.5时的8866.95mg/L增长至C/N比为3.0时的9156.03mg/L;随C/N比的升高,由于氮负荷和溶解氧环境不变,AerAOB浓度趋于平稳达1040mg/L左右;而系统内DNB浓度呈现阶梯式上升,C/N比为0.5,1.0,1.5,2.0,2.5和3.0条件下分别达到87.42, 178.2,267.9,357.2,446.4和535.5mg/L;然而,随C/N比的升高AnAOB的浓度由7710mg/L逐渐降至 7582mg/L,这是由于有机物的增加,促进DNB的快速增殖发展,在DNB降解NO3--N的同时,利用富余的COD与AnAOB竞争AerAOB生成的NO2--N,导致 AnAOB 的底物缺失,致使AnAOB浓度随C/N比的增大而降低[36].但是DNB的快速增长,同时AnAOB浓度基数比较大,使系统内的功能菌总浓度呈现上升趋势.

图7 不同C/N比条件下SNAD工艺的性能Fig.7 The SNAD process performance at different C/N ratios
2.3.3 不同 C/N比条件下功能菌活性的变化 随进水C/N比的增大,功能菌活性如图7(b)所示. RAN_NH4, RAN_NO2和 RAN_NO3分别由C/N比0.5 时的 0.36,0.41 和 0.05kg N/(m3·d)逐步降低至C/N比为3.0时的0.34,0.38和0.046kg N/(m3·d),AnAOB活性受到抑制; RAOB_NH4在C/N比为 0.5~3.0 条件下维持在 0.38kg N/(m3·d)左右,表明有机碳源的增大对于AerAOB活性没有明显的影响;然而, RDNB_NO2和 RDNB_NO3分别由 C/N比 0.5时的 0.0035和 0.0039kg N/(m3·d)逐步增大至 C/N比为 3.0时的 0.0215和 0.0238kg N/(m3·d),这表明 DNB活性随 C/N比的增加而增强[2]. AnAOB活性受到抑制是由于随着有机碳源的增加,提高了 DNB活性,其可利用富余的COD,与AnAOB竞争底物NO2--N,致使AnAOB的活性降低[36].
2.3.4 不同 C/N比条件下脱氮贡献率的变化SNAD工艺内种群协作关系复杂,不同C/N比条件下可能会影响到脱氮贡献率的改变,具体如图7(c)所示.随着C/N比的提高,脱氮性能不断增加,但 Eanammox分别降至 93.18%,86.26%,79.52%,72.84%,66.17%和 59.48%;而 DNB 涉 及 的Edenitrification由C/N比为0.5时的6.82%逐步提高至C/N比为3.0时的40.52%.可见,厌氧氨氧化途径的主导地位不断削弱,虽然C/N比为3.0时,模型预测厌氧氨氧化反应仍占主导,但该途径被削弱程度进一步增强.这是由于随着C/N比的增加,促使异养反硝化途径更加充分[11],由于底物(NO2--N)竞争,DNB对AnAOB形成竞争性抑制,削弱了 AnAOB浓度和活性,造成生物脱氮主反应呈现由厌氧氨氧化向异养反硝化反应转化的趋势.
3 结论
3.1 UMSB-MBR反应器在经历厌氧氨氧化工艺和CANON工艺后,通过引入有机碳源(C/N比0.5),成功启动SNAD工艺,NRE和ARE分别达到87.66%和94%.
3.2 基于 ASM1模型,利用启动基础数据,建立了SNAD 工艺启动模型;通过模型分析可知,氮负荷的增大,促进了 AnAOB 生长;而 DO 控制在 0.2~0.4mg/L,可以有效抑制NOB生长并促进AerAOB生长;当C/N比为0.5,AnAOB、AerAOB和DNB协同生长,实现SNAD工艺快速启动.
3.3 通过模型预测发现,随C/N比的增大,SNAD工艺性能不断增加,但DNB对AnAOB活性的抑制不断增强,从而削弱 AnAOB浓度,造成脱氮主要途径由厌氧氨氧化向异养反硝化反应的转化.综合功能菌的生长、活性和脱氮贡献率,考虑C/N比为1.5时最佳,工艺性能 NRE和 ARE分别可达 91.62%和95.17%.
