水系镁离子电池正极材料钠锰氧化物的制备及电化学性能*
2021-09-03张永泉姚安权杨柳朱凯曹殿学
张永泉 姚安权 杨柳 朱凯 曹殿学
1) (哈尔滨工程大学材料科学与化学工程学院, 超轻材料与表面技术教育部重点实验室, 哈尔滨 150001, 中国)
2) (哈尔滨工程大学智能科学与工程学院, 哈尔滨 150001, 中国)
3) (哈尔滨理工大学电气与电子工程学院, 工程电介质及其应用教育部重点实验室, 哈尔滨 150080, 中国)
4) (卡尔斯鲁厄理工学院, 应用材料研究所, 艾根施泰因-利奥伯德港 76344, 德国)
近年来镁离子电池正极材料的研发成为研究热点, 提高电池的高倍率性能和循环稳定性成为主要研究目标.本文采用水热法制备了纳米线和纳米片共混结构的钠锰氧化物(Na0.55Mn2O4·1.5H2O)纳米材料, 并用X-射线衍射和扫描电子显微镜进行表征, 通过充放电测试仪和电化学工作站进行变倍率充放电循环和变扫速循环伏安测试.结果表明水热反应时间对材料的相结构和形貌组成影响显著, 其中水热反应72 h样品(NMO-72)中纳米片和纳米线形成紧密共混, 纳米片有效填充到纳米线交叉空隙中, 提高了材料的振实密度.并且NMO-72材料具有更高的放电比容量和倍率循环性能.在50 mA·g-1电流密度下, NMO-72的放电比容量达到229.1 mAh·g-1; 在1000 mA·g-1电流密度下, NMO-72材料的放电比容量稳定在81 mAh·g-1; 而电流密度再次回到50 mA·g-1时, 其放电比容量稳定保持在164.7 mAh·g-1.同时, 循环伏安测试表明NMO-72材料与其他材料相比, 具有最佳的镁离子扩散动力学性能, 由此NMO-72材料具有更为优异的可逆比容量、高倍率性能和循环稳定性.
1 引 言
离子二次电池作为一类绿色环保、能量密度高、循环寿命长的储能方式, 已经广泛应用于便携电子设备、新能源汽车、智能电网等领域.随着各地积极响应国家节能减排号召, 研制更高能量密度、更长的循环寿命、更高安全性的离子电池电极材料变得尤为重要.其中由于镁离子带有2个电荷, 相比于锂离子电池, 其具有更高的能量密度;镁的沉积不会产生枝晶, 具有高安全性; 并且镁元素储量丰富, 价格低廉, 使得镁二次电池被认为是极具潜力的新型二次电池[1-5].但是镁离子电池的实际应用还存在阻碍, 由于镁离子的电负性较大,导致镁离子比锂离子更难在正极材料中嵌入及传输, 影响其电化学性能[6,7].因此, 研发一种制备方法简单、成本低廉且电化学性能优异的镁离子电池正极材料是十分必要的.
另外, 与锂离子扩散动力学性能相比, 电极材料中镁离子扩散动力学性能相对较差[8].因此, 需要改善电极材料中镁离子的扩散性能, 以实现高性能的镁离子电池.影响电极材料中镁离子扩散性能的因素主要包括界面扩散和体扩散.界面扩散主要受电解液的选择影响, 在电极材料和有机电解液之间的界面处, 由于强的静电相互作用, 镁离子必须克服从溶剂化物质中解离的困难.相反, 在水系电解液中, 借助强偶极水分子可以获得快速的镁离子扩散性能[9].因此, 使用水系电解液可以解决界面扩散问题.此外, 与有机电解液相比, 使用水系电解液可进一步降低电池生产成本, 提高电池安全系数并优化镁离子存储容量和充放电倍率性能[10-12].然而, 镁离子在电极材料中的体扩散是实际应用中的关键, 探索具有良好的镁离子扩散能力的正极材料仍然是一个挑战.目前镁离子电池正极材料的研究主要包括: 金属氧化物、金属硫化物、硒化物、聚阴离子化合物等[13-17].特别地, 层状结构的氧化物具有更开放的离子传导通道, 能够使得镁离子更容易插入/脱出和传输[18,19].其中层状钠锰氧化物在锂离子电池、钠离子电池和超级电容器中的研究较为广泛[20-26].Wang等[21]采用溶胶-凝胶法制备了层状Na-Mn-O材料, 并作为锂离子电池正极材料进行测试, 放电比容量达到176 mAh·g-1.Peng等[27]将蛋黄-蛋壳结构的Na0.55Mn2O4·1.5H2O@C复合材料作为锂离子电池负极材料, 获得了优异的倍率性能和循环稳定性, 在4 A·g-1电流密度下循环3000次后比容量依然达到448 mAh·g-1.Zheng等[24]将层状复合材料Na0.44MnO2·Na2Mn3O7作为钠离子电池正极材料进行研究, 在200 mA·g-1电流密度下循环100次后容量保持率为88%, 在1000 mA·g-1电流密度下比容量达到72 mAh·g-1.Chua等[28]将Na0.55Mn2O4·1.5H2O作为水系钠离子电池正极材料进行了研究, 在100 mA·g-1的电流密度下获得了77.2 mAh·g-1的比容量.Zhang等[26]研究了Na0.55Mn2O4·1.5H2O材料在不同电解液中的电容性, 在中性水系电解液中, 低电压区域表现出表面控制型赝电容行为, 高电压区域表现为插入型赝电容行为, 在碱性水系电解液中则表现为电池的行为.目前Na0.55Mn2O4·1.5H2O材料在镁离子电池中的研究还未见报道, 但是层状结构的Na0.55Mn2O4·1.5H2O材料具有可供镁离子插入/脱出的离子通道, 是潜在的镁离子电池正极材料.
本文采用水热法制备了纳米片和纳米线共混的钠锰氧化物(Na0.55Mn2O4·1.5H2O)纳米电极材料, 表征了其结构和形貌, 探究了其作为水系镁离子电池正极材料的电化学性能.
2 实验部分
2.1 试剂与仪器
三氧化二锰(Mn2O3), 100 nm, 北京伊诺凯科技有限公司; 氢氧化钠(NaOH), 天津市天大化学试剂厂; 导电炭黑(Super P), 深圳科晶智达科技有限公司; 聚偏氟乙烯(PVDF, 5130), Solvay公司; N-甲基吡咯烷酮(NMP), Sigma-Aldrich公司;氯化镁(MgCl2), 天津市天大化学试剂厂.
样品的晶体结构采用Mo靶的X-射线衍射仪(XRD, APEX II, 德国Bruker公司)进行测试; 样品的形貌由扫描电子显微镜(SEM, SU8020, 日本HITACHI公司)进行表征; 样品的元素组成由X-射线能谱仪(EDS, 德国Bruker公司)进行分析;样品的充放电性能由蓝电电池测试仪(LANHE CT2001A, 武汉市蓝电电子股份有限公司)进行测试; 样品的循环伏安(CV)性能由电化学工作站(CHI660E, 上海辰华仪器有限公司)进行测试.
2.2 钠锰氧化物纳米材料的制备
采用水热法合成纳米片和纳米线共混的钠锰氧化物(Na0.55Mn2O4·1.5H2O)纳米材料, 具体步骤如下: 首先将2 g Mn2O3倒入40 mL 10 mol·L-1的NaOH溶液中, 并搅拌30 min, 超声30 min, 再搅拌30 min, 得到充分溶解的混合物溶液.然后将溶液转移到50 mL聚四氟乙烯内衬的反应釜中,在170 ℃下反应60 h.待反应釜自然冷却至室温后, 将所得产物在6000 r·min-1转速下离心5 min,再用去离子水多次离心洗涤, 直至上清液呈中性.最后加入少量去离子水搅拌至悬浊液, 利用冷冻干燥机进行冻干处理, 获得Na0.55Mn2O4·1.5H2O纳米电极材料, 标记为NMO-60.通过调控水热反应时间(72, 84 h), 其他制备过程不变, 获得产物分别标记为NMO-72和NMO-84.
2.3 电化学性能测试
将质量比8∶1∶1的活性物质、导电剂Super P和黏结剂PVDF混合, 加入适量NMP配成浆料, 均匀涂覆在碳布上, 并在120 ℃下真空干燥12 h, 随后切割成尺寸为1c m×1 cm的电极片, 每个电极片的活性物质质量约为3-5 mg, 采用0.5 mol·L-1的MgCl2水溶液为电解液, 以碳棒为对电极, 以甘汞电极为参比电极, 以活性物质为工作电极, 通过三电极体系测试充放电性能和循环伏安曲线(CV).充放电性能在蓝电电池测试仪上进行测试, 电压范围为-0.6-0.9 V, 变倍率性能测试电流密度范围为50-1000 mA·g-1; 变扫速的CV通过电化学工作站进行测试, 测试的电位扫描范围为-0.6-0.9 V, 扫描速率范围为0.1-0.5 mV·s-1.
3 结果与讨论
3.1 材料的结构与形貌表征
图1为样品NMO-60, NMO-72和NMO-84的XRD图谱.从图1可以看出, 样品NMO-60在2θ为5.6°(001), 11.4°(002), 16.4°(200)和17.0°处出现了和钠锰氧化物Na0.55Mn2O4·1.5H2O(JCPDS No.43-1456)基本符合的特征衍射峰.另外, 在2θ为7.8°(140), 8.9°(200)和15.5°(350)处出现了和钠锰氧化物Na4Mn9O18(JCPDS No.27-0750)基本符合的特征衍射峰, 但是峰强非常弱,表明NMO-60材料主体为Na0.55Mn2O4·1.5H2O,含有少量Na4Mn9O18杂相.当水热反应时间延长至72 h时, NMO-72样品衍射峰强度增强, 表明材料的结晶性提高, 衍射峰对应晶面增大, 晶粒尺寸也在长大, 晶体结构更为稳定, 有益于材料电化学性能的提高.另外, Na0.55Mn2O4·1.5H2O和Na4Mn9O18的特征衍射峰强度比相比于NMO-60无明显变化,表明NMO-72的Na4Mn9O18杂相也非常少, 材料主体为Na0.55Mn2O4·1.5H2O.但是, 当水热反应时间延长至84 h时, Na4Mn9O18的特征衍射峰强度显著增加, Na4Mn9O18的含量所占比例显著增加,即表明NMO-84样品主体相为Na0.55Mn2O4·1.5H2O和Na4Mn9O18混合.Na0.55Mn2O4·1.5H2O属于单斜晶系, 空间群为C2/m, 具有层状离子传输通道[26,29]; 而Na4Mn9O18属于正交晶系, 空间群为Pbam, 具有隧道型离子传输通道[24,30].这说明水热反应时间的调控引起了样品晶体结构上的改变.基于镁离子较高的电负性, 层状结构的电极材料更利于镁离子的传输.

图1 制备样品的XRD曲线Fig.1.XRD curves of all samples.
图2 为样品NMO-60, NMO-72和NMO-84的SEM照片.可以看出, 样品NMO-60的形貌为纳米片状结构, 并存在少量的纳米线结构, 相互交叉分布.随着水热反应时间的增长, 样品NMO-72中的纳米线明显增多, 但还是以片状结构为主, 其中纳米线的直径约为200 nm, 长度最长可达9 µm, 且聚集紧密程度有所增加.样品NMO-84则以纳米线结构为主, 纳米片尺寸变小, 依附在纳米线上, 形成空隙较大.水热反应时间的调控可将钠锰氧化物从片状结构逐渐转变为线状结构, 其中样品NMO-72中纳米片和纳米线形成紧密共混,纳米片有效填充到纳米线交叉空隙中, 提高了材料的振实密度, 有利于提高电池的体积比能量; 并且适当的纳米片和纳米线的共混有利于提高电极材料的整体比表面积和微孔数量, 这有利于电极材料与电解液的充分接触, 提高其电化学性能.为了进一步确认三种样品的元素组成, 对三种样品进行了EDS分析, 结果如图3所示.可以看出, 三种样品均含有Na, Mn, O元素, 并且可以明显观察到Na相对于Mn的含量是随着水热反应时间增加而增加的, 这与图1 XRD图谱相对应, 当水热反应时间增加, Na4Mn9O18相含量随之增加, 因此Na相对于Mn的含量亦随之增加.

图2 制备样品的SEM照片 (a) NMO-60; (b) NMO-72; (c) NMO-84.插图为局部放大的SEM照片Fig.2.(a) NMO-60, (b) NMO-72 and (c) NMO-84 SEM images of all samples.The insets are the enlarged SEM images.

图3 制备样品的EDS图片Fig.3.EDS images of all samples.
3.2 材料的电化学性能
图4 是三种电极材料在50-1000 mA·g-1电流密度下的倍率性能图, 电压窗口为-0.6-0.9 V.初始在50 mA·g-1电流密度下测试时, 三种材料NMO-60, NMO-72和NMO-84的放电比容量最高分别为188.8, 229.1和217.3 mAh·g-1.经过不同电流密度充放电测试后, 在1000 mA·g-1电流密度下, NMO-60和NMO-72材料的放电比容量分别为68.1和81 mAh·g-1, 而NMO-84材料循环非常不稳定.从图4中可知, NMO-84材料在不同电流密度下的库仑效率偏低, 尤其在大电流充放电条件下库仑效率极不稳定, 导致材料的循环稳定性急剧恶化, 这可能与NMO-84材料中的Na4Mn9O18相含量增加有关.在高倍率下隧道结构的Na4Mn9O18相限制了镁离子的插入和脱出, 导致循环性能变差.当电流密度回到50 mA·g-1时NMO-60和NMO-72材料的放电比容量分别为96.3和164.7 mAh·g-1,分别为初始放电比容量的51%和75.8%, 说明NMO-72材料具有更为优异的可逆性和循环稳定性.
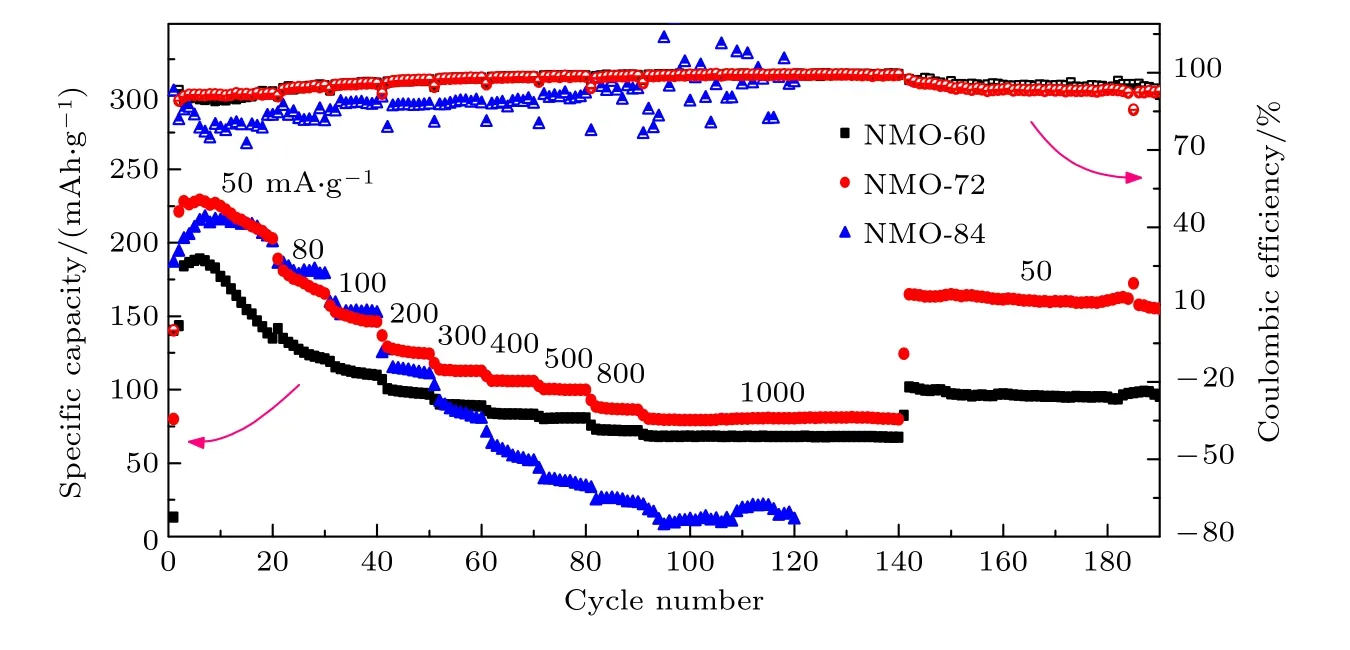
图4 制备样品在不同倍率下的充放电循环性能Fig.4.Charge-discharge cycling performance of all samples at different rates.
图5为不同倍率下的充放电曲线, 电流密度范围为50-1000 mA·g-1.从图5中可以看出, NMO-72材料具有更长的充放电平台、更高的比容量和优异的倍率性能.而NMO-84材料随着电流密度的增大, 可逆比容量衰减非常严重.通过对比50 mA·g-1电流密度下的充放电曲线可以发现, 三种材料均具有两段充电平台(0.06-0.38 V和0.38-0.75 V)和两段放电平台(0.2-0 V和0--0.23 V).通过放电平台可以发现, 在第一段平台(0.2-0 V)中三种材料的放电比容量基本相等, 而第二段平台(0--0.23 V)中NMO-72材料具有更高的比容量.换句话说, 三种材料的比容量性能差别主要体现在第二段平台范围中, 对应镁离子在材料内部的深入传输.由此说明在小电流密度下, NMO-72材料具有更为优异的镁离子扩散动力学性能.而在大电流密度下, 充放电平台不明显, 无法辨别两段平台的贡献比例, 后面通过CV测试进一步分析.
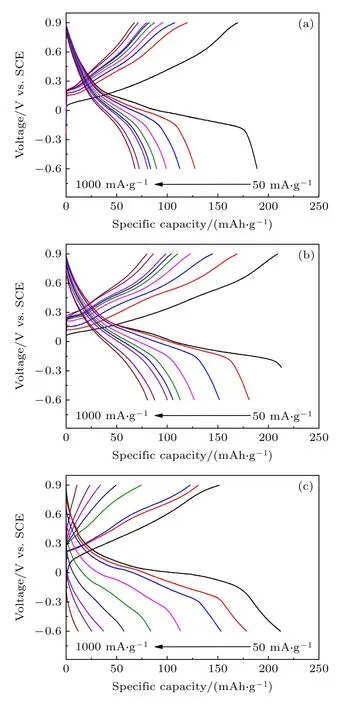
图5 不同倍率下的充放电曲线 (a) NMO-60; (b) NMO-72; (c) NMO-84Fig.5.Charge-discharge curves at different rates: (a) NMO-60; (b) NMO-72; (c) NMO-84.
图6 为NMO-60和NMO-72材料的CV曲线.如图6所示, NMO-60和NMO-72在-0.3-0.8 V电压区间内均有两对明显的氧化还原峰.在0.1 mV·s-1扫速下, 氧化峰为0.1-0.4 V和0.4-0.8 V,还原峰为0.3-0 V和0--0.3 V, 与图5中的两段充放电平台范围相对应.氧化峰对应充电平台, 表示镁离子从电极材料中脱出, Mn元素化合价升高;还原峰对应放电平台, 表示镁离子插入电极材料中, 锰元素化合价降低[9,31].对比0.1 mV·s-1扫速下的两个还原峰, NMO-60和NMO-72相比, 0.3-0 V处的峰面积基本一致, 而0--0.3 V处的还原峰面积NMO-72的更大, 这与前文关于第二段放电平台提供更高比容量相对应.表明镁离子进行缓慢传输时, NMO-72材料具有更为优异的镁离子扩散动力学性能.然而当扫描速率逐渐增大时, 相比于NMO-60, NMO-72材料在0.3-0 V处提供的容量更高, 这为NMO-72材料在大电流下提供更高的比容量提供了基础.在大电流下充放电时, 电极材料的极化电压会增大, 部分镁离子还没有进行脱出或插入, 充放电就已经结束了.因此, 充放电比容量的大小主要取决于0.1-0.4 V和0--0.3 V部分.由此, NMO-72材料具有更为优异的高倍率性能, 这与倍率性能测试结果相对应.
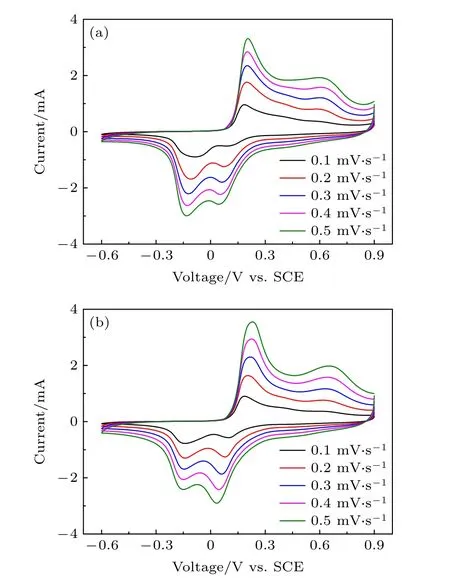
图6 不同扫描速率下的循环伏安曲线 (a) NMO-60;(b) NMO-72Fig.6.CV curves of (a) NMO-60 and (b) NMO-72 at various scan rates.
4 结 论
本文通过水热法制备了纳米线和纳米片共混结构的钠锰氧化物纳米材料.该材料由Na0.55Mn2O4·1.5H2O和Na4Mn9O18两种晶型组成, 水热反应时间越长Na4Mn9O18晶型占的比例越大, 而Na4Mn9O18含量的增多会抑制镁离子的输运, 导致材料的倍率性能变差.水热反应时间为72 h的NMO-72材料中纳米片和纳米线相互填充, 获得了更高的振实密度, 并且获得了优异的电化学性能, 在1000 mA·g-1电流密度下循环50次后, 其放电比容量仍稳定在81 mAh·g-1, 电流密度再次回到50 mA·g-1时, 其仍具有优异的循环稳定性.通过CV和充放电曲线表明, NMO-72材料具有更为优异的镁离子扩散动力学性能, 进而获得了更高的比容量和倍率性能.基于纳米线和纳米片共混结构钠锰氧化物中Na0.55Mn2O4·1.5H2O相的电化学性能更为优异,调控相结构将进一步优化和提高材料的电化学性能.离子掺杂是对材料相结构进行调控的重要手段, 我们下一步将进行此部分的研究工作, 为纳米线和纳米片共混结构钠锰氧化物正极材料在镁离子电池中的应用奠定研究基础.
感谢德国卡尔斯鲁厄理工学院Qiang Fu博士、Michael Knapp博士和Helmut Ehrenberg教授在XRD测试和分析方面的支持.
