高铁胁迫对甜菜幼苗生长及保护系统的影响
2021-09-02董寅壮范国凯於丽华王宇光
耿 贵,王 堽,董寅壮,范国凯,於丽华,王宇光
(1黑龙江大学生命科学学院,哈尔滨 150080;2黑龙江大学现代农业与生态环境,哈尔滨 150080)
0 引言
甜菜(Beta vulgarisL.),一种主要的糖料作物和经济作物,在农业经济发展中占有重要地位[1]。在中国,甜菜种植主要分布于北方地区,而南方地区少有栽培,其原因之一是甜菜更适应北方地区中性偏碱土壤环境[2]。因此,在农业种植和农业推广上土壤pH等理化性质是一个重要的受限因素[3]。酸性土低pH环境能使铁、锰、铝等大量的金属离子富集,使植物生长受到重金属离子的毒害[4]。在中国东北甜菜产区地势平坦,大量耕作土地容易受到季节性积水形成涝地,使土壤中气相被液相取代,溶解氧减少,氧化还原电位降低,碱性金属离子富集,其中微量铁元素的富集最为严重[5]。
在过去的研究中发现了酸性Al3+会严重影响苜蓿生长和根系发育,在对大豆(Glycine maxMerr)的研究中还证实了酸性Al3+会改变根际微生物群落的结构、功能与遗传多样性,从而驱动土壤肥力发生改变影响植物生长[6-7]。锰的富集导致小飞蓬(Conyza canadensisL.)中渗透调节生理指标发生显著变化,植物矮小等性状的出现[8]。Cu2+胁迫下玉米(Zea maysL.)叶片可见光-近红外光谱电子传递会随着离子浓度的增加向段波光反向跃迁[9]。关于铁元素胁迫的相关研究也显示过量的Fe2+对大豆农艺性状和叶肉细胞内膜系统产生较大的影响[10]。但目前的研究中针对高浓度的铁胁迫研究较少,相反缺铁胁迫的研究在番茄(Solanum lycopersicum)[11]、小麦 (Triticum aestivumL.)[12]、大豆[13]等诸多农作物研究中备受关注。
众所周知,铁作为植物生长所必须的微量元素,同时也是植物生长发育所需的营养物质,植物对铁营养的需求量一般在10-11~10-6mmol/L[14]。铁在植物光合作用、呼吸作用、激素合成及代谢、氮的固定、质膜的氧化还原系统及质膜的流动等生理代谢和酶促反应中发挥着极为重要的作用[15]。但是当环境所含铁的含量超过植物生理代谢所能调节的浓度时,会影响植物对其他营养物质的吸收,阻碍植物生长发育甚至导致植物死亡[15]。研究发现,铁过量会对植物造成胁迫,使植物体内积累过量的铁以及铁的化合物,这些物质会诱发生成多种活性氧自由基[16]。活性氧对质膜具有攻击性,造成过氧化从而导致膜损伤。而植物本身所具备的防御胁迫应答机制会启动体内保护系统,包括APX、CAT、SOD等酶类物质和Pro、MDA、可溶性糖等非酶类物质来防御脂质过氧化的形成并消除组织中多余的过氧化自由基,有效维持膜系统的稳定性[17]。目前,有关铁胁迫对植物生长及生理的研究多集在农作物缺铁受胁迫上,针对高浓度铁胁迫对植物生长的影响少有报道。本次实验为了探究甜菜幼苗在高浓度铁胁迫下的生理变化以甜菜幼苗作为实验材料,设计高出甜菜正常培养的Fe2+胁迫环境进行水培实验。通过测定甜菜幼苗保护系统等生理生化指标,研究高铁胁迫下甜菜植株保护系统和膜脂过氧化的变化规律,以期为甜菜在重金属逆境胁迫研究中提供进一步的理论支持和借鉴。
1 材料与方法
1.1 实验材料
以德国KWS公司培育的KWS1176品系,丸粒化的包衣甜菜(Beta vulgarisL.)种子作为实验材料。
1.2 实验设计
试验于2020年10—11月于黑龙江大学国家糖料改良中心植物培养室进行。甜菜包衣种子采用蛭石培养发芽,5天后选择长势均匀的甜菜幼苗,移栽至半倍的Hoagland营养液中。
Fe2+浓度梯度设置:0.06 mmol/L(霍格兰营养液培养的正常 Fe2+浓度)、0.12 mmol/L、0.24 mmol/L、0.48 mmol/L、0.96 mmol/L、1.92 mmol/L、3.84 mmol/L,共计7个处理,每个处理重复6次。
培养条件为:光照有效辐射(460±15)μmol/(m2·s),光照时间段6:00—20:00,昼夜温度(28±2)℃和(25±2)℃,相对湿度65%~70%。培养过程中不间断给营养液通入氧气,每天监测各处理营养液中的Fe2+浓度及pH值,使处理间营养液的其他离子浓度保持相对平衡,pH维持在5.7±2范围。5天更换一次培养液,培养至第18天收获样品。
1.3 收获样品
选取甜菜完全展开的第三、第四片真叶和完整的植株根系进行收获。收获前先用自来水冲洗,再用去离子水冲洗,最后用吸水纸把表面水吸干,用眼科剪剪去甜菜叶片主叶脉和死亡的侧根,剪碎混匀,各自称取0.5 g多份置于液氮中-80℃保存。
1.4 生理生化指标测定
收获后用分析天平测定甜菜植株鲜重(FW),105℃杀青30 min,75℃烘干至恒重后称取干重(DW),利用公式(1)计算得到叶片相对含水量(RWC)[18]。

相对电导率通过电导率仪(DDSJ-308A)测定,具体测定、计算参照参考文献19中的方法[19]。
收获的样品分别进行抗氧化酶活性和渗透调节物质的测定。过氧化氢法测定CAT、愈创木酚法测定POD、氮蓝四唑(NBT)法测定SOD、抗坏血酸(AsA)还原法法测定APX、酸性茚三酮测定Pro含量、蒽酮比色法测定可溶性糖含量。酶活性变化以蛋白含量定量,测定方法选用生工生物工程(上海)股份有限公司提供的Bradford法蛋白质定量检测试剂盒。
1.5 数据收集及分析
采用Microsoft Office Excel 2019进行数据整理;用IBM SPSS Statistics20.0专业软件对数据进行方差分析和Duncan法显著性检验(P<0.05)。
2 结果与分析
2.1 铁胁迫对甜菜幼苗叶片质膜透性和相对含水量的影响
植物细胞电解质外泄是反映植物受到环境胁迫时细胞损伤程度的重要生理指标之一,相对电导率可以有效反映细胞电解质外泄情况。实验通过测定不同浓度Fe2+培养下的甜菜幼苗叶片的相对电导率(图1-a),发现随着铁离子处理水平的加剧叶片电导率逐渐升高。较0.06 mmol/L培养条件下分别上升了67.7%、70.38%、75.28%、76.01%、79.39%并达到差异显著水平(P<0.05)。说明随Fe2+浓度的提升,甜菜幼苗叶片质膜受损程度加剧,且在3.84 mmol/L Fe2+培养条件下达到实验组的最大值,即细胞质膜受损最严重。
甜菜幼苗叶片组织的相对含水量(WRC)结果与处理浓度成反比。如图1-b所示,随着Fe2+处理水平加剧,甜菜幼苗叶片相对含水呈现降低趋势。其中0.12 mmol/L、0.48 mmol/L、3.84 mmol/L Fe2+处理下培养幼苗相对含水量较0.06 mmol/L条件下显著降低(P<0.05),分别降低12.7%、16.2%、25.4%。从而说明,随着铁离子处理浓度的增加,叶片组织含水量降低,代谢能力下降。
2.2 铁胁迫对甜菜幼苗抗氧化系统的影响
通过表1发现:高浓度Fe2+培养条件下,甜菜幼苗植株抗氧化系统(SOD、CAT、POD、APX)会产生不同程度的影响。随着Fe2+处理水平的提高,SOD活性在叶片中变化趋势是先升高后降低,但各个处理间SOD活性都高于0.06 mmol/L铁离子处理水平。其中0.96、1.96、3.84、0.24 mmol/L达到显著差异水平(P<0.05),较0.06 mmol/L铁离子处理分别升高了14.37%、10.182%、7.105%、6.533%。有趣的是,Fe2+胁迫水平低于0.96 mmol/L时,SOD的活性与处理水平成正相关;高于0.96 mmol/L时处理浓度提高,叶片中SOD活性显著降低(P<0.05)。同样在根系中,SOD含量较0.06 mmol/L Fe2+处理显著升高,随着铁浓度的提高分别升高了24.52%、34.45%、46.80%、82.66%、70.68%、57.60%。变化趋势与叶片中SOD保持一致。因此,甜菜幼苗SOD活性都呈现先上升后下降趋势,且在0.96 mmol/L铁离子处理时达到实验组的最大值。该结果表明过量的铁离子胁迫产生大量的活性氧,从而调节甜菜幼苗SOD的活性,但是当活性氧的增加远超过SOD酶的正常歧化能力时,细胞结构和功能受到破坏,生理代谢发生紊乱SOD酶的活性反而受到抑制。

表1 铁胁迫下甜菜幼苗根和叶片SOD(a、b)、CAT(c、d)、POD(e、f)、APX(g、h)的变化
与此同时,通过对甜菜幼苗叶片和根系的CAT、POD和APX活性进行测定,发现其整体与SOD活性变化趋势基本一致。即随着Fe2+浓度的增加,酶活性先升高后降低,且在Fe2+浓度为0.96 mmol/L时酶活性最高。
2.3 铁胁迫对甜菜幼苗叶片和根系渗透调节物的影响
图2-a和2-b的结果表明:随着铁离子处理水平的提高,甜菜幼苗(根系和叶片)组织积累了大量的脯氨酸。在此次实验处理的铁浓度范围内,0.96 mmol/L铁浓度培养下根系和叶片的脯氨酸含量均达到最高。甜菜幼苗Fe2+胁迫超过0.96 mmol/L时脯氨酸含量开始下降,整体上仍然高出0.06 mmol/L。其中叶片中脯氨累积量在0.48、0.96、1.96、3.84 mmol/L铁离子处理下分别高出0.06 mmol/L培养下27.37%、59.64%、54.44%、31.02%,且达到显著差异水平(P<0.05)。根系中脯氨酸累积量在0.48、0.96、1.96、3.84 mmol/L铁离子处理下分别高出0.06 mmol/L培养下19.37%、39.89%、31.34%、24.83%,且达到显著差异水平(P<0.05)。
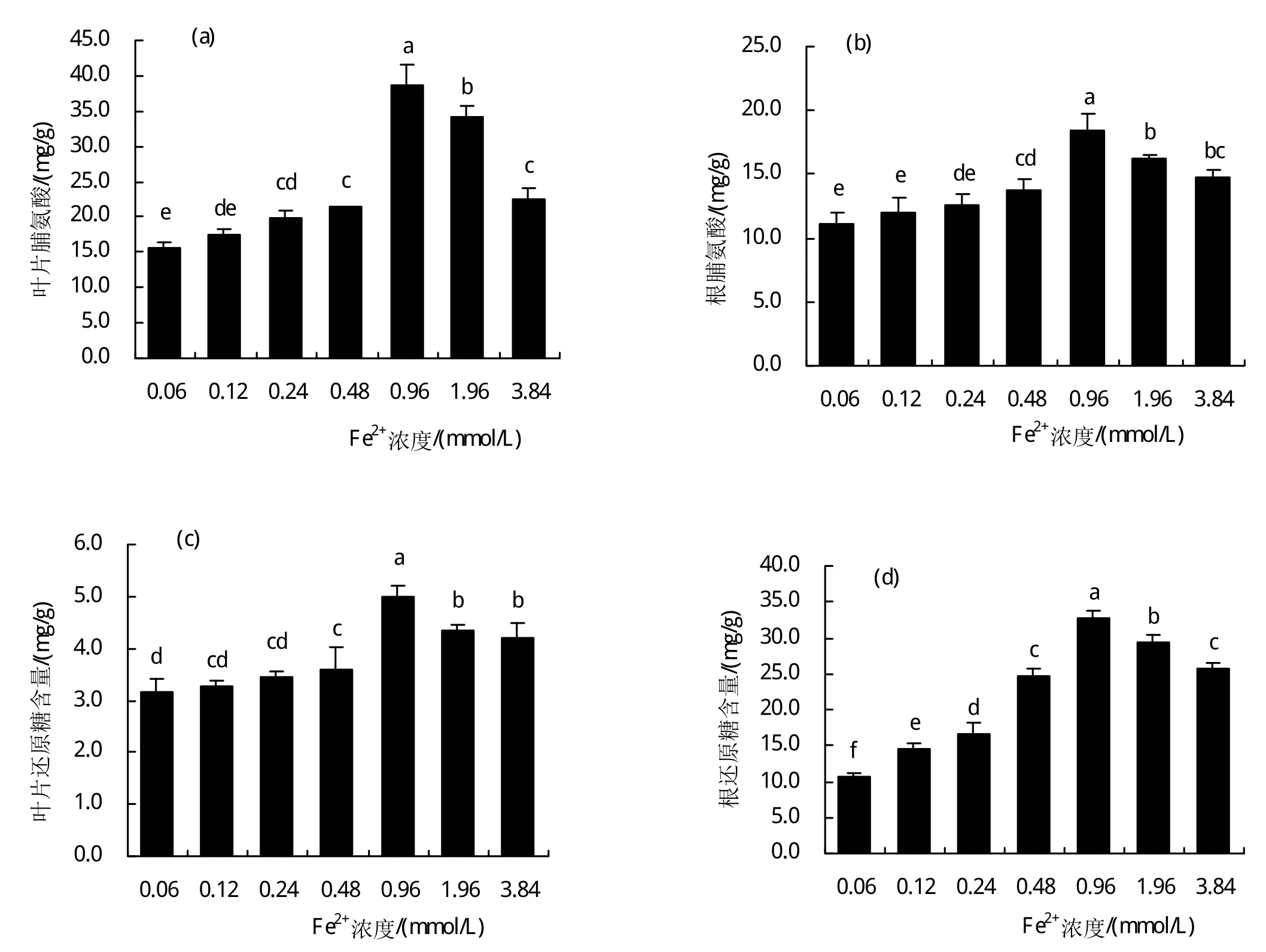
图2 过量铁胁迫下甜菜幼苗根和叶片Pro(a、b)、可溶性糖(c、d)的变化
此外通过测定植株可溶性糖发现:随着铁离子浓度的提高,甜菜幼苗(根系和叶片)组织中可溶性糖的积累量呈现先增加后降低的趋势。整体上组织中可溶性糖积累量都高于0.06 mmol/L的铁离子培养下含量,且在处理浓度范围内铁离子浓度为0.96 mmol/L培养下可溶性糖积累量达到最高。其中叶片组织中可溶性糖含量在0.48、0.96、3.84 mmol/L铁离子处理下分别高出0.06 mmol/L培养下12.70%、36.88%、24.89%,且达到显著差异水平(P<0.05)。根系中可溶性糖积量在0.12、0.24、0.96、1.96、3.84mmol/L铁离子处理下分别高出0.06mmol/L培养下27.05%、36.61%、67.74%、64.03%、59.20%,且达到显著差异水平(P<0.05)。甜菜中组织中可溶糖的这种变化量说明甜菜通过提高可溶性糖的积累量,增加了植株的渗透调节能力,从而响应过量Fe2+胁迫。
2.4 铁胁迫对甜菜农艺性状的影响
农艺性状是植物受到胁迫后最直观的表现,植物的根系作为离子吸收和养分运输的器官能最先感受外界离子的胁迫。在图3-b中,随着Fe2+胁迫浓度的提高,除0.24 mmol/L Fe2+处理以外,其余各处理均表现出生长抑制作用。其中0.48 mmol/L、0.96 mmol/L、1.92 mmol/L Fe2+胁迫下根系面积较0.06 mmol/L Fe2+处理显著下降(P<0.05),分别降低了36.8%、43.05%、89.54%,Fe2+胁迫浓度为3.84 mmol/L时根系面积为处理组中的最小值6.71 cm2。叶片的变化与根系变化一样随着Fe2+处理水平的提高,除了0.48 mmol/L处理外其余各组甜菜幼苗叶面积均有变小。其中Fe2+胁迫浓度为0.24 mmol/L和1.92 mmol/L时叶面积相对于0.06 mmol/L Fe2+处理显著下降(P<0.05),分别下降了27.25%和76.90%,处理为3.84 mmol/L时叶面积达到了处理间的最小值46.53 cm2。此外,通过数据统计发现甜菜叶片叶面积随着Fe2+胁迫水平的提高呈现变小趋势。因此Fe2+胁迫水平的增加抑制了甜菜幼苗根和叶片的生长,且Fe2+浓度越高对甜菜生长抑制作用越明显。

图3 铁胁迫下甜菜幼苗真叶面积(a)和根面积(b)变化
通过图4的根系形态发现,Fe2+浓度的提高,甜菜幼苗根系形态和根系颜色发生明显的改变。在0.06、0.12 mmol/L Fe2+处理下甜菜根系颜色为白色,生长旺盛。Fe2+浓度的提升甜菜幼苗根系开始由白色转变为暗红色。0.24 mmol/L时根系颜色开始变暗,0.96 mmol/L时变为浅红色,1.92 mmol/L时部分变红,3.84 mmol/L时完全变为红色。且根系整体形态上表现出生物量逐渐变小。除此外,甜菜幼苗在Fe2+浓度提搞后表现出叶片碎小,植株矮化,生物量降低等形态。Fe2+为0.06 mmol/L和0.12 mmol/L甜菜幼苗地上部分变化不明显,0.24 mmol/L时植株开始出现矮化,0.48 mmol/L、0.96 mmol/L、1.92 mmol/L和3.84 mmol/L处理下矮化现象明显,其中3.84 mmol/L时甜菜幼苗株高最低,生长明显受到抑制。

图4 铁胁迫下甜菜幼苗根系和植株形态的变化
3 讨论与结论
在长期因排水不良导致积水或受工业污染的酸性土壤中,Fe2+的含量可以达到一个相当的数量级,植物因此而受到Fe2+的毒害。然而,不同植物对铁毒害的症状也不尽相同[20]。研究发现过量的Fe2+胁迫会导致豌豆(Pisum sativumL.)叶片的叶尖开始出现白斑,并且白斑会随胁迫浓度的增加而向整个叶片蔓延,最终导致植株大部分叶片出现白化症状。除此外,高浓度的Fe2+使豌豆植株形态特征发生改变,如植株矮化,根系分支、变短以及生物量降低等[17,21]。在过量铁胁迫对大豆[Glycine max(Linn.)Merr.]生长及显微结构影响的实验中发现,用过量的Fe2+培养大豆会导致植株叶片缩小,生长受到抑制[10]。在本次实验中,随着铁离子浓度的增加甜菜幼苗表现出根变黄、叶片碎小、植株变矮、生长缓慢等特征,但没有出现明显的斑点。因此,出现斑点尚不能反映植物受铁离子胁迫的程度,同时也不能排除水培条件下铁含量过高影响的其他离子的吸收原因导致。
植物受到外界环境带来的非生物胁迫时,叶片相对电导率通常能反映了该条件下细胞质膜的损伤程度。研究发现植物在受到盐、碱、干旱和重金属等非生物胁迫时,叶片相对电导率升高,意味着质膜透性增加,原生质体受损严重[22-23]。本研究中,随着铁浓度的增加甜菜幼苗叶片相对电导率升高,因此高浓度Fe2+会破坏甜菜幼苗叶片细胞的完整性,导致细胞内液体外渗从而提高叶片相对电导率。
Fe2+是自由基形成的诱发剂,其能诱发生成超氧自由基,同时生成一些毒性极强的羟基自由基,与周围的活性生物大分子发生反应,不断地产生次生自由基。因此,铁离子对植物有毒害作用。此外,铁离子会与胁迫产生的过氧化物反应生成一种具有攻击性的铁自由基,主要攻击代谢酶类的反应中心以及蛋白复合体[24]。最终这些自由基共同导致膜质过氧化,从而使植物组织中细胞膜结构和功能受损,酶促反应中断,细胞代谢紊乱。有研究发现,高铁胁迫下油橄榄[Canarium album(Lour.)Raeusch.]植株中CAT、SOD、POD活性随着Fe2+浓度的增加呈现先上升后下降的趋势[15],该结果与本实验结果相符。在0.96 mmol/L处理条件下达到最高,之后随着铁离子处理浓度的升高甜菜幼苗组织中的抗氧化酶活性受到抑制。因此本次实验处理浓度范围内,0.96 mmol/L的Fe2+浓度是甜菜幼苗组织抗氧化酶类调节范围的最大浓度,也说明甜菜抗氧化酶能调节外界环境铁离子的胁迫浓度为0.96 mmol/L。因此,植物组织中所存在的抗氧化酶类在抵御逆境胁迫中具有协同调节作用,且发现抗氧化酶活性的调节能力是有一定的限度的。当外界环境施加的胁迫强度超过植物自身的调节范围时,它们对活性氧的清除能力则会被明显削弱。
植物对非生物逆境胁迫的适应调控,除了通过抗氧化物酶类来调节以外,还可以通过非酶类渗透调节物质直接参与调节[25-26]。研究证实植物在多种逆境下很容易发生渗透调节作用,如在盐胁迫下组织会合成、积累可溶性糖、可溶蛋白和脯氨酸等在渗透调节上有活性而对细胞无毒害的一类有机物来参与渗透调节,从而更好的适应高盐胁迫下的高渗透压环境。研究发现铁、锰胁迫下人参(Panax ginsengC.A.Meyer)会维持较高水平可溶性糖、脯氨酸含量以此对抗铁和锰毒害作用,这是人参适应环境、缓解铁和锰胁迫的重要机制之一[26]。本研究发现在实验组设计的处理体系中,Fe2+浓度的提高促进了甜菜幼苗组织中脯氨酸和可溶性糖含量的积累,变化趋势是先增加后降低,并在0.96 mmol/L铁离子培养下达到最大值。分析其原因可能是过量铁促使羟基自由基(-·OH)大量产生,进而诱导甜菜幼苗组织中脯氨酸和可溶性糖的大量积累。实验说明高铁胁迫促进植物组织中非酶类可溶性物质的积累,从而调节植物组织的渗透压,提高了植物组织对水分的吸收与保持。此外,实验也证明植物对任何逆境胁迫的调节都有一个适应性上限,当超过植物本身所能调节的范围时,调节能力将会下降。
本次试验,仅研究了水培条件下7个铁离子浓度梯度处理下甜菜生长和基础生理生化特性的变化,尚不能够充分解释高铁胁迫对甜菜耐生长的影响,至于其他相关因素的影响作用还有待于进一步研究。
但是可以确定的是,高铁胁迫下随着Fe2+胁迫浓度的提升,甜菜幼苗生长受到抑制:叶面积减小,相对含水量降低,质膜受损严重;根系生长能力减弱,根系颜色变暗。此外甜菜幼苗组织中抗氧化酶(SOD、CAT、POD、APX)活性随着铁离子水平的提高呈现先升高后降低的趋势。在铁离子胁迫处于较低浓度时,SOD、CAT、POD、APX活性随Fe2+浓度增加呈现升高趋势,说明甜菜植株中的保护酶系统能有效清除Fe2+胁迫产生的活性氧自由基。但随着铁离子浓度的不断提高增加到0.96 mmol/L,SOD、CAT、POD、APX活性开始下降,对组织中活性氧自由基的清除能力开始减弱。与此同时,非酶类渗透调节物质可溶性糖和脯氨酸的积累量也出现了相同的变化趋势。因此可以初步确定,甜菜植株抗氧化酶和渗透调节物质在高铁胁迫中起到了重要的调节作用,当Fe2+超过0.96 mmol/L时,这种调节机制会明显受到抑制。
