芸豆酵素复合发酵工艺优化及功能性分析
2021-09-02张艳莉佐兆杭刘淑婷李志芳
王 迪 王 颖,2,3 张艳莉 佐兆杭刘淑婷 张 裕 李志芳
(黑龙江八一农垦大学食品学院1,大庆 163319)(国家杂粮工程技术研究中心;黑龙江省农产品加工与质量安全重点实验室2,大庆 163319)(粮食副产物加工与利用教育部工程研究中心3,大庆 163319)
食用酵素是以一种或多种新鲜果蔬、药食同源食材等为原料,经多种益生菌发酵制得的富含酶、益生菌、矿物质和次生代谢产物等营养物质的功能性微生物发酵产品[1,2]。食用酵素既可最大程度保留植物原料的营养成分,又可通过有益微生物的代谢产生功能性小分子活性物质。食用酵素具有减肥降血脂[3,4]、解酒护肝[5]、美白抗氧化[6-8]、防治心血管疾病[9]等功效。以谷物作为益生菌载体的食用酵素可以解决传统发酵乳制品高脂高胆固醇等问题,同时为乳糖不耐症人群摄入益生菌提供新思路。目前研究多集中在工艺优化及功能性分析方面。洪厚胜等[10]利用酵母菌、乳酸菌、醋酸菌多菌种共同发酵葡萄果渣并优化工艺参数,经测定葡萄果渣酵素SOD活力可达988 U/mL,相较于发酵前提高了1.19倍。王辉等[11]探究青梅酵素生物活性及抑菌性,结果表明其抗氧化性及酶活性较强,对致病菌有明显抑制作用。
芸豆(Phaseolus vulgaris Linn)学名菜豆,又名四季豆,广泛种植于内蒙古、云南、黑龙江、辽宁等11个省、自治区,已成为栽培面积仅次于黄豆的食用豆类农作物[12]。芸豆富含蛋白质、B族维生素、矿物质等营养成分,同时含有多种人体必需氨基酸,其中赖氨酸和色氨酸含量相对较高[13,14]。芸豆中α-淀粉酶抑制剂可有效改善链脲佐菌素诱导的糖尿病小鼠高脂血症、胰岛素抵抗并提高其机体免疫力,降低机体氧化应激及高血糖灵敏度,并以低毒性有效防止血管组织的病变[15-17];芸豆多肽,如凝集素、蛋白酶抑制剂、淀粉酶抑制剂、抗真菌蛋白等,可用于抵御如真菌和细菌等病原微生物及食肉昆虫对植物的侵害[18];芸豆抗性淀粉具有防预治疗胃损伤、糖尿病、肠癌等功效[19,20]。芸豆富含的多种生物活性物质在疾病防治方面具有巨大潜力,还可被作为天然的抗氧化剂、色素、甜味剂应用于食品、化妆品、药品等相关行业,以安全性高、来源广泛、见效迅速的优点,在人类生活中扮演重要角色[21,22]。
芸豆主要以鲜食为主,存在综合利用程度低及高值转化差等问题,目前鲜见复合益生菌发酵芸豆酵素的研究,其工艺优化及功能性也鲜有报道。因此,本研究以黑龙江省地区主产紫花芸豆为研究对象,采用响应面法优化芸豆酵素发酵工艺参数,探究其抗氧化活性及体外抑菌性,以期提高芸豆附加值,同时为芸豆酵素系列产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
紫花芸豆;白砂糖;活性干酵母;植物乳杆菌(Lactobacillusplantarum);嗜酸乳杆菌(Lactobacillusacidophilus);金黄色葡萄球菌(Staphylococcusaureus);志贺氏菌(Shigella);大肠杆菌(Escherichiacoli);沙门氏菌(Salmonella);耐高温α-淀粉酶(20 000 U/mL);糖化酶(10 000 U/mL);1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH);超氧化物歧化酶(SOD)测试盒;羟自由基试剂盒;福林酚(10%)。
1.2 仪器与设备
JYL-Y912料理机,S220 pH计,H1850R冷冻离心机,BCV-6S1超净工作台,DRP-9082电热恒温培养箱,V-5100B可见分光光度计,YXQ-30SII立式压力蒸汽灭菌器。
1.3 实验方法
1.3.1 工艺流程
芸豆去皮清洗→打浆均质→液化→糖化→离心→灭菌→接种→发酵→后发酵
↑
酵母菌、乳酸菌
1.3.2 操作要点
菌种的活化与培养:取甘油保存的菌液100 μL于MRS液体培养基中,37 ℃恒温培养24 h,无菌操作台中划线接入MRS固体培养基中培养(37 ℃,24 h),连续接种3代,使其充分活化。挑取斜面培养基生长较好菌落接种至液体培养基中培养(37 ℃,24 h),摇匀后移取1%菌液至液体培养基(37 ℃,24 h),得到扩大培养的乳酸菌菌悬液,待用。活性干酵母于10倍体积蒸馏水中溶解,30~35 ℃恒温水浴锅中活化30 min,菌液待用。
芸豆清汁的发酵:紫花芸豆清洗后去皮,按1∶3(g/mL)料水比打浆。双酶法进行水解,液化条件:α-淀粉酶添加量200 μL/100 mL、pH 6.0、酶解温度97 ℃、时间20 min;糖化条件:加酶量200μL/100 mL、pH 4.5、温度60 ℃、时间30 min。酶解液于高速离心机中以1.0×104r/min离心15 min,得到芸豆清汁。调清汁pH 5.0、装瓶量30 mL、糖添加量8%后灭菌。冷却后接种0.2%酵母菌,32 ℃恒温振荡24 h进行预发酵,按1∶1(共同发酵)比例接种植物乳杆菌和嗜酸乳杆菌恒温发酵24 h。-4 ℃后发酵并保藏备用。
1.3.3 单因素实验设计
芸豆清汁初始pH 5.0,添加8%白砂糖后灭菌,接种3%复配乳酸菌,32 ℃发酵24 h,测定芸豆酵素SOD活力。固定其他条件,分别考察糖添加量、初始pH、接种量、发酵温度对发酵液SOD活力的影响。
1.3.4 响应面实验设计
利用Design-Expert 8.06软件中Box-Behnken模型,以糖添加量、初始pH、接种量、发酵温度4个单因素为自变量,发酵液SOD活力为响应值,优化发酵工艺参数。实验设计因素与水平见表1。

表1 响应面实验因素与水平
1.3.5 SOD酶活力测定
使用超氧化物歧化酶(SOD)测试盒测定。
1.3.6 抗氧化实验1.3.6.1 DPPH自由基清除能力测定
取2 mL样品溶液与2 mL 0.02 mg/mL DPPH-乙醇溶液混匀,室温下暗反应30 min,空白组以无水乙醇代替试样,517 nm处测定样品吸光度值[23]。
DPPH清除率=[1-(A1-A2)/A0]×100%
式中:A1为样品溶液的吸光度;A2为用无水乙醇代替DPPH时测得对应浓度的本底吸光度;A0为空白组的吸光度。
1.3.6.2 羟自由基清除能力测定
使用羟自由基测试试剂盒测定。
1.3.7 芸豆酵素体外抑菌活性测定1.3.7.1 菌悬液的制备
无菌条件下,将金黄色葡萄球菌、志贺氏菌、大肠杆菌、沙门氏菌接种于LB固体培养基,37 ℃培养24 h,活化两次。取1环活化后菌种接种于LB液体培养基,37 ℃培养至对数生长期,菌悬液重悬稀释后进行平板计数,使菌悬液中菌数保持在1×107~2×107CFU/mL,备用。
1.3.7.2 芸豆酵素抑菌活性的测定
吸取100 μL菌悬液于LB固体培养基上,涂布器涂开。打孔器在固体培养基上打孔,分别吸取20、40、80、160、320 mg/mL的芸豆酵素0.2 mL于孔中,无菌水为空白对照。培养基37 ℃恒温培养24 h,测量抑菌圈直径。
1.4 数据处理
2 结果与分析
2.1 单因素实验结果分析
由图1可知,SOD活力随糖添加量增加而升高,超过一定范围后下降,推测发酵液渗透压增高,造成细胞壁特性发生改变,同时抑制细胞膜上氨基酸转运蛋白等物质活性,影响细胞膜流动性[24]。此外,菌种细胞收缩及胞内水流出,造成生长周期停滞和凋亡等多种生物过程的破坏[25],致使发酵无法正常进行。

图1 单因素实验结果
SOD活力随着初始pH的增大呈先上升后下降的趋势,推测SOD化学本质为蛋白质,其分子内部规律性结构易受pH、温度等物理或化学因素影响,导致氢键断裂进而空间结构被破坏,酶活性降低。
增大接种量,SOD活力未增加却大幅度降低,推测接种量过低,易污染杂菌形成不利于菌种增殖生长的环境[26];接种量过高,菌体发酵速度过快,易造成微生物细胞衰老而自溶,影响风味。
随着发酵温度的升高,SOD活力逐渐增大,而温度过高时SOD活力呈降低趋势,分析原因温度升高加快微生物繁殖代谢。但过高缩短发酵周期,同时改变气体传递速率及溶解度,降低发酵液溶氧量,影响微生物正常生长代谢。
2.2 响应面实验结果分析
2.1.1 响应面结果及分析
响应面设计各因素水平的芸豆酵素SOD活力见表2。对表2实验结果进行回归拟合,所得回归方程为:Y=215.63+1.58A-2.18B+5.24C+2.97D-1.94AB-1.80AC-4.28AD+6.16BC-5.05BD-1.92CD-23.79A2-18.30B2-19.65C2-11.23D2。
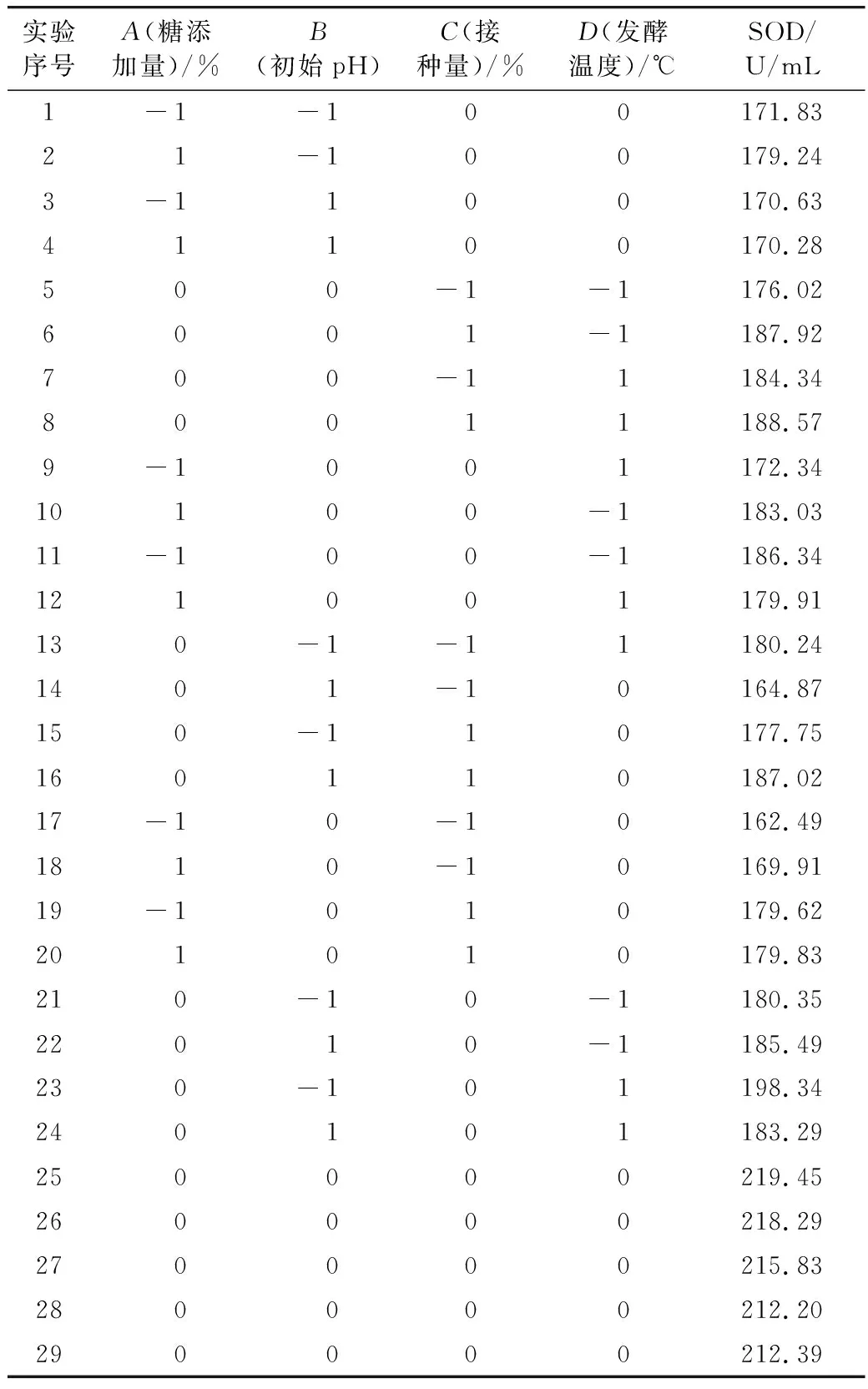
表2 响应面实验设计与结果
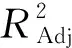
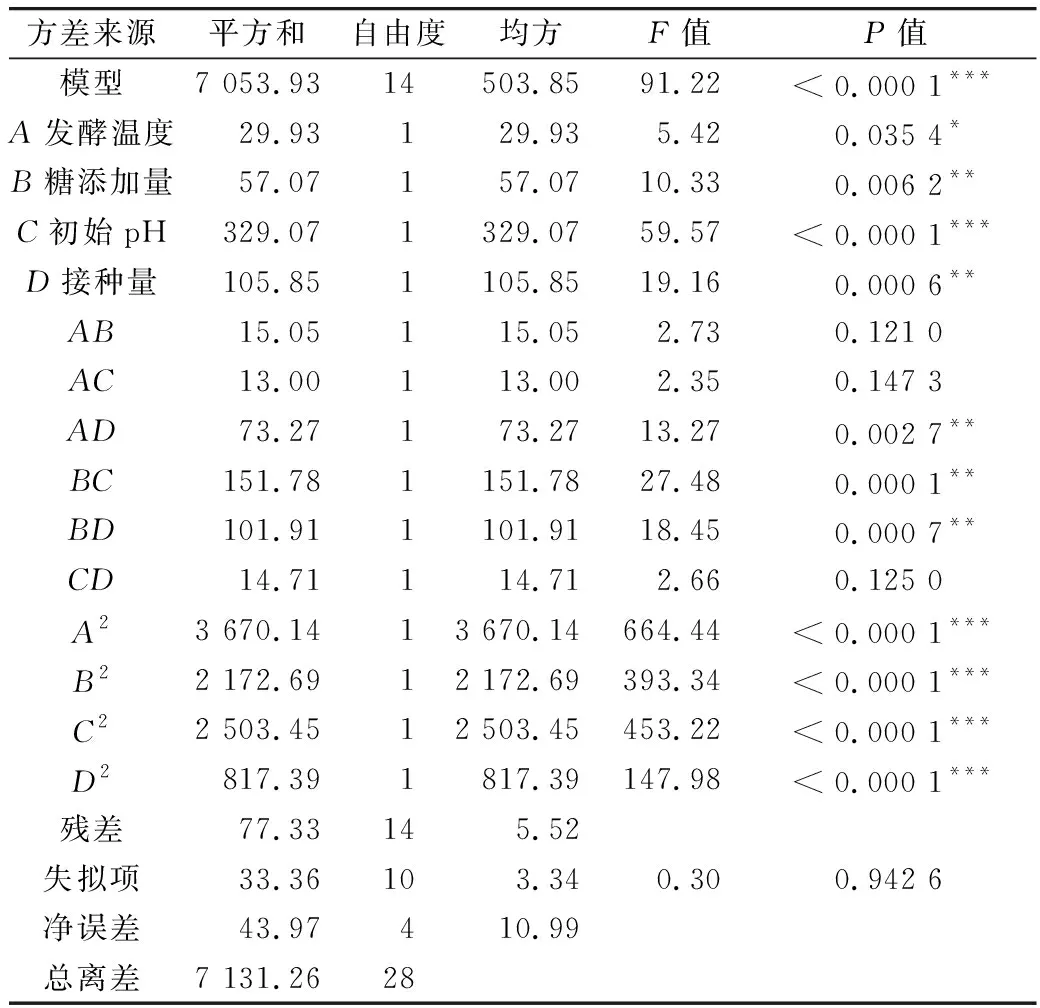
表3 回归方程方差分析及结果
方程一次项中C项对芸豆酵素SOD酶活力的影响达到极度显著水平(P<0.000 1),B项和D项达到高度显著水平(P<0.01),A项达到显著水平(P<0.05),即各因素对芸豆酵素SOD活力影响顺序依次为初始pH>接种量>糖添加量>发酵温度。
2.1.2 交互作用分析
各因素交互作用等高线图呈椭圆形,说明交互作用显著。响应面对比可知,初始pH、糖添加量和接种量曲面弯曲程度较大,表明对发酵液SOD活力影响显著,与回归方程的方差分析结果一致。经Design Expert 8.06优化芸豆酵素发酵工艺参数:糖添加量6.08%,初始pH 3.94,接种量3.23%,发酵温度为32.53 ℃,此条件下发酵液SOD活力预测值可达216.213 U/mL。为验证实验结果真实性,考虑到实践操作可行性,优化工艺参数为发酵温度32 ℃、糖添加量6%、初始pH 4.0、接种量3%,重复3次实验进行验证,得到芸豆酵素SOD活力为215.12U/mL(误差0.51%),证明优化的工艺参数具有准确性。
2.2 不同发酵阶段芸豆酵素抗氧化活性分析
2.2.1 不同发酵阶段芸豆酵素DPPH自由基清除率变化
芸豆酵素发酵过程中DPPH自由基清除率的变化如图2所示。整个发酵过程中芸豆酵素均对DPPH自由基具有一定的清除能力,呈现先迅速上升后趋于平缓的趋势。与发酵0 h相比,发酵8 h的芸豆酵素DPPH自由基清除率迅速增长2倍,随后以小幅度趋势增长,说明适当延长发酵时间可明显提高芸豆酵素DPPH自由基清除能力。发酵过程中DPPH自由基清除率显著上升,至发酵结束达90.57%,分析原因可能与酚类物质有关,其较容易给出一个氢离子并通过共振杂化而稳定[27],同时发酵过程中产生如超氧化物歧化酶(SOD)等抗氧化酶,两者共同作用是高DPPH自由基清除率的原因。
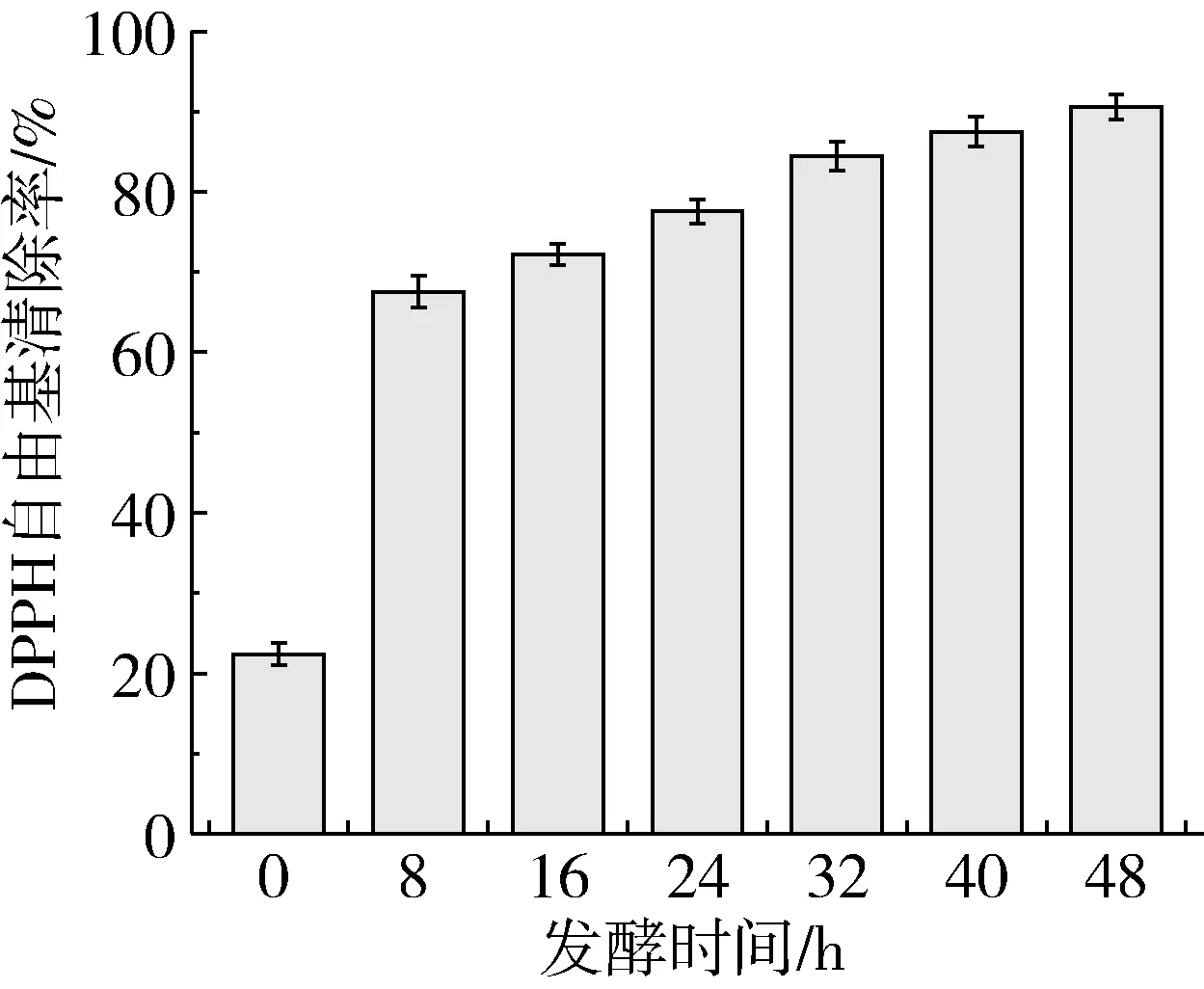
图2 芸豆酵素发酵过程中DPPH自由基清除率的变化
2.2.2 不同发酵阶段芸豆酵素羟基自由基清除率变化
芸豆酵素发酵过程中羟基自由基清除率的变化情况如图3所示。羟基自由基的清除能力随发酵时间的延长呈现持续增长的趋势,最终增长至88.06%。羟基自由基清除能力的提高可能是由于有机酸、维生素具有自由羟基的酚类物质,A环或B环上有自由的3-羟基取代或有多羟基取代的黄酮化合物,多酚类物质分子内含大量的酚羟基,提供活泼的氢,可终止自由基连锁反应[28]。多种因素共同作用提高发酵液自由基清除能力。
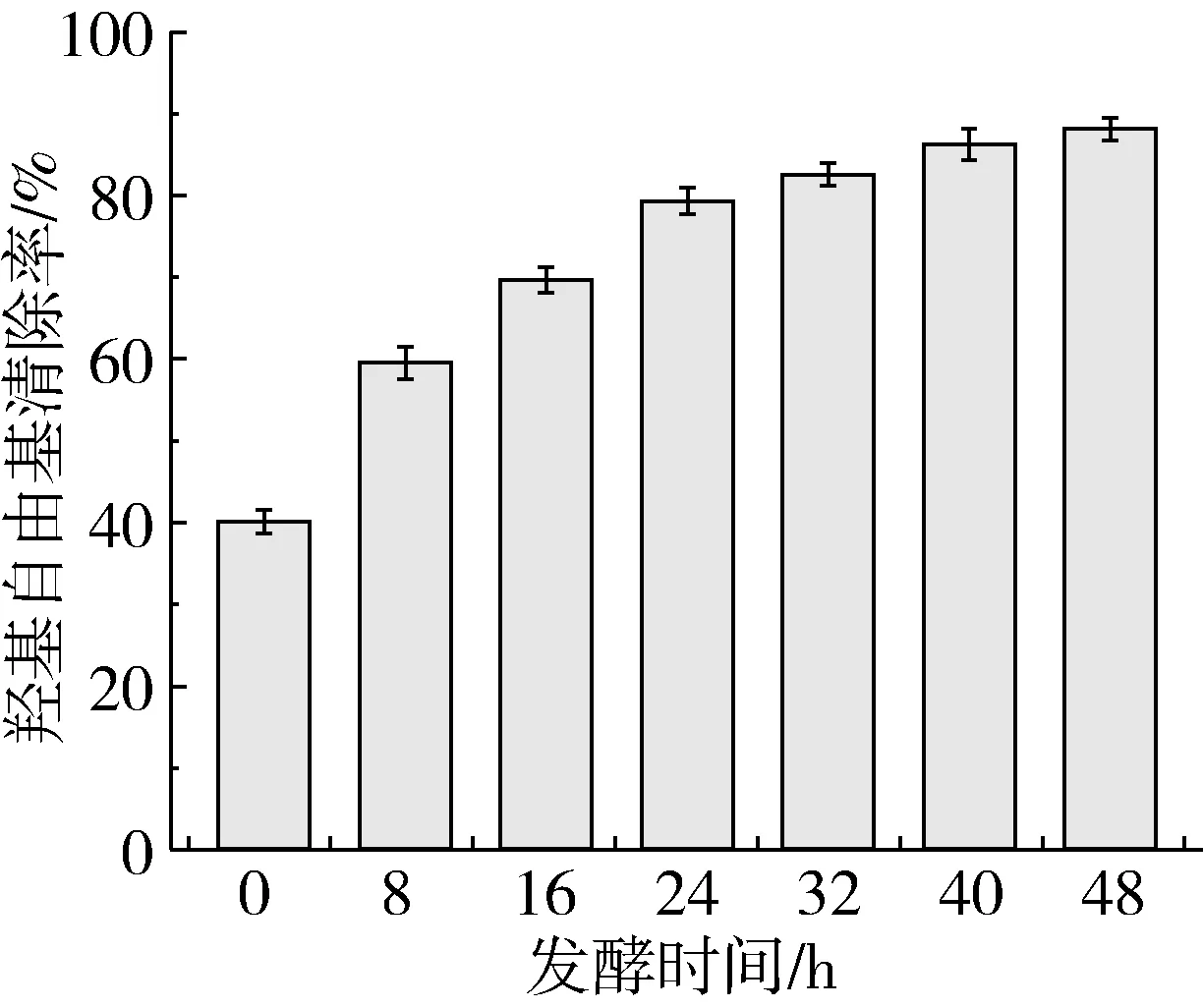
图3 芸豆酵素发酵过程中羟基自由基清除率的变化
2.3 芸豆酵素抑菌活性分析
由图4和表4可知,芸豆酵素对4种致病菌均有抑制作用,随着浓度升高抑菌圈直径显著增大(P<0.05)。当芸豆酵素浓度为320 mg/mL时,均处于15~20 mm的高敏范围。其中,相较于革兰氏阴性菌(沙门氏菌、志贺氏菌、大肠杆菌),芸豆酵素对革兰氏阳性菌(金黄色葡萄球菌)的抑制效果更强,与相关文献报道的研究结果相一致[29]。原因在于供试菌种细胞壁组成不同,革兰氏阳性菌细胞壁大部分由位于表面的肽聚糖构成,溶菌酶等抑菌成分可直接作用其表面进而抑制肽聚糖的合成并溶解细菌。而阴性菌细胞壁主要成分为脂多糖和脂蛋白,可一定程度防止其细胞结构被外界破坏[29]。

图4 芸豆酵素产生的抑菌圈效果图

表4 不同浓度芸豆酵素的抑菌活性
3 结论
芸豆酵素发酵最优工艺条件为发酵温度32 ℃、糖添加量6%、初始pH4.0、接种量3%,此条件下发酵液SOD活力为215.12 U/mL。发酵使芸豆酵素DPPH自由基清除率及羟自由基清除率显著增长,至发酵结束其清除率分别为90.57%和88.06%,证明经工艺优化后的芸豆酵素具有良好的抗氧化活性。采用扩散法考察不同浓度芸豆酵素对致病菌抑菌效果,结果表明芸豆酵素抑菌活性随浓度升高而增强,且对革兰氏阳性菌抑制效果更强。经此工艺优化后的芸豆酵素色泽通透,气味绵柔,具有良好的功能活性。
