响应面法优化铁皮石斛多糖纯化工艺
2021-09-02张小辉卫梦尧杨永志黄耀豪苏官杰刘冠希吴子峰丁金龙
张小辉,卫梦尧,杨永志,黄耀豪,苏官杰,刘冠希,李 飞,吴子峰,丁金龙
(广东工业大学生物医药学院,广东广州 510006)
铁皮石斛(Dendrobium officinale)作为一种传统名贵的中药材,是一种具有高药用价值的食用植物,其主要活性成分有多糖[1−3]、生物碱[4]、类黄酮[5]、多酚[6]、微量元素[7]和氨基酸等[8],其中多糖含量最高,2020版《中国药典》记载铁皮石斛中多糖含量不低于25%[9]。铁皮石斛多糖具有降血糖、护肝、抑菌[10−11]、抗肿瘤、抗骨质疏松、保护肠胃、抗氧化[12−14]和增强免疫力等功效。
目前铁皮石斛粗多糖主要以水提法提取,一般会含有蛋白质和色素等杂质。目前关于石斛多糖脱蛋白的方法较多是蛋白质变性法[15−16]与酶解法,但这些方法存在操作复杂、重复次数多、脱蛋白率不高[17−18]、多糖损失率大[19−21]等缺点。双水相萃取相对于传统的有机-无机溶剂萃取是一种新的萃取方法,迄今为止,已用于多种材料的提取和纯化,包括多糖[22−25]、蛋白质[26]、酶[27]、多肽[28]、氨基酸[29]等。其具有分相时间短、条件温和、选择性强、易放大、处理简单、不易影响萃取物的生物活性[30−32]等优点。
目前关于石斛多糖的双水相萃取纯化研究尚未见报道。本文拟采用乙醇-硫酸铵双水相体系纯化铁皮石斛粗多糖,在单因素实验基础上,使用响应面法优化萃取条件,以期为铁皮石斛多糖的纯化及其实际生产应用提供实验依据。
1 材料与方法
1.1 材料与仪器
干燥铁皮石斛茎 购于京东店铺敏昂养养健康专营店;硫酸铵、无水葡萄糖 分析纯,天津致远试剂厂;无水乙醇、苯酚、硫酸 分析纯,广州化学试剂厂;考马斯亮蓝G250国药集团化学试剂有限公司;磷酸 分析纯,天津大茂化学试剂厂。
SIL102数显恒温电热套 日本岛津仪器有限公司;RE-5299旋转蒸发仪 日本岛津仪器有限公司;DGU-20A高速台式离心机 日本岛津仪器有限公司;L6S型紫外分光光度计 上海仪电分析仪器有限公司;XH-C旋涡混匀器 常州越新仪器制造有限公司。
1.2 实验方法
1.2.1 双水相相图的绘制 称取20 g硫酸铵固体于锥形瓶中,加入30 g蒸馏水得到澄清溶液,不断搅拌并滴入无水乙醇至溶液浑浊,记录加入的乙醇质量mi,此时液体总质量为Mi,之后再加入一定量的蒸馏水至澄清,记录加入水的质量mj,体系总质量为Mj。继续滴入无水乙醇至溶液浑浊,之后加入水至溶液澄清,重复操作,计算每个浊点的乙醇浓度与硫酸铵浓度,绘制乙醇-硫酸铵双水相体系相图。
1.2.2 铁皮石斛粗多糖的制备 粗多糖的制备方法根据罗秋莲[16]的方法进行改进:取干燥铁皮石斛茎进行打粉,过100目筛,以1:25(g/mL)料液比加入去离子水,90℃浸提2次后过滤,8000 r/min离心10 min,取上清液,减压浓缩,加入浓缩液4倍体积的95%乙醇,4℃冰箱保存过夜后8000 r/min离心10 min,将沉淀进行冷冻干燥,得到粗多糖。
1.2.3 构建双水相体系 固定体系质量为30.0 g。在50 mL离心管中分别加入一定质量的硫酸铵和乙醇溶液,根据乙醇与硫酸铵加入的质量百分比,加入一定量0.5 mg/mL的铁皮石斛粗多糖提取液(三个组成质量百分比之和为100%),置于漩涡混合器上于室温下混合,静置至上下相体积不再发生变化,将双水相体系两相分离并进行透析(1000 Da)48 h。
1.2.4 单因素实验 以(NH4)2SO4浓度、C2H5OH浓度和萃取温度为因素,多糖萃取率、除蛋白率为考察指标,考察3个因素对多糖萃取率与除蛋白率的影响。
1.2.4.1 (NH4)2SO4浓度对多糖萃取率与除蛋白率的影响 固定双水相体系30.0 g,在浓度25%(w/w)C2H5OH、萃取温度25℃的条件下,考察(NH4)2SO4在17%、18%、19%、20%、21%(w/w)下对多糖萃取率和除蛋白率的影响。
1.2.4.2 C2H5OH浓度对多糖萃取率与除蛋白率的影响 固定双水相体系30.0 g,(NH4)2SO4为19%(w/w),萃取温度25℃,考察C2H5OH为21%、22%、23%、24%、25%、26%、27%、28%、29%、30%(w/w)对多糖萃取率和除蛋白率的影响。
1.2.4.3 萃取温度对多糖萃取率与除蛋白率的影响
固定双水相体系30.0 g,(NH4)2SO4为19%(w/w),C2H5OH为25%(w/w),考察萃取温度15、25、35、45、55℃对多糖萃取率和除蛋白率的影响。
1.2.5 响应面试验 在单因素实验基础上,选取(NH4)2SO4浓度、C2H5OH浓度和萃取温度作为考察因素,以多糖萃取率与除蛋白率为响应值,采用三因素三水平进行响应面分析优化,具体见表1。

表1 Box-Behnken实验因素水平设计Table1 Box-Behnken experimental for factor and level
1.2.6 多糖萃取率的计算
1.2.6.1 葡萄糖标准曲线的测定 葡萄糖标准曲线绘制方法根据王琳炜等[15]的方法进行改进:将葡萄糖标准品放置于65℃干燥箱中烘干至恒重,精确称取葡萄糖标准品制成每1 mL含90μL的溶液的葡萄糖标准溶液。分别吸取0.2、0.4、0.6、0.8、1.0 mL于试管中,用去离子水补齐至1.0 mL。向各试管中加入1.0 mL 5%苯酚溶液(现配现用),摇匀后加入5.0 mL浓硫酸,置旋涡振荡器摇匀,90℃水浴25 min,水浴后流水冷却3 min,在波长490 nm处测定吸光度值[16]。以吸光值(y)对应葡萄糖含量(x)获得标准曲线线性回归方程为y=66.356x+0.0021(R2=0.9995)。
1.2.6.2 多糖含量测定 精确取样品1.0 mL,下相稀释10倍,上相无须稀释,精密加1.0 mL 5%苯酚溶液,后加入5.0 mL浓硫酸,置旋涡振荡器摇匀,90℃水浴25 min,在波长490 nm处测定吸光度值。根据葡萄糖标准曲线计算多糖浓度得到多糖萃取率。
根据葡萄糖标准曲线计算出双水相体系中上下相的多糖含量,计算出双水相体系的多糖萃取率。
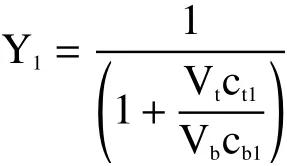
式中:Y1为多糖在下相中的萃取率;ct1为上相多糖浓度,mg/mL;cb1为下相多糖浓度,mg/mL;Vt为上相体积,mL;Vb为下相体积,mL。
1.2.7 除蛋白率的计算
1.2.7.1 蛋白质标准曲线的绘制 蛋白质标准曲线绘制方法根据王琳炜等[15]的方法进行改进:精确称取牛血清白蛋白10 mg,制成0.1 mg/mL的牛血清白蛋白标准溶液。精确称取考马斯亮蓝G-250粉末100 mg,用95%乙醇50 mL溶解,加入100 mL 85%的磷酸溶液,再转移至1000 mL容量瓶中用水定容,制成考马斯亮蓝试剂。分别吸入标准牛血清白蛋白溶液0、0.2、0.4、0.6、0.8、1.0 mL,用去离子水补齐至1.0 mL。加考马斯亮蓝G-250试剂5.0 mL摇匀,放置5 min后,在波长595 nm处测定吸光度值[29]。以横坐标为蛋白含量,纵坐标为吸光度值绘制标准曲线。以吸光值(y)对应蛋白质含量(x)获得标准曲线线性回归方程为y=20.743x+0.0025(R2=0.9987)。
1.2.7.2 蛋白质含量测定 精密取样品1.0 mL,精密加考马斯亮蓝G-250试剂5.0 mL,摇匀,放置5 min,在波长595 nm处测定吸光度值。根据蛋白质标准曲线计算蛋白质浓度得到除蛋白率。
根据蛋白质标准曲线计算出双水相体系中上下相的蛋白质含量,计算出双水相体系的除蛋白率。
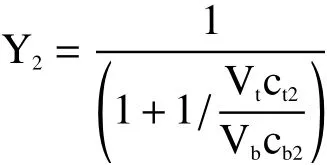
式中:Y2为除蛋白率(即蛋白质在上相的萃取率);ct2为上相蛋白质浓度,mg/mL;cb2为下相蛋白质浓度,mg/mL;Vt为上相体积,mL;Vb为下相体积,mL。
1.3 数据处理
响应面模型的回归方程与显著性统计均通过Design-Expert 8.0.6软件进行统计分析处理。所有实验均重复3组进行。
2 结果与分析
2.1 乙醇-硫酸铵双水相体系相图的确定
在25℃时,使用浊点法得到乙醇-硫酸铵双水相体系的相图如图1所示。相图中曲线上方为双水相区域,能形成双水相体系,下方为均相区,不会分层。因为硫酸铵在有一定浓度的乙醇水溶液中容易析出,因此硫酸铵浓度不宜选择过高[33]。此相图为乙醇-硫酸铵双水相体系分离纯化铁皮石斛多糖提供了理论依据。

图1 乙醇-硫酸铵双水相相图Fig.1 Phasediagram of ethanol-ammonium sulphate
2.2 单因素实验结果
2.2.1 (NH4)2SO4浓度对多糖萃取率和除蛋白率的影响 由图2可知,随着硫酸铵浓度增大,多糖萃取率先增加后减少,这可能是随着硫酸铵浓度增加,体系下相体积增加,利于多糖在下相的富集,而除蛋白率变化幅度较小,硫酸铵质量分数过高时,双水相体系下相的盐析作用增强,导致多糖在下相的溶解度降低,从而抑制了多糖在下相的溶解[22,34−35]。(NH4)2SO4浓度为18%时多糖萃取率达到最大值,与19%时相差不大;但硫酸铵浓度为19%时,除蛋白率达到最大值,除蛋白率接近90%。综合考虑下,选取19%浓度的(NH4)2SO4为宜。

图2 (NH4)2SO4浓度对多糖萃取率与除蛋白率的影响Fig.2 Effect of ammonium sulfate concentration on the extraction rate of polysaccharides and protein removal rate
2.2.2 C2H5OH浓度对多糖萃取率和除蛋白率的影响 由图3可知,随着乙醇浓度增大,多糖萃取率与除蛋白率先增加后减少,乙醇浓度过高时,可能导致得体系中水分子往上相富集,下相体积减小,相比增大,而多糖主要分布于下相,随着水在下相含量降低,多糖在下相的含量降低[35−36],乙醇浓度越高多糖萃取率降低幅度变大,不利于多糖与蛋白质的分离。在25%浓度时多糖萃取率和除蛋白率最高,故选取25%浓度的C2H5OH为宜。
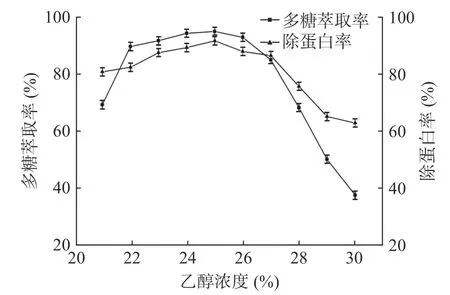
图3 C2H5OH浓度对多糖萃取率与除蛋白率的影响Fig.3 Effect of ethanol concentration on the extraction rate of polysaccharidesand protein removal rate
2.2.3 萃取温度对多糖萃取率和除蛋白率的影响由图4可知,随着萃取温度升高,多糖萃取率与除蛋白率先增加后减少,这可能是随着温度增加,多糖在下相的溶解度增加,有利于多糖溶解在下相,温度进一步升高时,进而影响双水相体系的分配系数与体系压力等,使得多糖萃取率与除蛋白率降低[33]。在25℃时多糖萃取率与除蛋白率最高,故萃取温度选取25℃为宜。
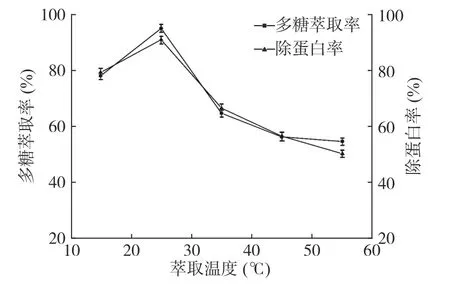
图4 萃取温度对多糖萃取率与除蛋白率的影响Fig.4 Effect of extraction temperature on the extraction rate of polysaccharides and protein removal rate
2.3 响应面试验结果及分析
2.3.1 实验结果与方差分析 在单因素实验基础上,使用软件Design-Expert8.0.6进行三因素三水平响应面试验设计,以(NH4)2SO4浓度、C2H5OH浓度和萃取温度作为自变量,多糖萃取率与除蛋白率作为响应值,共设计17组试验,如表2所示。

表2 响应面试验设计及结果Table 2 Response surface test design and results
试验结果采用Design Expert 8.0.6软件进行统计分析,对表2的数据进行二次多项式拟合,得到二次多元回归模型为:
多糖萃取率(%):Y=94.75−1.91A+1.07B+2.34C+0.16AB−2.21AC−2.26BC−5.05A2−5.94B2−3.68C2
除蛋白率(%):Y=91.76−5.16A−1.90B−4.51C+3.67AB+4.95AC+0.79BC−9.19A2−9.35B2−12.02C2
得到多糖萃取率和除蛋白率的方差分析结果见表3和表4。

表4 除蛋白率方差分析结果Table 4 ANOVA results of protein removal rate
从表3可以看出,回归模型的P-Value<0.0001,表明该模型极显著。模型失拟项的P-Prob=0.1407>0.05,失拟项不显著,说明残差都是由随机误差引起的。模型确定系数R2=0.9895,RAdj2=0.9761,说明该模型可以解释97.61%响应值的变化,模型与试验的拟合程度较好。由方差分析表可以看出,硫酸铵浓度(A)、乙醇浓度(B)及萃取温度(C)对多糖萃取率都有极显著性影响。根据F值可知,影响多糖萃取率的三个因素大小顺序为C>A>B,即萃取温度>硫酸铵浓度>乙醇浓度。交互项AB不显著,AC、BC交互作用极显著。
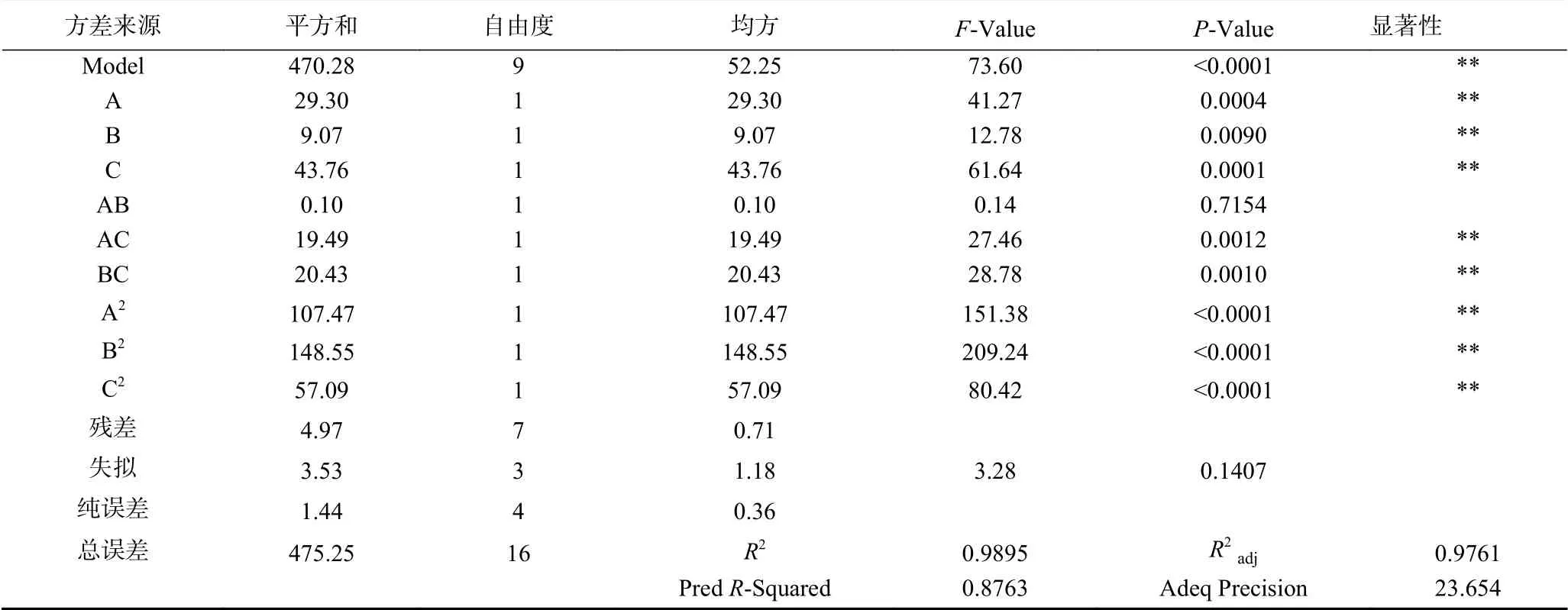
表3 多糖萃取率方差分析结果Table 3 Polysaccharideextraction rate analysis of variance results
从表4可以看出,回归模型的P-Value<0.0001,表明该模型极显著。模型失拟项的P-Prob=0.0516>0.05,失拟项不显著,说明残差都是由随机误差引起的。模型决定系数R2=0.9894,RAdj2=0.9759,说明该模型可以解释97.59%响应值的变化,模型与试验的拟合程度较好。由方差分析表可以看出,硫酸铵浓度(A)、乙醇浓度(B)及萃取温度(C)对除蛋白率都有极显著性影响。根据F值可知,影响除蛋白率的三个因素大小顺序为C>A>B,即萃取温度>硫酸铵浓度>乙醇浓度。交互项BC不显著,AB、AC交互作用极显著。
2.3.2 各因素相互作用对多糖萃取率和除蛋白率的影响 各个因素之间相互作用如下。根据试验拟合得到的回归方程,得出响应面图,图的等高线和三维图的陡峭度反映出每个因素的相互联系。若等高线图中心是圆形就表明影响多糖萃取率的两个因素之间交互作用是不显著的,椭圆形则表明是显著的;三维立体图的曲面越陡,就说明两因素之间交互作用为显著。
由图5、图6、图7的响应面图可知,随着各个因素的增大,多糖萃取率逐渐增大,增加至一定程度时,多糖萃取率达到最大值,但随着各个因素继续增加,多糖萃取率逐渐降低。等高线图可看出乙醇浓度(B)与萃取温度(C)的响应曲面走势最陡峭,其等高线中心呈椭圆形,BC项(P=0.0010)对多糖萃取率有极其显著影响。硫酸铵浓度(A)与萃取温度(C)的响应曲面走势陡峭,AC项(P=0.0012)对多糖萃取率也有极其显著影响。硫酸铵浓度(A)与乙醇浓度(B)的等高线中心趋近于圆形,AB项(P=0.7154)交互作用不显著。
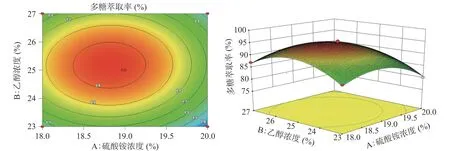
图5 硫酸铵浓度、乙醇浓度交互作用对多糖萃取率影响的响应面与等值线图Fig.5 Response surface and contour plot of interaction of ammonium sulfate concentration and ethanol concentration on the extraction rate of polysaccharides
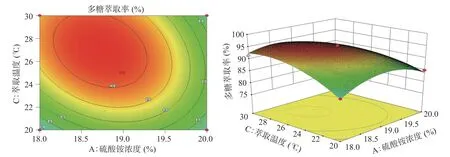
图6 硫酸铵浓度、萃取温度交互作用对多糖萃取率影响的响应面与等值线图Fig.6 Response surface and contour plots of interaction of ammonium sulfate concentration and extraction temperature on extraction rate of polysaccharide
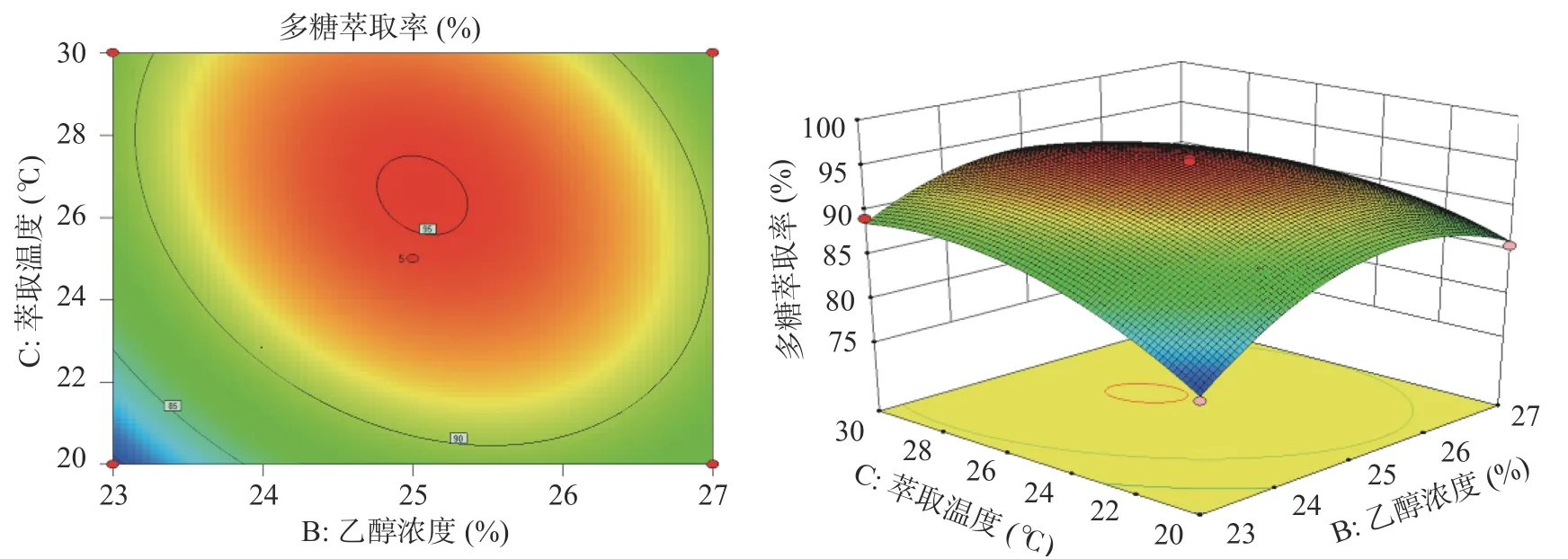
图7 乙醇浓度、萃取温度交互作用对多糖萃取率影响的响应面与等值线图Fig.7 Response surface and contour plots of interaction of ethanol concentration and extraction temperature on extraction rate of polysaccharide
由图8、图9、图10的响应面图可知,随着各个因素的增大,除蛋白率逐渐增大,增加至一定程度时,除蛋白率达到最大值,但随着各个因素继续增加,除蛋白率逐渐降低。等高线图可看出硫酸铵浓度(A)与萃取温度(C)的响应曲面走势最陡峭,AC项(P=0.0008)对除蛋白率有极显著影响。硫酸铵浓度(A)与乙醇浓度(B)的响应曲面走势陡峭,AB项(P=0.0043)对除蛋白率也有极显著影响。乙醇浓度(B)与萃取温度(C)的等高线中心趋近于圆形,BC项(P=0.4019)交互作用不显著。

图8 硫酸铵浓度、乙醇浓度交互作用对除蛋白率影响的响应面与等值线图Fig.8 Responsesurface and contour plotsof interaction of ammonium sulfateconcentration and ethanol concentration interaction on protein removal rate

图9 硫酸铵浓度、萃取温度交互作用对除蛋白率影响的响应面与等值线图Fig.9 Response surface and contour plots of interaction of ammonium sulfate concentration and extraction temperature on protein removal rate
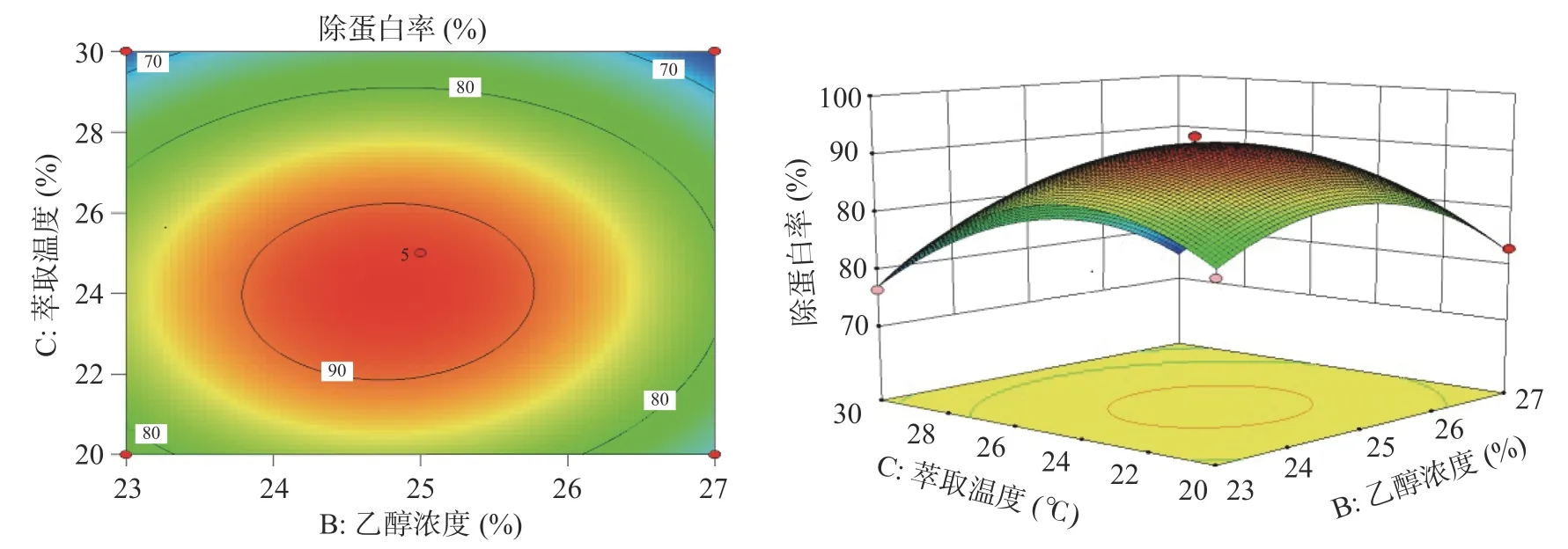
图10 乙醇浓度、萃取温度交互作用对除蛋白率影响的响应面与等值线图Fig.10 Response surface and contour plots of interaction of ethanol concentration and extraction temperature on protein removal rate
2.3.3 响应面优选条件验证 响应面优化结果得知,乙醇-硫酸铵双水相体系萃取纯化铁皮石斛多糖的最佳工艺条件为:硫酸铵浓度为18.76%,乙醇浓度为24.95%,温度为24.92℃,在此条件下铁皮石斛多糖萃取率与除蛋白率分别为94.85%和92.62%。根据实际情况进行调整,双水相体系在30.0 g情况下,硫酸铵浓度为18.80%,乙醇浓度为25.00%,萃取温度为25℃,在该条件下得到的多糖萃取率与除蛋白率94.39%±0.58%和91.36%±0.70%,与模型预测值基本符合,表明所选模型合理,能够模拟和预测该双水相体系对铁皮石斛多糖萃取率与除蛋白率的影响。实验中粗多糖纯度为85.20%±0.74%,双水相纯化后多糖的纯度为95.96%±0.61%,多糖纯度明显提高。
3 结论
本文在单因素实验基础上,采用响应面法对铁皮石斛多糖的乙醇-硫酸铵双水相萃取纯化工艺进行优化,最佳工艺条件如下:硫酸铵质量分数为18.80%,乙醇质量分数为25.00%,萃取温度为25℃,在该条件下得到的多糖萃取率与除蛋白率分别为94.39%和91.36%,多糖纯度由85.20%提高到95.96%。论文研究结果可为铁皮石斛多糖的工业化纯化及实际生产应用提供实验方法与理论依据,同时也表明双水相萃取技术在天然药物活性成分的纯化分离中有着良好的应用前景。
