暹罗芽孢杆菌LW-1产γ-聚谷氨酸发酵培养基的优化
2021-09-02蔡亚慧王文玉皇高峰张继冉徐淑霞张世敏
蔡亚慧,王 青,王文玉,皇高峰,张继冉,徐淑霞,张世敏,吴 坤
(河南农业大学生命科学学院,河南郑州 450002)
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是由D-谷氨酸、L-谷氨酸单体通过γ-羧基与α-氨基间的γ-酰胺键聚合而成的一种天然同聚物,它的分子量为1~200万[1]。γ-PGA的结构特点使它具有可在水中溶解、可生物降解[2]、可吸附重金属离子及对环境友好的性[3]质,因此在日化、食品、医药、环保、农业等领域中被广泛应用[4−6]。
目前,γ-PGA的生产以微生物发酵法为主,因其相对于化学合成法和提取法,具有周期短、生产条件简单等优点,但由于微生物发酵的产出率不高,这限制了γ-PGA的大规模使用[7−8]。现阶段主要通过基因工程的手段改造菌株和优化发酵培养基条件来提高γ-PGA的产量,但因调控γ-PGA代谢的基因众多,单个基因的敲除、敲入或过度表达时细胞内的代谢易造成紊乱[9−11];而培养基成分、前体和培养条件明显影响γ-PGA的产量,尤其是γ-PGA的产量和性质都受到培养基成分的直接影响;因此优化菌种发酵γ-PGA时的培养基是提高工业发酵中γ-PGA产量的重要手段[12−13];王德新、Kongklom、张超及张慧丽等人对Bacillus subtilis、Bacillus licheniformis的发酵培养基成分进行优化,使γ-PGA的产量得到大幅度的提高,甚至达到36.5 g/L[14−17]。应用γ-PGA发酵培养基发酵的微生物多为枯草芽孢杆菌(Bacillus suhtilis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniformis)[18],而关于暹罗芽孢杆菌(Bacillus siamese)发酵生产γ-PGA的文章目前较少。王德新等分别通过优化培养条件和分批补料发酵的方法使Bacillus siamensisSB1001和Bacillus siamensisIR10发酵γ-PGA的产量分别达到了25.22 g/L和(41.40±2.01)g/L[19−20]。
本实验室前期从污水中分离筛选得到一株γ-PGA的高产菌株,鉴定后将其命名为暹罗芽孢杆菌LW-1菌株,本实验用响应面法系统的对暹罗芽孢杆菌产γ-PGA的发酵培养基成分进行优化,进一步提高γ-PGA产量,为该菌株的工厂发酵及γ-PGA的大规模应用奠定基础。
1 材料与方法
1.1 材料与仪器
暹罗芽孢杆菌(Bacillus siamese)LW-1由本实验室选育、保藏;MgSO4·7H2O、CaCl2、KH2PO4·3H2O、NaCl、FeCl3·6H2O、蔗糖、甘油、葡萄糖、麦芽糖、HCl、氯化铵、尿素、MnSO4、淀粉、牛肉膏、无水乙醇、蛋白胨、玉米芯 国药集团化学试剂有限公司;谷氨酸标品Alfa Aesar(中国)公司;胰蛋白胨粉、酵母浸粉、琼脂粉 英国Oxoid公司;谷氨酸钠 河南莲花味精股份有限公司。
MQL-61R立式全温振荡培养箱 上海宜电科学仪器有限公司;DH-500A电加热恒温培养箱 北京中兴伟业仪器有限公司;2695XE高效液相色谱仪美国Waters公司;SJ-CJ-2FD双人单面清洁工作台 苏杰集团有限公司;YXQ-LS-50SII立式压力蒸汽灭菌器 上海工业医疗设备厂;101-2A电加热鼓风干燥箱 天津市泰西仪器有限公司。
1.2 实验方法
1.2.1 培养基配制 种子培养基(g/L):酵母粉5,胰蛋白胨10,氯化钠10;基础发酵培养基(g/L):谷氨酸钠40,柠檬酸钠12,MgSO4·7H2O 0.5,甘油30,(NH4)2SO49,KH2PO40.5,FeCl3·6H2O 0.06,MnSO40.1,CaCl20.15,上述培养基在p H7.5,121℃,0.1 MPa条件下灭菌20 min[21]。
1.2.2 菌种的培养
1.2.2.1 种子培养 甘油管中保藏的菌种接到种子培养基(10 mL/50 mL三角瓶)中,接种量为2%,在培养温度为37℃的,转速为180 r/min条件下激活并培养12 h;然后按相同的接种量将活化菌株接种到种子培养基(50 mL/250 mL)中,在相同的条件下扩增培养12 h[20]。
1.2.2.2 发酵培养 把种子液接种到基础发酵培养基(60 mL /250 mL三角瓶)中,接种量为2%,在37℃的培养温度,210 r/min的转速下摇瓶发酵48 h。
1.2.3 发酵培养基单因素实验 葡萄糖、麦芽糖、淀粉、甘油和蔗糖分别被用作初始发酵培养基中的碳源,在2%接种量下发酵48 h。测定γ-PGA产量,确定最佳碳源,然后对最佳碳源的浓度(10、30、50、70、90、110、130 g/L)进行考察;在最适碳源条件下,以氯化铵、尿素、牛肉膏、硫酸铵、蛋白胨、玉米芯、酵母粉分别作为氮源,确定最佳氮源;然后对最佳氮源的浓度(3、5、7、9、11、13、15 g/L)进行考察;在最适碳氮源条件下对谷氨酸钠的浓度(0、10、20、30、40、50、60、70 g/L)进行优化;在上述最适条件下对柠檬酸钠的浓度(4、6、8、10、12 g/L)进行优化;接着分别对磷酸二氢钾浓度(0、0.5、1.0、1.5、2.0、2.5 g/L)、硫酸镁浓度(0、0.4、0.8、1.2、1.6、2.0 g/L)、硫酸锰浓度(0、0.05、0.10、0.15、0.20、0.25 g/L)、氯化钙浓度(0、0.075、0.150、0.225、0.300 g/L)和三氯化铁浓度(0、0.02、0.04、0.06、0.08、0.10 g/L)进行优化。
1.2.4 响应面试验设计
1.2.4.1 Plackett-Burman设计 基于前期单因素实验的结果,以γ-PGA(g/L)产量为响应值,考察发酵培养基中的九个组分对γ-PGA产量的影响。利用软件Design-Expert 10.0设计试验,每个因素选取高低(+1,−1)两种水平,各因素水平见表1。
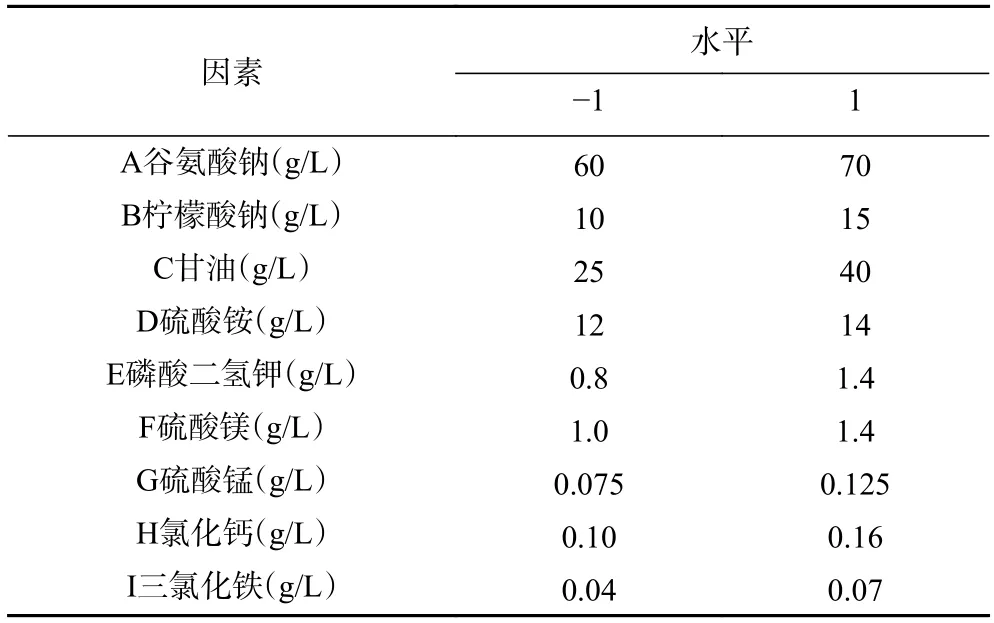
表1 Plackett-Burman试验的因素与水平Table 1 Factors and levels of Plackett-Burman design
1.2.4.2 最陡爬坡实验 主效应基于PBD的结果,系数估计值为正的因子选高值,系数估计值为负的因子选低值[22];响应面分析的中心点为γ-PGA产量(g/L)最高的组。
1.2.4.3 Box-Behnken试验 使用响应面方法进一步优化PBD确定的三个最值得注意的因素,其他因子的浓度与单因素实验的结果一致。利用软件Design-Expert 10.0设计三因素三水平的响应面试验,总共由17个实验组成,包括有5个中心点。自变量为谷氨酸钠、柠檬酸钠和硫酸镁,响应值为γ-PGA(g/L)产量,实验因素的水平见表2。

表2 Box-Behnken实验因素水平Table 2 Factors and levelsof Box-Behnken design
1.2.5γ-PGA含量的测定 把摇瓶里发酵液的p H调至3左右,8000 r/min离心30 min,收集上清液将其调回原pH;取适量的上清液,加入4倍体积的无水乙醇并混匀,在4℃下静置过夜(12 h);6000 r/min离心15 min,得到沉淀,加入适量的超纯水使沉淀复溶,透析脱盐后,置于−80℃下冷冻干燥,最后对提取物称重即得γ-PGA的产量[21]。
1.3 数据分析
使用Microsoft Excel 2016和SPSS 20.0来处理分析试验数据,利用Design-Expert 10处理PB实验和Box-Behnken实验的结果绘制出相关图表,并使用Origin·Pro 9.0进行制图。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同碳源及碳源浓度对γ-PGA产量的影响微生物自身的生长及产物的积累与培养基中碳源的种类与浓度密切相关,因此合适的碳源对于γ-PGA的积累起着正向作用[23]。在初始发酵培养基的基础上,比较不同种类的碳源对暹罗芽孢杆菌LW-1发酵生产γ-PGA的影响,结果如图1所示,从图中可知,当甘油作为碳源时,γ-PGA产量最高为24.52 g/L,和其它碳源相比存在显著性差异(P<0.05)。
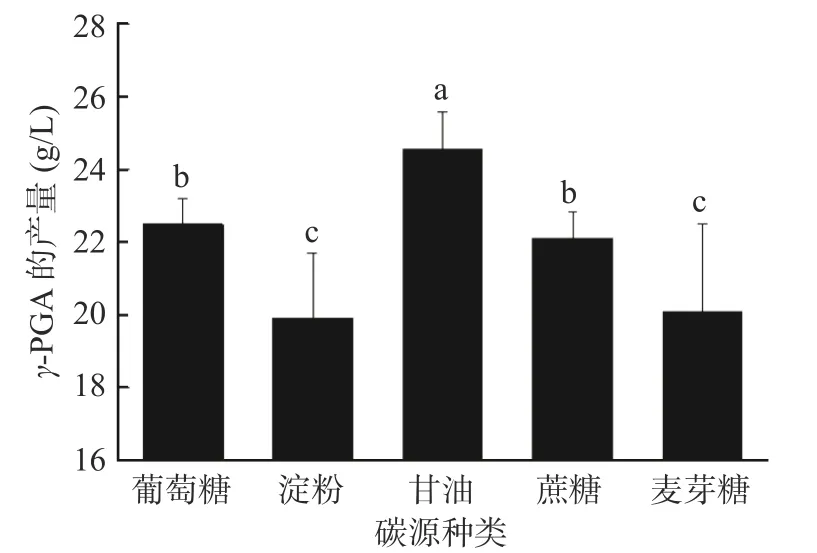
图1 不同碳源对γ-PGA产量的影响Fig.1 Effects of carbon sources on the yield of γ-PGA
对甘油的最适浓度进行研究,结果如图2所示,甘油浓度小于30 g/L时,随着甘油浓度的升高,γ-PGA的产量增加,甘油浓度处于30 g/L时,γ-PGA产量最高为24.82 g/L,而后随着甘油浓度的增加,γ-PGA的产量降低;这可能是高浓度的碳源导致了发酵液的渗透压上升,从而抑制了菌体的生长与代谢,进而抑制了γ-PGA的合成[24]。因此选取浓度为30 g/L的甘油作为碳源。
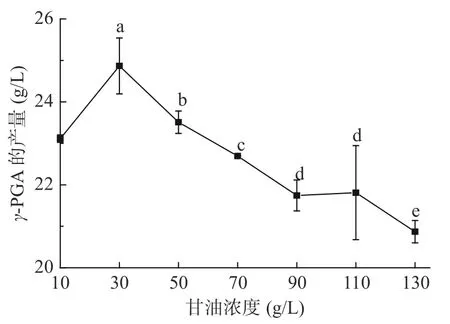
图2 甘油浓度对γ-PGA产量的影响Fig.2 Effects of glycerol concentration on the yield of γ-PGA
2.1.2 不同氮源及氮源浓度对γ-PGA产量的影响在最适碳源的条件下,比较不同种类的氮源对γ-PGA产量的影响,结果如图3所示,从图中可知,当无机类的氮作为氮源时,如:(NH4)2SO4、尿素,γ-PGA产量显著高于有机类的氮(牛肉膏、酵母粉、蛋白胨)作为氮源时的产量(P<0.05),这与Wan-Tack Ju研究的B.subtilisMJ80的结果相似,表明暹罗芽孢杆菌LW-1利用无机氮源的能力强,可能因无机氮源的结构简单更易被菌体利用[25];当(NH4)2SO4作为氮源时,γ-PGA的产量达到最高为24.53 g/L。

图3 不同氮源对γ-PGA产量的影响Fig.3 Effects of different nitrogen sources on the yield of γ-PGA
(NH4)2SO4的浓度对暹罗芽孢杆菌合成γ-PGA时的影响,结果如图4所示,从图中可知:γ-PGA的产量随(NH4)2SO4浓度的增加而增加,(NH4)2SO4浓度为13 g/L时,γ-PGA的产量最大为26.10 g/L,此后γ-PGA的产量变化不大;可能由于在发酵初期,菌体浓度较大,氮源浓度加大时,菌体与氮源接触较充分,发酵反应比较充分,但随着反应的进行,菌体进入衰亡期,即使增加(NH4)2SO4,发酵反应程度也会降低[26],因此选取13 g/L的(NH4)2SO4较为合适。

图4 (NH4)2SO4浓度对γ-PGA产量的影响Fig.4 Effects of (NH4)2SO4 concentration on the yield of γ-PGA
2.1.3 不同浓度的谷氨酸钠对γ-PGA产量的影响因大多数产γ-PGA的菌株为谷氨酸依赖型菌株,谷氨酸钠的浓度对γ-PGA产量有着重要的作用[21]。从图5可以看出,谷氨酸钠的浓度在10~60 g/L时,γ-PGA的产量随着谷氨酸钠含量的增加而增大,谷氨酸钠的浓度为60 g/L时,γ-PGA的产量最大为30.42 g/L,此后γ-PGA的产量开始降低,这说明谷氨酸钠的浓度过高时不利于γ-PGA的合成;可能由于谷氨酸钠与γ-PGA的结构类似,当浓度过高时会对γ-PGA合成酶系产生反馈阻遏,从而抑制了γ-PGA的合成[27]。

图5 谷氨酸钠浓度对γ-PGA产量的影响Fig.5 Effectsof sodium glutamate concentration on the yield of γ-PGA
2.1.4 不同浓度的柠檬酸钠对γ-PGA产量的影响谷氨酸依赖型菌株一般为多碳源形式[28],因此研究柠檬酸钠的浓度对暹罗芽孢杆菌LW-1合成γ-PGA时的影响,从图6可以看出,当柠檬酸钠的浓度小于10 g/L时,随着柠檬酸钠浓度的增加,γ-PGA的产量增大,柠檬酸钠浓度为10 g/L时,γ-PGA的产量达到最大为31.61 g/L,此后γ-PGA的产量开始降低,因此确定柠檬酸钠的最适浓度为10 g/L。

图6 柠檬酸钠的浓度对γ-PGA产量的影响Fig.6 Effects of concentration of sodium citrate on the yield of γ-PGA
2.1.5 无机盐离子浓度优化结果 无机盐离子和微生物的生命活动相关,任何生命活动的进行都离不开无机盐离子,同样无机盐离子的浓度影响着γ-PGA的合成[29]。进一步优化基础培养基中无机盐离子的浓度,优化结果见图7A~图7E。从图中可知,无机盐离子总体对γ-PGA产量影响的大致趋势为γ-PGA的产量随着无机盐离子浓度的增加先升高后降低,最适浓度分别为:MgSO41.2 g/L、KH2PO41.0 g/L、CaCl20.075 g/L、FeCl30.06 g/L、MnSO40.1 g/L。

图7 无机盐离子浓度对γ-PGA产量的影响Fig.7 Effects of inorganic salt concentration on the yield of γ-PGA
2.2 PIackett-Burman试验设计结果及分析
基于单因素实验的结果,采用Plackett-Burman设计(N=9)进行试验,响应值为γ-PGA的产量(g/L)。PB实验设计及响应值见表3(每组试验有3个重复,取平均值)。试验水平、各因素的显著性方差分析及效果分析见表4。该试验模型P=0.0044<0.01,这说明该试验模型影响极显著,决定系数R2=0.9990;校正系数R2Adj=0.9946,这表明该模型对于实验的重复是高度可靠的,各因素水平的设计较合理。谷氨酸钠(A)和柠檬酸钠(B)的P值分别为0.0006、0.0053(<0.01),说明它们对γ-PGA产量的影响极显著;硫酸镁(F)的P值为0.0210(<0.05),说明它对γ-PGA产量有显著影响。此外谷氨酸钠、柠檬酸钠和硫酸镁的估计值均为正值,说明它们对γ-PGA产量为显著的正效应,且影响顺序为谷氨酸钠>柠檬酸钠>硫酸镁。因此选取谷氨酸钠、柠檬酸钠、硫酸镁进行下一步实验。

表3 Plackett-Burman 试验设计及结果Table 3 Design and resultsof Plackett-Burman experiments

表4 Plackett-Burman实验水平及效果分析Table 4 Plackett-Burman experimental level and effect analysis
2.3 最陡爬坡试验结果与分析
基于Plackett-Burman实验的结果分析,选取谷氨酸钠、柠檬酸钠、硫酸镁这三个因素进行最陡爬坡试验,由于谷氨酸钠、柠檬酸钠、硫酸镁均对γ-PGA的合成起积极作用,因此取高水平,爬坡试验设计及结果见表5。从表中可看出,第八组实验γ-PGA的产量达到最高为45.71 g/L,因此将第八组每个因子的水平作为响应面实验的中心点,即谷氨酸钠84 g/L,柠檬酸钠18 g/L,硫酸镁2.1 g/L。
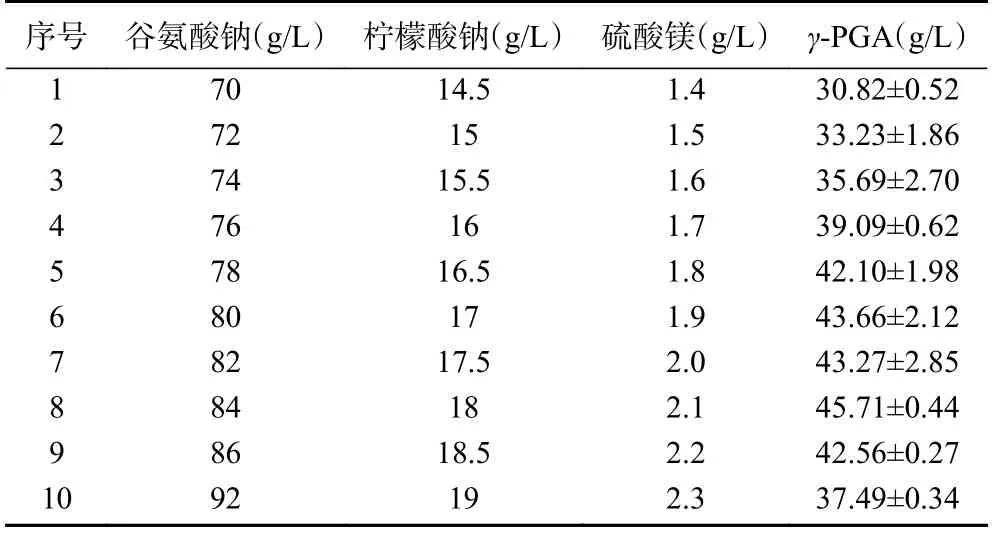
表5 最陡爬坡实验设计及结果Table 5 Steep climbing experimental design and results
2.4 响应面试验
2.4.1 响应面设计及结果 以谷氨酸钠、柠檬酸钠、硫酸镁这三个因素的浓度为自变量,γ-PGA产量(g/L)为响应值,以最陡爬坡实验的结果为依据设计一个三因素三水平的Box-Behnken实验,实验设计和结果见表6,回归模型系数的显著性结果见表7。根据表6结果,运用Design-Expert 10.0软件对其进行二次回归分析,可得到的拟合回归方程为:γ-PGA产量(g/L)= −842.43099+4.62321X1+69.2414X2+63.00469X3+0.022478X1X2+0.40344X1X3−0.4015X2X3−0.033888X12−1.96048X22−21.5451X32。
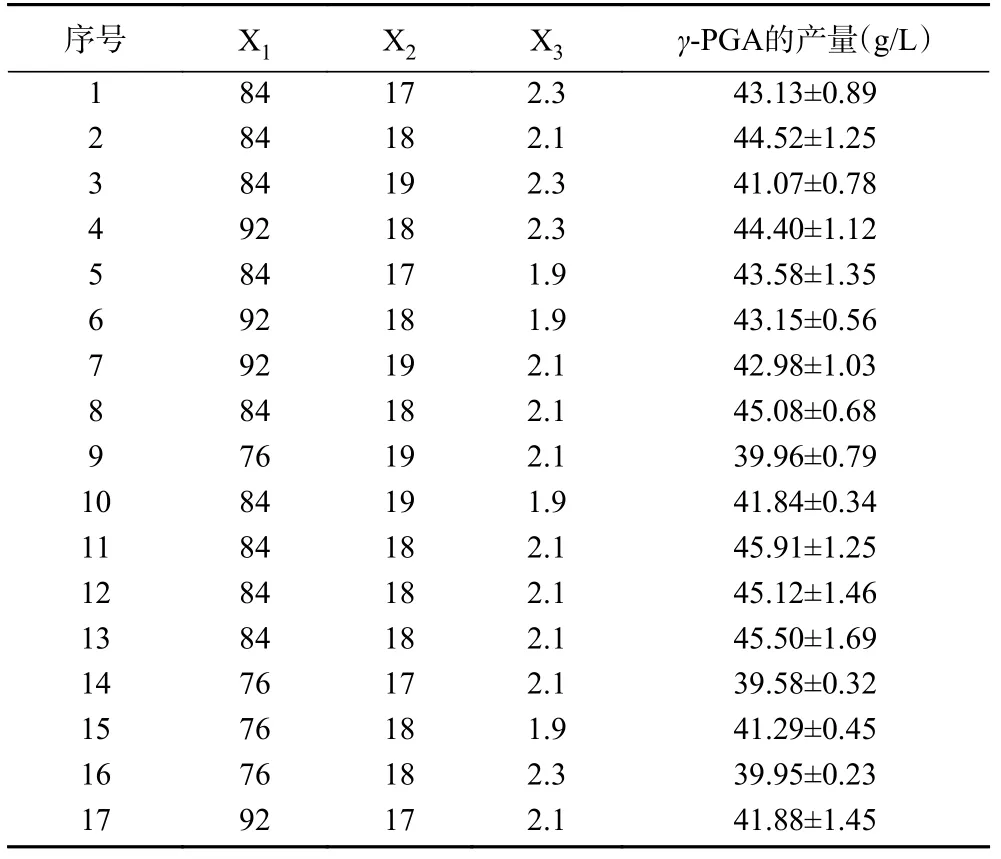
表6 Box-Behnken 实验设计及结果Table6 Design and resultsof Box-Behnken experiments
由表7可知,这个回归模型的P值为0.003(<0.01),模型的失拟项P=0.0857(>0.05),表明该模型的误差小、可信性高、数据拟合度较好;模型的决定系数R2=0.9283和校正系数R2Adj=0.8361,表明该模型的预测值与实际值吻合度较高,且83.61%的暹罗芽孢杆菌发酵产γ-PGA的模型可用该模型来解释;因此该模型可用来分析及预测暹罗芽孢杆菌产γ-PGA的最大值;此外该模型的一次项X1和二次项X12、X22都极显著(P<0.01),表明各因素间对γ-PGA的影响并不是简单的线性关系。

表7 Box-Behnken 结果的统计分析Table 7 Statistical analysis of Box-Behnken design experiments
2.4.2 各因素交互作用分析 借助Design-Expert 10.0软件绘制出相应的响应曲面图与等高线图(图8~图10),两因素间交互作用的情况可用等高线图直观地表现出,等高线之间的轮廓越接近圆形,表明两因素间的相互作用越不明显,轮廓越接近椭圆形,表明两因素间的相互作用越明显[24]。在谷氨酸钠、柠檬酸钠和硫酸镁选取的范围内,γ-PGA产量存在最大值,由响应曲面图可知,随着各因素浓度的增加,γ-PGA的产量先增加后减小,由图8和图9可知,谷氨酸钠引起的响应曲面坡度比柠檬酸钠和硫酸镁的更陡峭,表明谷氨酸钠对暹罗芽孢杆菌LW-1发酵产γ-PGA的影响比柠檬酸钠和硫酸镁更大,从图10可知,柠檬酸钠引起的响应曲面坡度比硫酸镁的陡峭,表明柠檬酸钠对γ-PGA产量的影响比硫酸镁更大;该响应曲面图(图8~图10)说明了两两因素之间存在着交互作用,它们共同影响着γ-PGA的合成,但两两因素间的交互作用对γ-PGA产量的影响没有显著性。

图8 谷氨酸钠和柠檬酸钠对暹罗芽孢杆菌LW-1发酵产γ-PGA的影响Fig.8 Effects of sodium glutamateand sodium citrateon γ-PGA production from Bacillus siamese LW-1
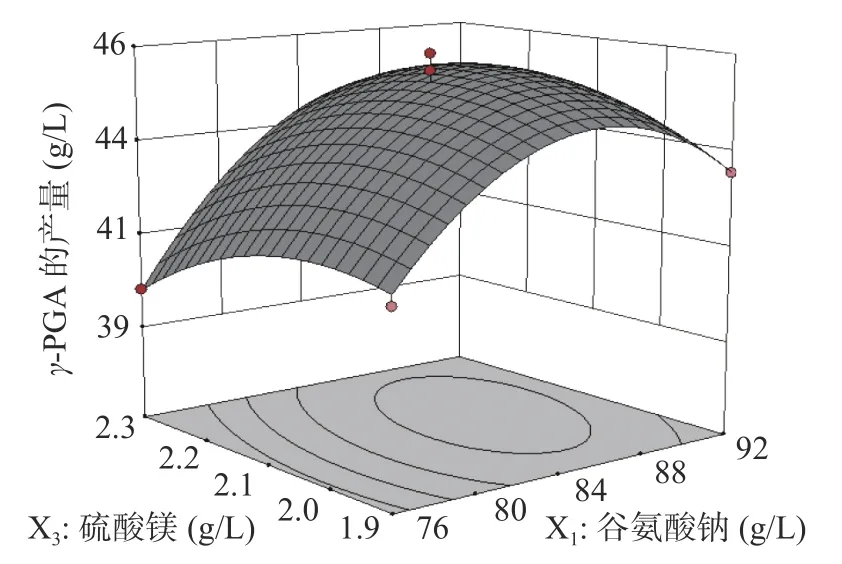
图9 谷氨酸钠和硫酸镁对暹罗芽孢杆菌LW-1发酵产γ-PGA的影响Fig.9 Effects of sodium glutamate and magnesium sulfate on γ-PGA production from Bacillus siamese LW-1
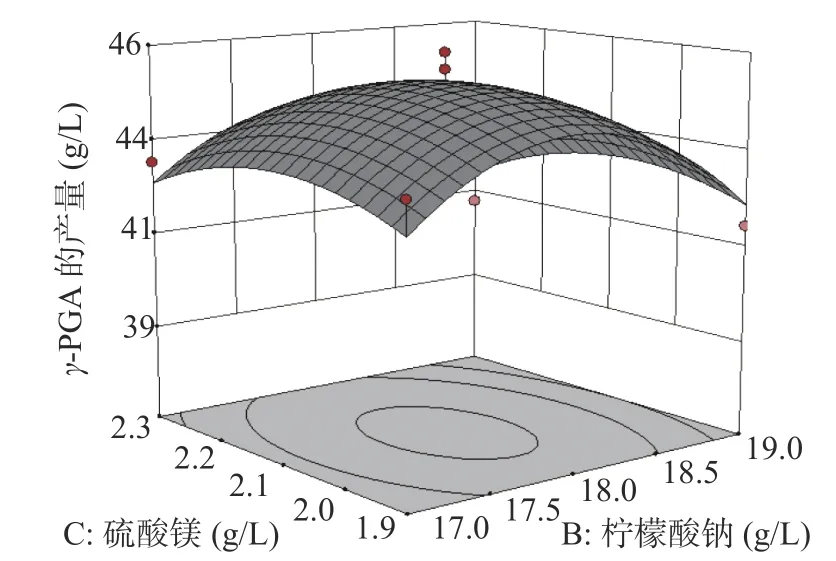
图10 柠檬酸钠和硫酸镁的对暹罗芽孢杆菌LW-1发酵产γ-PGA的影响Fig.10 Effectsof sodium citrate and magnesium sulfate on γ-PGA production from Bacillus siamese LW-1
2.4.3 最优培养基的确定及验证 对拟合回归方程中的自变量进行分析求极值,可得到该模型中三因素的最佳值分别为:谷氨酸钠86.709 g/L,柠檬酸钠17.941 g/L,硫酸镁2.107 g/L,在该发酵培养基中γ-PGA产量的理论最大值为45.91 g/L。
为了验证预测值及回归方程的精确性,按得出的最佳培养基配方:谷氨酸钠86.71 g/L,柠檬酸钠17.94 g/L,MgSO4·7H2O 2.11 g/L,甘油 25 g/L,KH2PO41.4 g/L,(NH4)2SO414 g/L,MnSO40.075 g/L,CaCl20.1 g/L,FeCl3·6H2O 0.04 g/L,进行5次重复实验,得到γ-PGA的产量为(44.78±0.62)g/L,与模型预测出来的产量吻合度达97.54%,比在初始培养基中的产量(23.26 g/L),提高了1.93倍。
3 结论
本文通过单因素试验与PBD试验确定了培养基中对γ-PGA产量影响显著的因子,并通过响应面法对显著因子进行优化,得出显著因子的最佳添加量为:谷氨酸钠 86.71 g/L,柠檬酸钠 17.94 g/L,MgSO4·7H2O 2.11 g/L,经过验证,在最佳培养基条件下γ-PGA的产量为44.78 g/L,产量比优化前(23.26 g/L)相比提高了1.93倍。因此用响应面法得到γ-PGA的最佳发酵培养基是合理的、可行的,此外这为γ-PGA工业化大量发酵提供了一种新型菌株。但目前γ-PGA的提取方法有有机溶剂沉淀法、化学沉淀法和膜分离沉淀法,这些提取方法成本较高、工艺复杂,γ-PGA的提取方法还需进一步改进;此外目前对于生产特定分子量的γ-PGA一般用温度、超声波等方式对高分子量γ-PGA进行降解,用菌株发酵生产特定分子量的γ-PGA也需进一步探究[30−32]。
