九龙牦牛AQP7基因鉴定及在各组织中的表达和定位
2021-09-02李娟,郑姚,王利
李 娟,郑 姚,王 利
(西南民族大学 动物科学国家民委重点实验室,四川 成都 610041)
水通道蛋白(AQPs)是一类具有高选择性的跨膜通道蛋白,其主要功能是通过多种途径实现细胞运输水和促进一些低分子量的溶质通过[1-2]。AQPs由13个成员组成(AQP0~AQP12)[3],广泛分布于各种组织和器官中,其中水通道蛋白7(Aquaporins 7,AQP7)是一种水/甘油转运蛋白[4],允许水和小的中性电荷溶质,如甘油、尿素、嘌呤以及亚砷酸盐通过[5-6],在机体糖代谢和脂代谢过程中起着重要的作用,影响脂质和葡萄糖的稳态。AQP7已成为脂肪细胞代谢的潜在调节因子,在脂肪组织中受到胰岛素的反向调节[7-8],胰岛素通过PI3K途径影响AQP7基因启动子区的胰岛素反应元件,与成人肥胖有着密切的联系[9-10]。除此之外,其还参与了脑缺血、充血性心力衰竭、高血压和血管生成等相关疾病的心血管功能和病理过程[11]。牦牛是青藏高原上的关键物种,生长在寒冷低氧等极端环境,对青藏高原生态系统的协调和稳定发展起着重要的作用[12-13],所以牦牛的健康养殖和生产性能的提高极其关键。目前,AQP7基因主要在小鼠[14]、藏山羊[15]和人类[16]中进行研究,在高原牦牛上的研究还未见报道,其作为参与代谢的心血管功能的关键基因,对探讨牦牛在高原低氧环境下的适应性和生长有着重大的意义。本研究对九龙牦牛AQP7基因进行克隆及表达分析,探讨其在牦牛组织器官中的表达模式,旨在为后续探讨该基因的功能提供参考资料。
1 材料和方法
1.1 试验动物与样品采集
本试验所用牦牛来自四川九龙县,随机选择3头健康成年雄性九龙牦牛作为研究对象,采集心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉及瘤胃8个组织,一部分组织装入冻存管中储存于液氮,另取一部分用装有4%多聚甲醛固定液的离心管保存。
1.2 试验材料
AQP7兔多克隆抗体购自北京博奥森生物技术有限公司;RNAiso Plus试剂盒、PrimeScriptTMRT Reagent Kit试剂盒、pMDTM19-T Vector Cloning Kit试剂盒和DH5α感受态细胞均购于宝日医生物技术(北京)有限公司。AQP7基因扩增及荧光定量引物由上海生物工程有限公司合成(表1)。
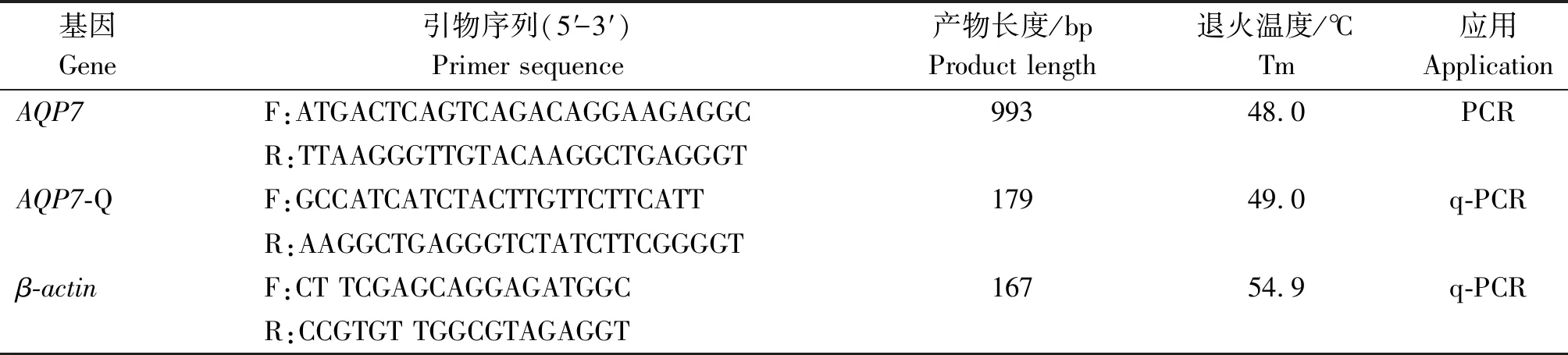
表1 引物信息Tab.1 Primer information
1.3 组织总RNA提取及cDNA的制备
称取0.1 g牦牛心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉和瘤胃,将组织剪碎后加入液氮至研钵中进行研磨,按照RNAiso Plus试剂盒说明书对8种组织RNA进行提取,1%琼脂糖电泳和Nano Drop 2000分光光度计对其进行检测。获得质量完好的RNA按照PrimeScriptTMRT Reagent Kit说明书进行cDNA的制备,获得的cDNA于-20 ℃保存备用。
1.4 AQP7基因的克隆测序
牦牛心脏cDNA为模板扩增AQP7基因,对应的PCR扩增体系为50 μL:上游和下游引物各2 μL(0.5 μmol/L),1.1×T3 Super PCRMix酶44 μL(1×),cDNA模板2 μL(100 ng/μL)。反应程序:98 ℃预变性2 min;98 ℃变性10 s,54 ℃退火10 s,72 ℃延伸15 s,共35个循环;72 ℃再延伸2 min,4 ℃保存。获得的PCR产物用1%琼脂糖电泳检测,按照DNA回收试剂盒说明书对目的片段进行胶回收,胶回收产物按照pMDTM19-T Vector Cloning Kit说明书进行连接,转化到DH5α中,将转化菌液涂布于含有氨苄(Amp+)的LB固体培养基上,37 ℃培养过夜,挑取单菌落,PCR进行鉴定,阳性菌液送生工生物工程(上海)股份有限公司进行测序。
1.5 AQP7基因生物信息学分析
测序得到的序列与目的基因序列进行比对,确定其为目的基因后对其基本性质进行分析,首先使用ORF Finder寻找序列的开放阅读框,同时得到相应的氨基酸序列。用在线软件ExPASy、ProtScal、TMHMM、SignalP和SMART对蛋白质理化性质、疏水性、跨膜结构、信号肽、结构功能域和蛋白互作进行分析。利用SOPMA软件对氨基酸二级结构进行预测,用MEGA 6.0软件进行系统进化树的构建。
1.6 AQP7基因组织表达差异分析
利用RT-qPCR技术检测牦牛AQP7基因在心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉和瘤胃组织中的表达差异,以β-actin作为内参矫正基因的相对表达水平。10 μL反应体系:上下游引物均为0.8 μL(0.5 μmol/L),cDNA模板1 μL(50 ng/μL),TB GreenTMPremixExTaqTMⅡ 5.2 μL(2×),ddH2O 2.2 μL。反应程序:95 ℃预变性3 min;95 ℃变性10 s,59.4 ℃退火10 s,共40个循环。3个生物学重复,每个样本重复检测3次,用2-ΔΔCt法进行分析,用SPSS 26.0软件分析其显著性。
1.7 AQP7蛋白免疫组织化学检测
用多聚甲醛固定的8种牦牛组织经脱水、包埋和切片后,进行染色,3%甲醇双氧水中室温放置10 min,用PBS将切片进行清洗,浸入pH值6.0、0.01 mol/L的柠檬酸盐缓冲液中,将其进行加热至沸腾,冷却后用PBS洗涤2次,随后向其滴加山羊血清封闭液后室温放置20 min,滴加一抗(1∶100),滴加生物素化二抗,将其放置于37 ℃中孵育30 min,用PBS清洗后室温下进行DAB显色,最后利用苏木素进行轻度复染,脱水透明后用中性树胶封片。通过显微镜观察染色结果,采集3张400倍显微图像,用Image-Pro Plus 6.0图像分析系统对结果图片进行分析,用SPSS 26.0软件分析其显著性。
2 结果与分析
2.1 九龙牦牛AQP7基因克隆
心脏cDNA为模板扩增后获得与预期目的片段大小一致的基因片段(图1),经测序获得AQP7基因片段长度为993 bp,ORF为993 bp,序列共编码330个氨基酸,将获得的序列提交到NCBI,获得登录号为MW045313。
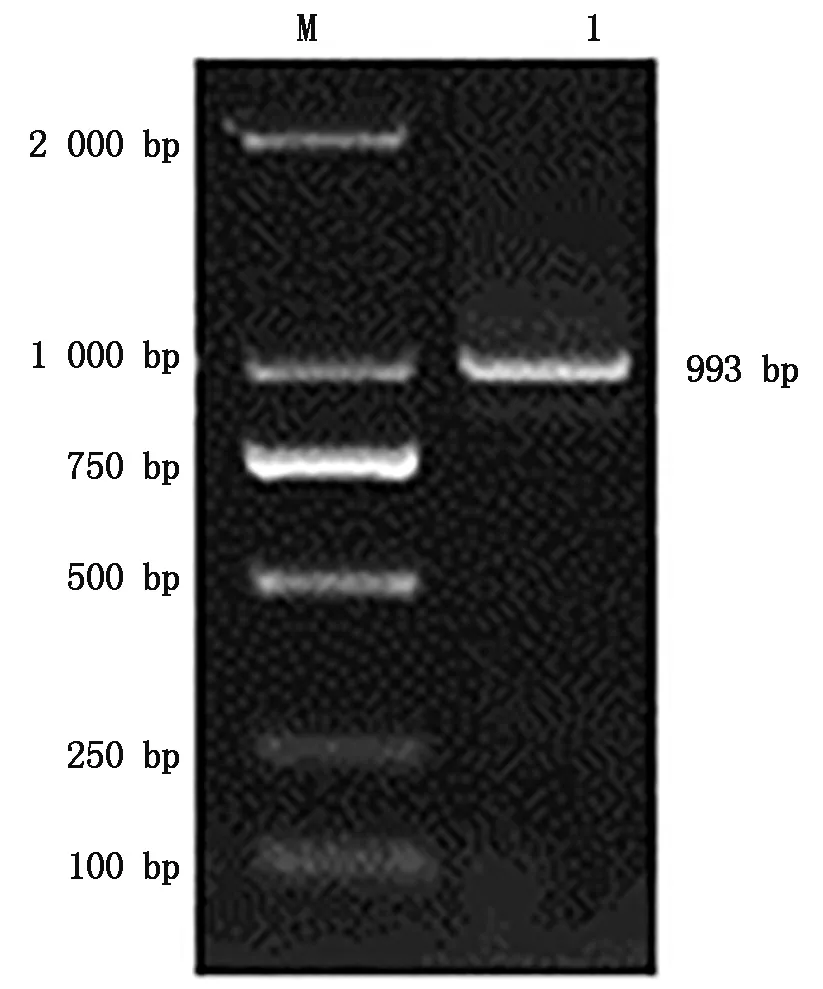
图1 AQP7基因PCR扩增Fig.1 PCR amplification of AQP7
2.2 九龙牦牛AQP7基因生物信息学分析
获得的牦牛AQP7基因序列比对后,下载相应的同属及其他动物的序列进行同源性分析,发现与黄牛的同源性最高为99.7%,其次为水牛(98.7%)、山羊(95.0%)和瘤牛(90.6%),与小鼠的同源性最低,为67.8%。系统进化树的构建发现该基因与黄牛和瘤牛聚为一类,亲缘关系最近,与水牛的物种亲缘关系次之(图2)。九龙牦牛AQP7蛋白理化性质分析结果显示,其分子式为C1651H2548N424O445S16,分子质量为35.97 ku,等电点9.32。编码的氨基酸有17个带负电残基(Asp+Glu),24个带正电残基(Arg+Lys),脂肪系数为93.94,不稳定系数为33.43,亲水性平均值为0.318,推测该蛋白为稳定疏水蛋白。功能预测发现,牦牛AQP7蛋白有典型的疏水区,此外有6个典型的跨膜螺旋区,含有1个MIP结构功能域。蛋白质互作分析发现其与同家族的AQP8、AQP11和AQP12B等存在相互作用。AQP7有α螺旋(27.27%)、β折叠(2.42%)、延伸片段(24.55%)和无规卷曲(43.33%)4种二级结构,其中无规卷曲占比最高。
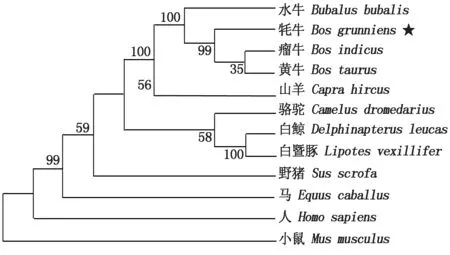
图2 九龙牦牛AQP7基因进化树Fig.2 Phylogenetic tree of AQP7 gene of Jiulong yak
2.3 九龙牦牛AQP7基因组织表达谱
牦牛AQP7基因在不同组织中的表达结果显示(图3),AQP7基因在心脏的表达量最高,肌肉和肾脏次之,表达量相对较低的组织为肝脏、脾脏、肺脏、小肠和瘤胃。AQP7基因在心脏和肌肉中的表达量极显著高于肾脏、肝脏和脾脏等其他组织(P<0.01),且在心脏中的表达量极显著高于肌肉组织(P<0.01)。
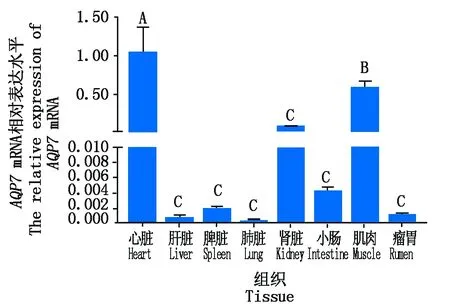
不同大写字母表示差异极显著(P<0.01);相同字母表示差异不显著(P>0.05)。The different capital letters show extremely significant different(P<0.01);The same letter show no significant different between stages(P>0. 05).
2.4 九龙牦牛组织中AQP7蛋白表达和定位
通过免疫组织化学方法检测,发现AQP7免疫阳性细胞在九龙牦牛心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉和瘤胃组织中均检测到,阳性颗粒主要分布在细胞质中。AQP7蛋白表达于多种组织器官,在心脏和肌肉的肌细胞、肾脏的近曲小管内皮细胞和集合管内皮细胞中表达较为丰富。除此之外,AQP7蛋白在毛细血管内皮细胞、肝细胞、淋巴细胞、小肠固有层细胞核中也都有表达(图4)。平均光密度值分析可知(图5),牦牛AQP7蛋白在心脏中的表达量最高,肾脏和肌肉次之,在肝脏、脾脏、肺脏、小肠和瘤胃中的表达量相对较低,且AQP7蛋白在心脏、肾脏和肌肉中的表达显著高于肝脏、脾脏、肺脏、小肠和瘤胃(P<0.05)。
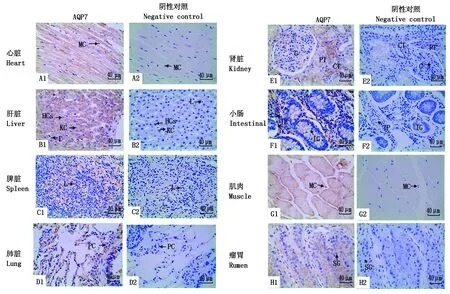
A1~H1.牦牛AQP7蛋白在心脏、肝脏、脾脏、肺脏、肾脏、小肠、肌肉、瘤胃中的免疫组织染色;A2~H2.阴性对照。MC.肌细胞;KC.枯否细胞;HCs.肝细胞;L.淋巴细胞;PC.上皮细胞;G.肾小球;CT.集合管;PT.近曲小管;IG.肠腺; IP.固有层; SG.颗粒层。
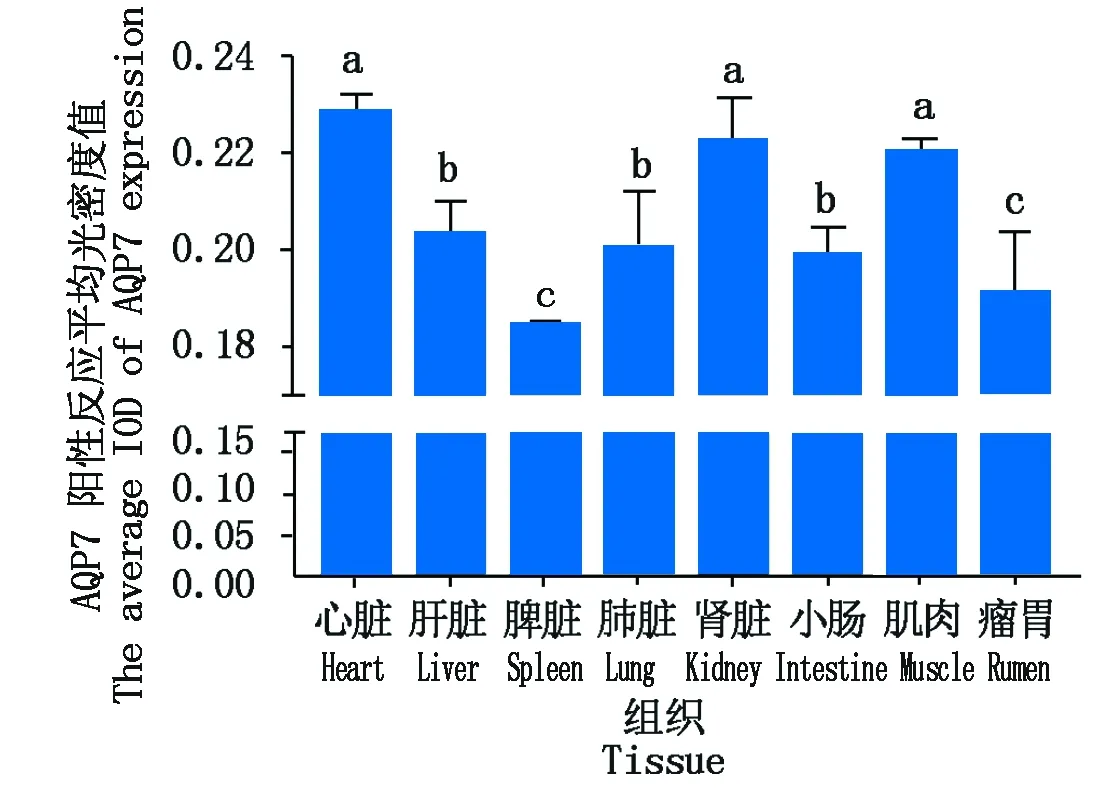
不同小写字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。The different small letters show significant difference(P<0.05);The same letter show no significant difference between stages(P>0. 05).
3 讨论
目前,关于水通道蛋白转运水和其他小分子物质的功能研究已相当完善,但对于其通过转运功能参与其他维持机体相对稳态的机制还不清楚。近年来,水通道蛋白在皮肤病[17]、肾脏疾病[18]和癌症[19]等疾病中的研究越来越多,关于其低氧适应性和生长机制的研究相对较少,牦牛作为高原上耐寒和耐低氧的物种,了解其天然的适应性机制有利于解决目前适应高原环境的问题以及提升牦牛生产性能。前人的研究表明,AQP4和AQP9基因与牦牛的低氧适应性相关[20-21],对AQP7基因的研究有利于加强水通道蛋白家族在低氧适应性过程中的作用机制研究,并且参与糖代谢和脂代谢[22-23],在一定程度上有利于进一步加强探讨其低氧适应性机制。因此,本研究克隆获得九龙牦牛编码区为993 bp 的AQP7基因,编码330个氨基酸,与张亚楠等[15]克隆获得的藏山羊的AQP7基因片段长度一致,同源性也相对较高,其具有的跨膜结构和MIP结构域与藏山羊一致,但蛋白分子式和氨基酸的序列有一定的差异。牦牛和藏山羊均生活在高海拔地区具有较强的抗逆性,所以在一定程度上有相似性。除此之外,蛋白基本理化性质分析和结构也为进一步探讨牦牛AQP7蛋白在机体当中可能的功能作用提供参考资料。
前人研究表明,人AQP7基因在肾脏[24]、脂肪组织[25]、睾丸[26]和心脏[27]中均有表达,本研究通过RT-qPCR方法发现,AQP7基因在九龙牦牛心脏、肝脏和脾脏等8种组织中均有表达,且在心脏、肾脏和肌肉中的表达量最高,与藏山羊的组织表达相对一致[15]。AQPs在心血管系统中举足轻重,AQPs参与了一些相关疾病的心血管功能和病理过程[28],九龙牦牛AQP7在心脏中高表达说明了其在心脏的功能作用中起着重要的作用,这可能是由于牦牛心脏对高原环境有一定的适应性所导致的,可以通过对心脏血液循环系统的调节来促进机体在高原环境的适应性;在肾脏中的高表达可能是由于肾脏作为生物体的泌尿系统,参与了水的过滤和重吸收等过程,水的运输和其他小分子物质的运输均依赖于水通道蛋白的功能作用;肌肉当中AQP7的高表达,可能是因为肌肉参与了机体的能量代谢过程,且肌肉组织中含有脂肪成分。已有报道表明,人AQP7参与机体的脂代谢过程,调节机体的能量稳态[29]。
组织定位研究发现,AQP7蛋白在九龙牦牛心脏、肝脏和脾脏等8个组织当中均有阳性颗粒,和RT-qPCR结果基本一致。AQP7定位于小鼠脂肪组织、心脏和横纹肌的毛细血管[23],这与本研究结果相似。AQP7基因敲除小鼠心脏的甘油和ATP含量降低,说明AQP7对阐明心脏生理和病理的过程具有重要意义[28]。此外,AQPs在肾脏特异性细胞类型和液体稳态中的生理和病理功能已被深入研究[30],并可能成为一种新型的肾脏疾病的理想生物标志物。综上所述,可以推断AQP7蛋白在牦牛心脏、肾脏和肌肉中起着至关重要的作用。牦牛在生理学和组织学上都具有独特的性状,以适应青藏高原低氧高海拔的恶劣生活环境,具有与黄牛相比更敏感的低氧感知能力和更高的代谢能力[31]。心脏和肌肉均作为能量代谢的重要器官,在对环境的适应性方面起着重要的作用,AQP7通过参与牦牛心脏和肌肉的能量代谢过程来影响牦牛对极端环境的适应性,且AQP7在脂代谢的过程中有着不可替代的作用,本研究结果对于了解AQP7在牦牛生长过程中对脂代谢的调控机制提供了重要的参考数据,并且为探讨牦牛通过AQP7参与能量代谢来影响高原低氧环境的适应性机制奠定了基础。
