他克莫司与常用抗真菌药体外协同抗白念珠菌作用的初探
2021-09-01王莉王华周洁翟晓翔
王莉 王华 周洁 翟晓翔
(1.上海市第七人民医院皮肤科,上海 200137;2.上海浦东公利医院急诊科,上海 200135)
近年来,为应对真菌耐药率的增加,我们尝试筛选出一些对常用抗真菌药物具有协同作用且易获取的药物。先前的研究已经观察到28种非经典抗真菌药,如他克莫司、舍曲林和利福喷丁与适当浓度的氟康唑联用对白念珠菌的体外抑制作用,其中他克莫司(FK506)和环孢菌素A(CyA)对氟康唑表现出最显著的体外协同抗白念珠菌作用[1]。我们采用棋盘式微量液基稀释法对他克莫司与部分常用抗真菌剂的体外协同作用进行了比较,进而筛选出药物组合的最佳方案。研究结果总结如下。
1 材料与方法
1.1 材料
药物 他克莫司(tacrolimus,FK506)原料药购自麦克林生化科技有限公司;两性霉素B(amphotericin B,AmB)购自西安南斯科技有限公司;咪康唑(miconazole,MCZ)、伊曲康唑(itraconazole,ITZ)、酮康唑(ketoconazole,KCZ)及特比萘芬(terbinafine,TBNF)购自西格玛奥德里奇(上海)贸易有限公司。
主要试剂 RPMI1640粉末购自上海如吉生物科技发展有限公司;二甲基亚砜(dimethyl sulphoxide,DMSO)购自西格玛奥德里奇(上海)贸易有限公司。
受试菌株 对氟康唑耐药的白念珠菌临床分离株(FCZ-resistant isolates ofCandidaalbicans),共3株,由海军军医大学药学院保存和提供。 经过形态和生化鉴定并筛选用于体外药物敏感性测试后,获取了MIC80> 256 μg / mL的耐氟康唑菌株。同时,为确保药物测试可靠性,选择了CLSI推荐的ATCC菌株作为标准菌株:近平滑念珠菌ATCC22019(CandidaparapsilosisATCC22019)。
培养基配制 SDA培养基:900 mL三蒸馏水中加入葡萄糖40 g、琼脂18 g、蛋白胨10 g,搅拌加热至完全溶解;用氯霉素水溶液(2 mg/mL)将其pH调节至7.0±0.1(常温),将该溶液稀释至1000 mL,分管密封包装,经高压灭菌,并在4℃下保存、备用。 YEPD培养液:900 mL三蒸馏水中加入葡萄糖20g、蛋白胨20g、酵母提取物10g,充分搅拌至完全溶解;用氯霉素水溶液(2 mg/mL)调整pH,将该溶液稀释至1000 mL,分管密封包装,经高压灭菌,并在4℃下保存、备用。 RPMI1640培养基:900 mL三蒸馏水中加入吗啡啉丙磺酸34.5 g,碳酸氢钠2.0 g、 RPMI1640粉末10 g,搅拌至完全溶解;用NaOH溶液(1 mol / L )将其pH调节至7.0±0.1(常温);将该溶液稀释至1000 mL使用直径为0.22 μm的微孔膜(广东环凯生物科技有限公司生产,Ф50水系)进行过滤,等分并高压灭菌后在4℃下保存、备用。
主要仪器设备 96孔平底带盖平板购自上海艾研生物科技有限公司;立式压力蒸汽灭菌器(LDZX-50KBS)购自上海申安医疗器械厂;智能型真菌培养箱(MJX-150L)购自上海培因实验仪器有限公司;单人双面净化工作台(SW-CJ-1F)购自苏州安泰空气技术有限公司;HZ-9211K恒温振荡器、BSA1245-CW电子天平以及Multiskan MK3型酶标检测仪均购自苏州赛恩斯仪器有限公司。
1.2 方法
他克莫司原液的配制 取1.5 mL EP管1根,将1 mL二甲基亚砜作为溶剂、1 mg他克莫司原料药为溶质,配制成药物原液,其溶度为1 mg/mL,并在4℃条件下,避光干燥保存备用。
抗真菌药物母液的配制 以二甲亚砜(DMSO)作为溶剂,将酮康唑、伊曲康唑、特比萘芬、咪康唑及两性霉素B等多种原料药作为溶质,各自配制成6.4 mg/mL的母液并-20℃条件下保存备用,两性霉素B母液应注意避光。
菌悬液的配制 取1 mL的 YEPD培养液,把挑取自4℃的SDA培养基的少量菌株接种至该培养液中,并在30℃,200 r/min环境参数下进行震荡培养。经过24 h活化后(“一次活化”),该真菌处于指数生长的后期;“一次活化”完成后,取10μL该种“一次活化”真菌溶液,并将其加入1 mL YEPD培养液中,继而以相同环境参数及方法活化16 h(“二次活化”);“二次活化”完成后,取10 μL的该种“二次活化”真菌培养液加入到10 mL RPMI1640培养液中,使用血细胞计数器设定其浓度为5×103CFU/mL并定为实验用菌悬液。 任一菌株的接种必须限定在15 min内,同时,确保用于继代和培养的培养基不会污染实验中使用的培养基。
他克莫司的抑菌浓度(MIC80)值判定 依据2002年美国临床实验室标准协会(CLSI)发布的M27-A2程序实施药物MIC值的测定。实验使用96孔板作为培养板;第1列每孔中添加RPMI 1640培养基100 μL,作为阴性对照孔;第2列至第12列每孔中添加菌悬液100 μL,作为实验孔;然后在第2列每孔中添加100 μL他克莫司药物溶液,此时他克莫司的浓度为500 μg / mL,待在充分混合后从第2列的孔中吸取100 μL含药菌液并添加入第3列对应孔中,待再次充分混合后同样吸取100 μL含药菌液并添加入第4列,依次操作直至第11列;最后从第11列中吸取100 μL含药菌液并丢弃; 第12列为无药真菌溶液,作为无药对照孔。此时,第2列至第11列中的药物浓度分别为500 μg/mL、250 μg/mL、125 μg/mL、62.5 μg/mL、31.25 μg/mL、15.63 μg/mL、7.81 μg/mL、3.91 μg/mL、1.95 μg/mL、0.98 μg/mL。将培养板置于35℃的恒温箱中进行培养,48 h后取出培养板,通过酶标记分析仪测量每孔在波长为630 nm的OD值,并记录为MIC80值(真菌生长被抑制80%时的药物浓度,下同),如果MIC80值超出可测范围:当MIC80值在最大浓度500 μg/ mL之上,则记录为“>500 μg/mL”;当MIC80值等于或低于最小浓度0.98 μg/mL,则记录为“≤0.98 μg/mL”。重复2~3次上述实验过程,当MIC80值多次仅差一个药物浓度差或相同时即止。在观测记录该药物的MIC80值之前,必须查看第1列的培养液是否透明、第12列的真菌生长是否正常,以此判断实验过程有无被污染,确保实验数据的准确可靠。
抗真菌药物的抑菌浓度(MIC)值判定 抗真菌药物的抑菌浓度(MIC)值判定方法基本同上。以伊曲康唑为例:在第1列和第12列中分别加入阴性对照RPMI 1640培养基和阳性对照菌悬液200 μL,第2列每孔中添加32 μL伊曲康唑药液和168 μL菌悬液,即伊曲康唑的起始浓度为1024 μg/ mL。从第2列到第11列依次倍比稀释,最后从第11列中吸取100 μL含药菌液并丢弃。将培养板置于恒温箱中培养48 h后取出,在确定实验过程无污染的情况下测定OD值及MIC80值。通过该方法分别测定特比萘芬、酮康唑、咪康唑对实验菌株的MIC80值及两性霉素B的MIC值。
他克莫司与抗真菌药合用后的分数抑菌浓度指数(FICI)值判定 以3株耐氟康唑的白念珠菌临床分离株为实验菌株,使用棋盘微液稀释法,测算他克莫司(FK506)分别联合两性霉素B、特比萘芬、酮康唑、咪康唑和伊曲康唑等药物的FICI值。具体方法如下:实验使用96孔板作为培养板;组合使用的他克莫司与抗真菌药物分别在培养板的第A至H行及第2至11列纵、横两个方向依次进行4倍的倍比稀释;抗真菌药物稀释范围:伊曲康唑:256~0 μg/mL;酮康唑:64~0 μg/ mL;两性霉素B:8~0 μg/mL;咪康唑:64~0 μg/mL;特比萘芬:64~0 μg/mL。他克莫司的初始药物浓度为其对相应受试菌株MIC80值的1/4;同样在培养板的第1行和第12行设置阴性对照组(培养基对照)和无药对照组(真菌生长对照)。将培养板置于恒温箱中培养48 h后取出,在保证实验过程无污染的情况下测定每孔在630 nm下的OD值,以确定几种药物合用后的MIC并逐个计算出FICI。所有实验平行进行3次,取3次的平均值作为最终的FICI。
他克莫司与抗真菌联合使用后的效果评价 他克莫司与5种抗真菌药物两两组合后各药的MIC值除以各药独用时的MIC值的商之总和为FICI,即FICI =MICA合/ MICA单+MICB合/ MICB单。判断标准:若FICI≤0.5,则可判定两药间具有协同作用,并且FICI值与协同作用负相关;若0.5
质控菌 依据CLSI提出的M27-A2方案,本实验采用的质控菌是近平滑念珠菌ATCC22019(CandidaparapsilosisATCC22019),每次实验需准备药敏面板若干和一个质控菌面板。部分抗真菌剂对质控菌的MIC80值:酮康唑:0.125~0.5 μg/mL;伊曲康唑:0.06~0.25 μg/mL;两性霉素B的MIC值:0.25 μg/mL~1.0 μg/mL。 仅当抗真菌剂对质控菌的MIC值在标准值内且菌株生长良好时,才能判定为实验过程准确,实验数据可靠。
2 结 果
2.1 他克莫司对常用抗真菌药体外抗耐药白念珠菌协同作用
在实验的这一部分中,我们使用棋盘法观察了他克莫司和5种常用的抗真菌药(两性霉素B、特比萘芬、咪康唑、伊曲康唑和酮康唑)联合使用对3株白念珠菌株(Candidaalbicans103、Candidaalbicans100及Candidaalbicans115)的体外协同抑制作用。结果表明:他克莫司和所有5种候选抗真菌药的组合在这3株测试菌株中显示出不同程度的协同作用,尤以两性霉素B和他克莫司的组合最为明显,具体表现为两种药物组合后的FICI值最低(FICI为0.05至0.06),并且菌株之间无显著差异(见表1);其次是咪康唑,两者组合后的FICI值为0.09至0.13(见表2);他克莫司-伊曲康唑组对3株被测耐药菌的FICI值为0.25(见表3);酮康唑—他克莫司组和特比萘芬—他克莫司组的体外抗耐药真菌协同作用相对较弱:酮康唑—他克莫司组的FICI值在0.31到0.38间(见表4),特比萘芬—他克莫司组的FICI值均为0.50(见表5)。相关实验药物同他克莫司联合使用中均未发生拮抗作用。质控菌株ATCC22019生长良好,对所有受试药物的MIC值均在标准值内,故可判定该实验的检测方法准确,结果可靠。

表1 他克莫司—两性霉素B组抗耐药白念珠菌作用

表2 他克莫司—咪康唑组抗耐药白念珠菌作用

表3 他克莫司—伊曲康唑组抗耐药白念珠菌作用

表4 他克莫司—酮康唑组抗耐药白念珠菌作用
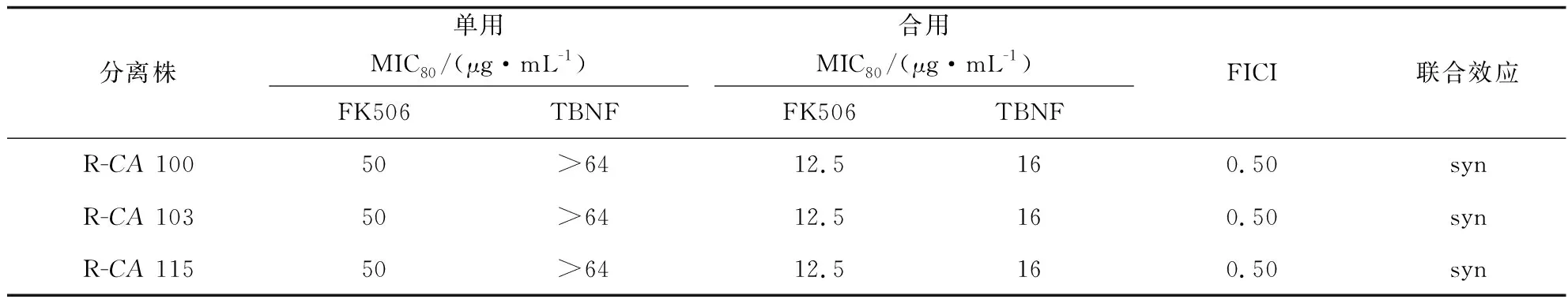
表5 他克莫司—特比萘芬组抗耐药白念珠菌作用
3 讨 论
近年来,各种因素导致抗真菌药的大量使用甚至滥用,致使真菌耐药率大幅增加。研发新的药物需要高昂的成本,而药物上市后的大量使用又进一步加剧了药物耐药的产生。因此,如果能够在常见药物中筛选一些对常用抗真菌药具有协同作用的药物,无疑是一种低成本且行之有效的方法。在前期研究中,我们观察到大环内酯类免疫抑制剂他克莫司(FK506)对氟康唑具有较好的体外抗真菌增效作用[1],故在本阶段的实验中,我们继续采用棋盘式微量液基稀释法针对他克莫司同其他几种常用抗真菌药的体外协同作用做了进一步的探究和比较,尝试筛选出协同作用相对显著的药物组合方案。研究结果显示:在备选5种药物组合中,他克莫司-两性霉素B组合表现出了最佳的体外协同抗耐药白念珠菌作用,这与Gao等[2]及Kubiça等[3]对他克莫司和两性霉素B联合后对曲霉菌属和赤霉菌属真菌的体外协同增效作用的研究结果基本一致。在后两者的研究中,他克莫司与两性霉素B组合后对白念珠菌以外的其他菌属菌株也表现出了显著的体外协同增效作用,故此我们推测,两性霉素B与他克莫司联合后,或可明显提高两性霉素B对诸多真菌菌株,甚至是对耐药菌株的抗真菌活性。此外,在我们的研究中,他克莫司分别同咪康唑、伊曲康唑及酮康唑联合使用后对受试白念珠菌也表现了一定的体外协同作用,无一药物组合表现拮抗作用。这一协同作用在Zhang等[4]对皮肤癣菌体外分离株的研究中也得到了体现。Zhang等的研究发现:他克莫司与伊曲康唑、特比萘芬及联苯苄唑组合后分别对53%、53%及63%的受试皮肤癣菌体外分离株表现了的较强的体外协同作用。
如青霉素提取自青霉菌一般,他克莫司同样是从链霉菌属中分离而来。在哺乳动物中,他克莫司、结合蛋白FKBP12及钙调神经磷酸酶可形成三元复合物,该复合物抑制活化T细胞的钙调神经磷酸酶核因子(NFAT)通路,进而阻止T细胞增殖。临床上,他克莫司的全身用药常用于预防同种异体移植器官患者的排斥反应,而局部使用则主要用于治疗白癜风、特应性皮炎等自身免疫相关性皮肤病,近年来也逐渐开始用于激素依赖性皮炎及脂溢性皮炎的治疗[5-6]。但作为免疫抑制剂的一种,他克莫司在临床上一直被视为真菌性皮肤病治疗的药物禁忌。而近些年,已有研究显示他克莫司可以局部用药促进顽固性体癣的恢复,甚至有研究者尝试将他克莫司与环孢菌素A等钙调神经磷酸酶抑制剂作为抗真菌药研发的新方向和靶点[7-8]。我们的研究结果也提示:他克莫司与多种传统抗真菌药,包括两性霉素与唑类等都存在较好的体外协同抗耐药白念珠菌作用。由于他克莫司系钙调神经磷酸酶抑制剂的一种,而钙调神经磷酸酶通路又在多项研究中被证实与真菌细胞壁的完整性及内质网应激反应等多种造成抗真菌药物耐药的因素有关,且作为与白念珠菌耐药密切相关的基因之一,RTA2基因的表达上调也在体内、外被证实与钙调神经磷酸酶通路的充分激活有关[9-10]。故此,依据他克莫司和常用抗真菌药的药理学作用,不难解释本次实验中,他克莫司与两性霉素B及其他常用抗真菌药所表现出的或强或弱的体外协同抗耐药菌株作用。鉴于他克莫司在实际应用中具有明显的免疫抑制作用,无法作为抗真菌药物直接使用,也有学者尝试使用一些细胞毒性和免疫抑制活性相对较低的他克莫司类似物,如31-O-脱甲基-FK506、9-脱氧-FK506等与抗真菌药联合使用,也观察到了类似的协同增效作用[11],故他克莫司及类似物与常用抗真菌药组合使用,尤其是两性霉素B,或可作为临床上耐药真菌病治疗的可能方案之一。但不得不提的是,目前无论是针对他克莫司还是其类似物的抗真菌增效作用研究仍多局限于体外试验,很少涉及动物实验及临床研究,故其在体内抗真菌增效作用及使用安全性尚待进一步观察。
