白念珠菌TFP1基因与钙调神经磷酸酶通路的相关性分析
2021-09-01孟玲宁刘锦燕项明洁沈瀚
孟玲宁 刘锦燕 项明洁 沈瀚
(1.南京大学医学院附属鼓楼医院检验科,南京 221000;2.上海交通大学医学院附属瑞金医院卢湾分院检验科,上海 200020;3.上海交通大学医学院附属瑞金医院检验科,上海 200025)
近年来,随着广谱抗生素、糖皮质激素、免疫抑制剂以及各种介入治疗和器官移植的广泛应用,念珠菌病的发病率逐年增高。据统计,侵袭性念珠菌感染的患者已达到250000例/年,死亡人数约为50000例/年。发病率高达2~14/1000例[1]。目前,唑类药物是治疗白念珠菌感染的首选药物,但近年来由于其广泛使用,唑类药物的耐药率越来越高[2],因此,探索出白念珠菌具体的耐药机制对确定新的抗真菌治疗目标尤为重要。
白念珠菌中离子稳态的紊乱会影响许多细胞过程,而液泡型 H+-ATPase(V-ATPase)与维持胞质中钙离子浓度稳定密切相关[3]。白念珠菌TFP1基因是V-ATPase的编码基因,研究表明TFP1在白念珠菌胞吞运输中起着至关重要的作用。此外,TFP1对液泡功能和白念珠菌的发病机制必不可少,使其成为新型抗真菌药物的潜在靶点[4]。本课题组前期实验发现,白念珠菌TFP1基因在临床氟康唑耐药的白念珠菌中高表达,而白念珠菌中的钙调神经磷酸酶通路已经证实通过转录因子Crz1p调控RTA2基因表达而介导白念珠菌耐药[5],故本次研究旨在探索TFP1基因与钙调神经磷酸酶通路的关系,为临床耐药菌株的治疗提供新思路。
1 材料与方法
1.1 菌株
本研究中使用的30株临床白念珠菌都来自南京大学附属鼓楼医院检验科。其中第1~24株为氟康唑耐药白念珠菌;第25~30株为氟康唑敏感白念珠菌。
1.2 主要试剂
酵母菌RNA抽提试剂盒Yeast RNAiso Kit(Takara),反转录试剂盒PrimeScript RT-PCR Kit(Takara),RT-PCR扩增试剂盒SYBR©Premix Ex TaqTMII(Takara)均购自于大连宝生物工程有限公司;酵母菌氨基酸营养缺陷培养基及酵母菌高效转染试剂盒(北京泛基诺公司);rTaq酶、Ex Taq酶、DNA Marker DL2000和DNA Marker DL5000(大连宝生物工程有限公司);DMT化学感受态细胞(北京全式金生物技术有限公司);UNIQ-10柱式质粒小量抽提试剂盒(生工生物工程有限公司);PCR 产物回收试剂盒(Biomiga 公司);鲱鱼精DNA[普洛麦格(北京)生物技术有限公司]。
按配方分别配制YPD培养液和YPD培养基、LB培养液、含氨苄西林的LB培养基以及酵母缺陷培养基SD-LEU2(SD培养基中不含亮氨酸)和SD-LEU2-HIS1(SD培养基中不含亮氨酸和组氨酸)。
1.3 引物
引物序列见表1,所有引物均在NCBI BLAST网站检测其特异性,并由生工生物工程有限公司进行合成。

表1 引物序列
1.4 临床菌株基因TFP1表达量检测
挑取白念珠菌工程菌SN152单克隆菌落于3 mLYPD培养液中,200 r/min、 37℃培养过夜。吸取1 mL菌液转移至1.5 mL的Ep管中,按照Yeast RNAiso Kit试剂盒进行总RNA抽提,后按照PrimeScript RT-PCR Kit试剂盒说明书配制逆转录反应体系。制备好的白念珠菌cDNA利用Takara公司SYBR©Premix Ex TaqTMII试剂盒说明书配制RT-PCR反应体系,反应的两对引物18S-F/18S-R(白念珠菌18S rRNA引物)和TFP1-F/TFP1-R见表1,反应条件为95℃预变性5 min;95℃ 5 s,60℃ 31 s,共40个循环。
1.5 菌株DNA抽提、质粒转化抽提
参照项明洁等[6]方法,挑取SN152单克隆菌株于2 mL YPD液200 r/min摇16 h,收集菌体用蒸馏水清洗1遍后,加入0.5 mL lysis buffer,37℃水浴2 h后离心弃上清,利用苯酚/氯仿/异戊醇方法对菌株进行DNA抽提。
参照王影等[7]方法进行质粒转化抽提,吸取5 μL质粒pSN52、pSN40加入到配制好的DH5α感受态细胞中,吹打混匀后低速离心数秒,置于冰上30 min;后42℃水浴热激90 s,立即置冰上放置2 min;加入37℃预热的LB培养液500 μL中,于摇床中37℃ 200 r/min培养45 min,离心2 min后弃上清300 μL,混匀Ep管中剩余液体后,均匀涂布于含卡那霉素的LB选择性平板上,37℃孵育过夜。第2天挑取平板上的单克隆菌落至含有卡那霉素的LB培养液中,37℃ 200 r/min摇床培养16 h。次日,利用UNIQ-10柱式质粒小量抽提试剂盒抽提质粒。
1.6 等位基因敲除组件构建
参照Noble等的方法[8],以SN152菌株DNA为模板、 P1和P3为引物扩增TFP1基因的上游片段up;P1’和P3’为引物扩增TFP1基因的上游片段up’;P4和P6为引物扩增TFP1基因的下游片段down;P4’和P6’为引物扩增TFP1基因的下游片段down’。以pSN40和pSN52质粒DNA为模板,P2和P5为引物分别扩增营养筛选标记片段His1和Leu2。其中P3和P3’的5’端序列与P2的5’端序列互补;P4和P4’的5’端序列与P5的5’端序列互补。PCR产物经电泳鉴定后,按照Biomiga胶回收试剂盒操作分别进行回收。
将纯化后的PCR产物up、His1、down按照融合PCR反应的体系进行配制,体系(50 μL)为0.3 μL Ex Taq酶、5 μL 10×缓冲液、4 μL dNTP、50 ng up/down片段、200 ng His1片段、0.4 μL P1、0.4 μL P6和ddH2O。反应条件为94℃ 2 min预变性; 94℃ 30 s, 52℃ 50 s, 68℃ 8 min,共30个循环;68℃ 15 min延伸。得到的融合片段up-his1-down经电泳鉴定后,利用乙醇沉淀法进行回收。同样的方法制备融合片段up’-leu2-down’。
1.7 目的基因TFP1敲除株构建
以白念珠菌SN152为亲本菌对TFP1基因先进行第一拷贝敲除,将敲除组件up-leu2-down通过醋酸锂方法转染至菌株SN152,用灭菌玻璃棒将处理过的菌体均匀涂布于SD-leu2缺陷培养基中,置于30℃孵育2 d。挑取单克隆菌株于YPD液中200 r/min摇16 h,进行菌株DNA抽提,后采用套式PCR方法鉴定TFP1基因是否成功敲除。引物P1 up和LEU left分别位于引物P1和P2的上游和下游,引物LEU right和P6 down分别位于引物P5和P6的上游和下游,用以检测同源重组片段up-leu2-down是否插入以及插入的位置是否正确。第一拷贝成功敲除后进行第二拷贝的敲除,用同样的方法将片段up’-his1-down’转染至菌株TFP1+/-。敲除后采用套式PCR 鉴定片段是否成功插入相应的位置(引物见表1)。再设计引物TPF1-F和TFP1-R鉴定目的基因TFP1是否被完全敲除。
1.8 菌株TFP1、CRZ1、RTA2表达量检测
挑取单克隆菌株SN152 1株、TFP1+/-菌株5株以及TFP1-/-菌株5株分别于YPD培养液中摇过夜,后进行DNA抽提。采用与1.4中相同的方法检测各菌株中TFP1、CRZ1以及RTA2基因的表达量,四对引物见表1。
2 结 果
2.1 临床菌株基因TFP1表达量检测
为了增加结果的可靠性,我们对同一份标本同时检测3次,计算他们的均值为最终目的基因的Ct值。以氟康唑敏感的菌株△Ct均值为校准值1,计算得到各临床菌株TFP1基因的相对表达量,结果如图1所示,在24株临床氟康唑耐药或剂量-敏感依赖型菌株中有9株表现为TFP1基因高表达(2倍或者以上)。

图1 30株临床白念珠菌菌株TFP1相对表达量
2.2 等位基因敲除组件构建
白念珠菌TFP1基因第1条同源重组基因敲除组件由up(424 bp)、leu2 (2307 bp)和down (460 bp)片段构成;第1条同源重组基因敲除组件由up’(449 bp)、his1 (2388 bp)和down’(450 bp)片段构成,由电泳结果图2a和2b可以看出各基因片段大小和位置均正确。融合PCR的电泳结果(图2c)显示,第一拷贝敲除组件up-leu2-down和第二拷贝敲除组件up’-his1-down’片段的大小和位置均正确。
2.3 目的基因TFP1敲除株构建
鉴定第一拷贝敲除株时,两对引物P1 up和LEU left、LEU right和P6 down分别位于筛选标记Leu2的上下游,长度分别为1187 bp和1217 bp,电泳结果如图3a所示,条带大小与位置均正确,TFP1基因第一拷贝敲除成功。鉴定双拷贝敲除株时,两对引物P1’ up和HIS left、HIS right和P6’ down分别扩增出筛选标记His1的上下游,长度分别为769 bp和1007 bp,电泳结果如图3b所示,条带大小与位置均正确。同时引物TFP1-F和TFP1-R未能扩增出TFP1基因片段,证明双拷贝敲除成功。
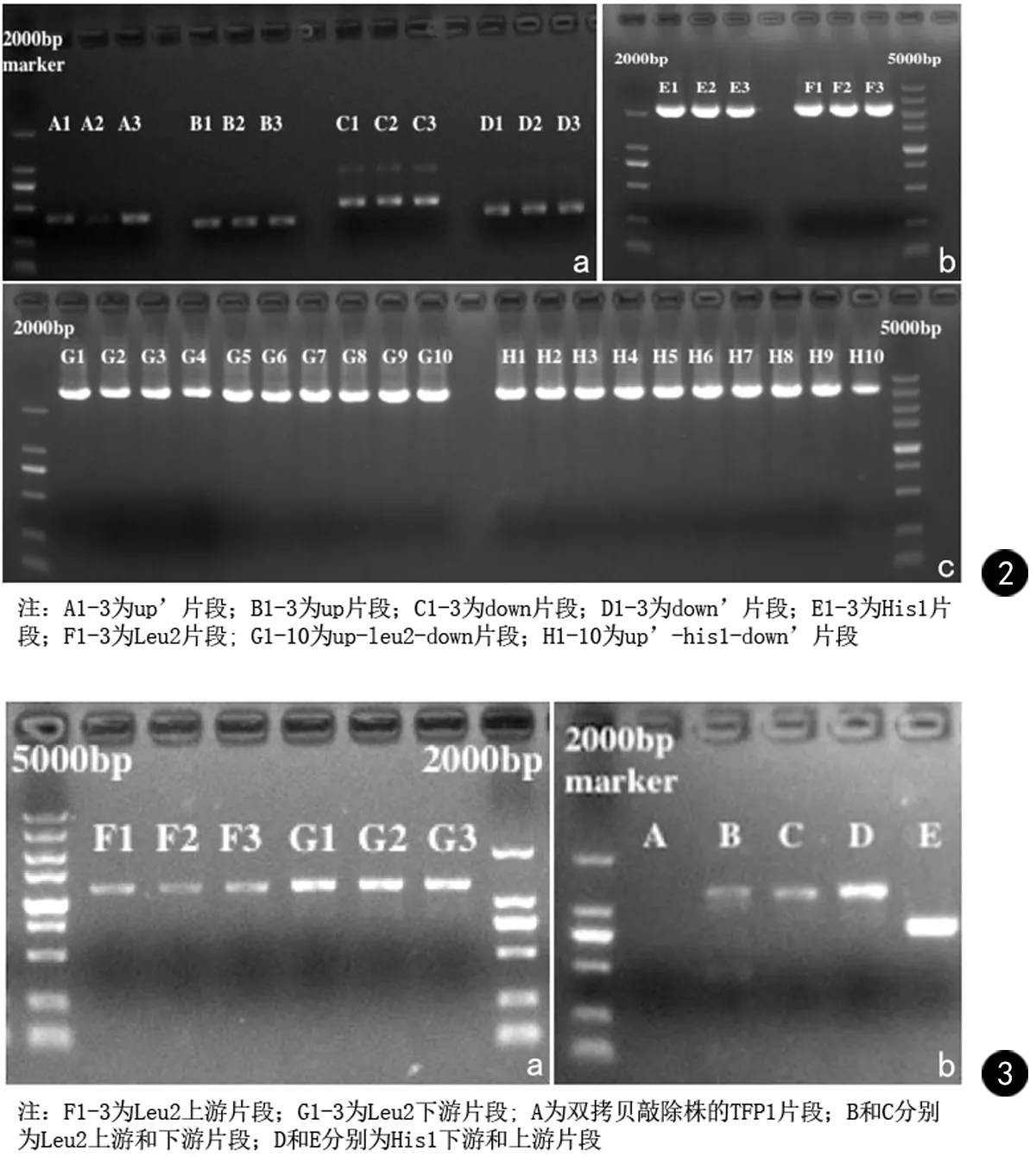
图2 PCR产物电泳结果 图3 敲除株鉴定电泳结果
2.4 菌株TFP1、CRZ1、RTA2表达量检测
利用实时荧光定量PCR实验方法测定白念珠菌SN152 1株、TFP1+/-菌株5株以及TFP1-/-菌株5株中基因TFP1、CRZ1和RTA2的表达水平。先将白念珠菌总mRNA反转录合成cDNA,再利用实时荧光定量PCR检测各目的基因的表达水平。我们以白念珠菌18S rRNA 为内参基因,检测反应过程中各基因扩增的Ct值,用相对定量方式计算TFP1、CRZ1和RTA2的△Ct(△Ct=CtTFP1/CRZ1/RTA2-Ct18S),各敲除菌株TFP1、CRZ1和RTA2表达量相对于白念珠菌工程菌SN152表达量均值的倍数即为2(△△Ct=△Ct-△CtSN152)。结果如表2所示,当白念珠菌SN152第1条等位基因TFP1敲除后,CRZ1和RTA2的表达量几乎没有变化;当白念珠菌两条等位基因均敲除后,CRZ1的表达量下降了约40%,RTA2的表达量下降了约60%。

表2 白念珠菌TFP1、CRZ1和RTA2相对表达量
3 讨 论
离子稳态对维持白念珠菌的生长代谢极为重要,离子稳态的失调会影响细胞过程的各个方面,其中液泡型H+-ATPase(V-ATPase)对于维持离子稳态至关重要,而TFP1是V-ATPase亚基蛋白的编码基因[4]。有研究发现,白念珠菌TFP1-/-细胞对抗真菌药物高度敏感,并且会影响胞质中钙离子的水平[9]。为了探究临床白念珠菌菌株TFP1基因的表达量,我们采用实时荧光定量PCR方法对TFP1基因进行半定量检测,结果显示在24株氟康唑耐药白念珠菌中,有9株表现为TFP1基因过表达,而其余菌株TFP1基因表达量相对于敏感菌株均没有2倍以上程度的增加,我们猜测其余菌株的耐药机制可能与钙离子水平变化的关系较小。
白念珠菌中与钙离子代谢相关的一条重要通路为钙调神经磷酸酶通路CaN,已有文献证实,CaN通路中调节白念珠菌对唑类药物耐药性产生的靶基因为RTA2基因,而RTA2基因是CaN通路转录因子Crz1p调控的靶基因[10]。本次研究发现,当白念珠菌敲除一条等位基因TFP1时,CRZ1和RTA2的表达量分别为1.07±0.06和1.01±0.04,与亲本株的表达量几乎没有变化;当白念珠菌敲除全部两条TFP1基因后,CRZ1和RTA2的表达量相较于亲本株出现了下降,分别为0.60±0.04和0.38±0.04,所以我们猜测TFP1基因与CRZ1、RTA2基因的表达呈正相关,而TFP1基因过表达的耐药白念珠菌可能是依赖钙调神经磷酸通路的方式参与了耐药性的形成,但其中具体机制尚未明确,还需进一步研究。
