基于网络药理学探讨“黄芪-茯苓-五味子”组方治疗糖尿病肾病的作用机制
2021-09-01滕海英欧余航肖建平
滕海英,欧余航,肖建平
(1.福建中医药大学附属康复医院,福建 福州350003;2.福建中医药大学附属第三人民医院,福建 福州350108)
糖尿病肾病(diabetic nephropathy,DN),约占糖尿病患者的40%,是糖尿病常见的慢性并发症之一,可致肾功能不可逆的损伤,是终末期肾病(ESRD)的主要病因[1]。现代中医认为:糖尿病肾病与“肾消”“消肾”“下消”密切相关,且归经定位以肾为主,病机以“本虚”为主,治疗以补气药为主,利水渗湿药、收敛固涩药等为佐[2]。“黄芪-茯苓-五味子”组方(HFW)作为中医常见治疗糖尿病肾病的组合,其中黄芪补中益气,茯苓渗湿健脾,五味子收敛固涩,补肾止遗,兼可补肾气。马居里教授[3]治疗糖尿病肾病的经验方中,用HFW以益气固表,健脾益肾,祛风散邪。王静[2]在探讨糖尿病肾病的古籍文献用药规律后发现:在录入的203首方剂中,黄芪、茯苓、五味子的使用频次最高。HFW能够有效降低糖尿病肾病患者的尿蛋白和相关炎症因子[4],但其具体的作用机制尚不明确。本研究利用网络药理学探讨HFW治疗糖尿病肾病的作用机制,为糖尿病肾病的中医临床治疗和实验研究提供方向和理论支持。
1 方 法
1.1 HFW的活性成分筛选 以“黄芪”“茯苓”“五味子”作为检索词在TCMSP数据库[5](https://tcmspw.com/tcmsp.php)检索,获得这3味药的化学成分信息,按照生物利用度(OB)≥30%且类药性(DL)≥0.18为筛选条件[6],筛选出HFW的活性成分。
1.2 HFW的作用靶点筛选 采用TCMSP数据库[5]检索获得黄芪、茯苓、五味子中活性成分对应的作用靶点,并查询UniProt数据库[7](https://www.uniprot.org)对获得的作用靶点进行基因名转换。
1.3 糖尿病肾病的作用靶点筛选 以“diabetic nephropathy”“diabetic kidney disease”作为检索词在DisGeNET数据库[8](https://www.disgenet.org/)和GeneCards数据库[9](https://www.genecards.org/)检索出糖尿病肾病作用靶点。将DisGeNET数据库中相关性得分(Score)≥0.2[10]和GeneCards数据库中Score≥20[11]的基因整理汇总,获得糖尿病肾病的作用靶点。
1.4 构建HFW活性成分-糖尿病肾病共同靶点网络 将HFW活性成分作用靶点和糖尿病肾病作用靶点导入Venny 2.1.0软件(https://bioinfogp.cnb.csic.es/tools/venny),获得HFW和糖尿病肾病的共同靶点;通过Cytoscape 3.8.0软件进行可视化分析,构建“HFW活性成分-糖尿病肾病共同靶点”关系网络。
1.5 构建蛋白互作关系网络(PPI)网络 将获得的共同靶点导入String 11.0数据库[12](https://stringdb.org/),设定物种为“Homo sapiens”,其他参数选择默认参数,构建HFW治疗糖尿病肾病共同靶点的PPI网络,以分析共同靶点之间的相互作用关系。
1.6 GO和KEGG富集分析 通过DAVID 6.8数据库[13](https://david.ncifcrf.gov)在线将共同靶点进行基因ID转换,利用R语言3.6.1软件和Bioconductor数据库的org.Hs.eg.db包和clusterProfiler包[14]对共同靶点进行生物学过程(BP)、细胞成分(CC)及分子功能(MF)的GO注释分析和KEGG通路富集分析,以校正后P值<0.05为条件进行筛选,以分析HFW治疗糖尿病肾病潜在作用靶点可能参与的生物学过程和信号通路。
2 结 果
2.1 HFW的作用靶点 利用TCMSP数据库对HFW化学成分进行筛选,根据设定的DL、OB参数,筛选出43个活性成分,其中黄芪20个,茯苓15个,五味子8个,剔除重复项,获得42个活性成分。通过TCMSP数据库检索获得HFW的活性成分对应的作用靶点,进行基因名转换后,剔除重复项,获得185个活性成分作用靶点。
2.2 糖尿病肾病的作用靶点 通过检索DisGeNET和GeneCards数据库,根据设定的Score参数,检索出糖尿病肾病的作用靶点分别为153个和225个,剔除重复项后,获得糖尿病肾病的作用靶点334个。
2.3 活性成分-共同靶点网络的构建 将筛选得到的334个糖尿病肾病作用靶点与185个HFW活性成分作用靶点取交集,获得48个共同靶点。48个共同靶点基因对应的HFW活性成分有17个,见表1。由此推测HFW的17个活性成分通过这48个共同靶点治疗糖尿病肾病。将17个活性成分和48个共同靶点导入Cytoscape3.8.0软件,构建“HFW活性成分-糖尿病肾病共同靶点”可视化网络,见图1。

表1 HFW的活性成分
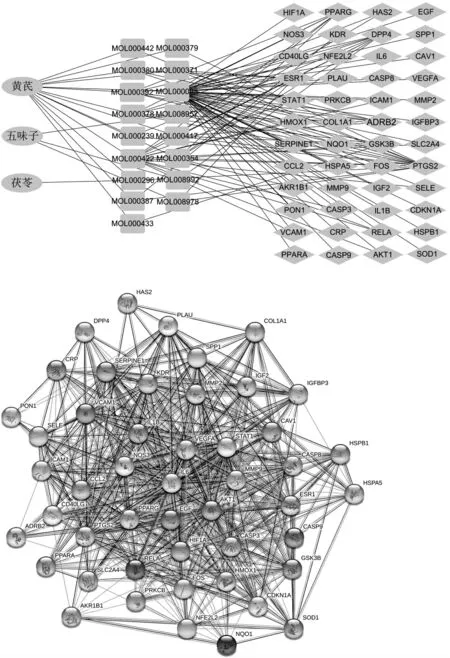
图1 “HFW活性成分-糖尿病肾病共同靶点”可视化网络图
2.4 PPI网络的构建 通过String数据库在线构建的HFW治疗糖尿病肾病共同靶点的PPI网络,包含48个节点和584条边,见图2。结果发现:在48个共同靶点中自由度(degree)值排名前10位分别是AKT1、IL6、VEGFA、CASP3、PTGS2、MMP9、EGF、NOS3、CCL2、IL1B,其中自由度值最高的是AKT1,自由度值为45,其次是IL6,自由度值为44。提示这些靶点在PPI网络中占有重要地位,是HFW治疗糖尿病肾病的关键靶点。

图2 共同靶点的PPI网络图
2.5 GO富集分析 GO功能富集分析共涉及1 324个BP、19种CC、78个MF,根据富集基因数目,选择排名前10位的功能注释信息,并绘制柱状图,见图3。结果显示:HFW治疗糖尿病肾病可能与营养水平反应、氧水平反应、抗氧化应激反应等BP有关;CC涉及到膜筏、膜微结构域、膜区域等多细胞成分;MF涉及到细胞因子受体结合、泛素样蛋白连接酶结合、整合素结合等。
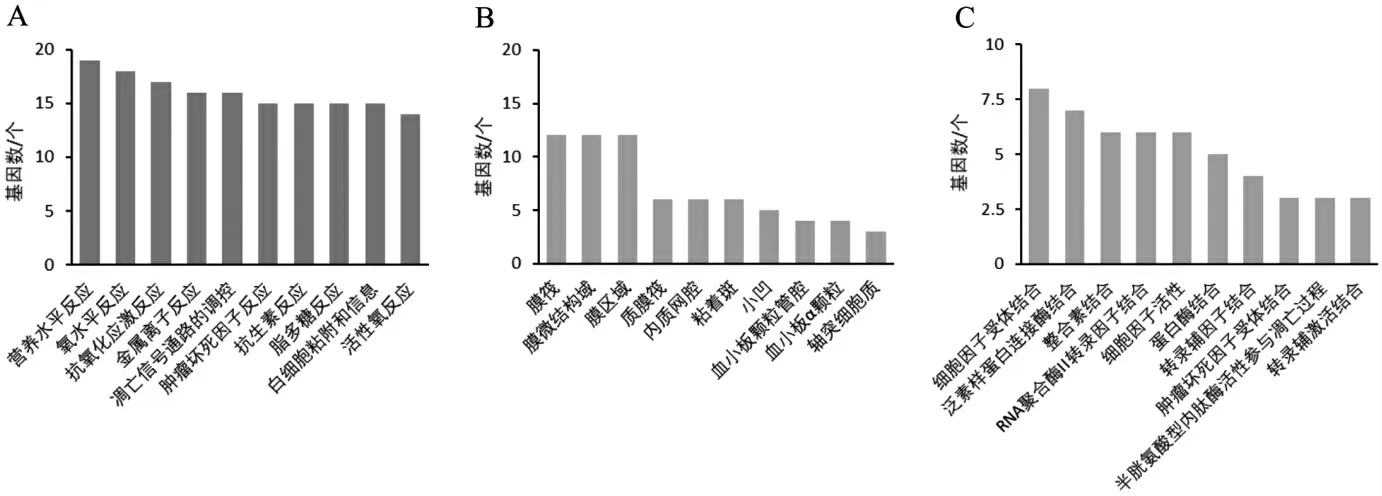
图3 共同靶点的GO富集分析图
2.6 KEGG通路富集分析 KEGG通路富集分析共获得105条富集通路,列出富集基因最多的前10条信号通路,见表2。KEGG富集的信号通路主要包括AGE-RAGE信号通路、液体剪切应力和动脉粥样硬化、卡波西肉瘤相关疱疹病毒感染、癌症蛋白聚糖、TNF信号通路等。

表2 KEGG通路富集分析中富集基因最多的前10名富集通路
3 讨 论
糖尿病肾病主要病因是继发于糖尿病,其自然病史包括肾小球超滤、进行性白蛋白尿、GFR下降以及最终出现的ESRD[1],炎症反应、免疫反应和氧化应激在糖尿病肾病的发生和发展中起着核心作用[15]。目前研究认为:与糖尿病肾病中炎症反应机制密切相关的因子包括转录因子、促炎细胞因子、趋化因子[16]。机体在糖尿病特殊环境下,免疫细胞、细胞因子以及自身抗体等免疫因素相互影响,造成肾功能的损害[17]。氧化应激可改变肾脏血流动力学,损伤肾小球内皮细胞,导致基质在系膜细胞外沉积及增厚肾小球基底膜[18]。本研究通过对HFW活性成分与糖尿病肾病的共同靶点进行PPI网络和富集分析,发现HFW治疗糖尿病肾病主要与炎症反应、免疫反应和氧化应激相关,同时还和细胞增殖与凋亡的过程有关。
本研究通过构建“HFW活性成分-糖尿病肾病共同靶点”关系网络,显示HFW通过17种化合物靶向48个共同靶点。其中,作用较多靶点的活性成分有槲皮素、山奈酚、异鼠李素、毛蕊异黄酮、芒柄花黄素,这些化合物可能是HFW治疗糖尿病肾病的关键药物。
近年来,槲皮素和山奈酚作为治疗糖尿病肾病的药物已引起了广泛关注。研究发现:糖尿病肾病C57BL/6J模型小鼠口服低剂量槲皮素治疗显示出抗氧化、抗凋亡和肾保护作用[19],另有研究发现槲皮素可通过激活Hippo途径抑制高糖诱导的小鼠肾小球系膜细胞的增殖[20];山奈酚可通过增加GLP-1、胰岛素的释放和抑制RhoA/Rho激酶来改善糖尿病引起的肾脏损伤和纤维化[21];异鼠李素抑制NFκB信号传导活性,降低炎症介质的产生和减轻氧化应激反应,起到对糖尿病大鼠的肾脏保护作用[22];毛蕊异黄酮通过体内和体外NF-κB途径改善糖尿病诱导的肾脏炎症[23];芒柄花黄素可增加SIRT1在2型糖尿病大鼠肾组织中的表达而减轻肾脏损害[24]。
HFW治疗糖尿病肾病的共同靶点主要富集在AGE-RAGE、TNF、HIF-1、IL-17、VEGF等信号通路和液体剪切应力和动脉粥样硬化、卡波西肉瘤相关疱疹病毒感染、癌症蛋白聚糖上。AGE-RAGE信号通路在糖尿病并发症中发挥着重要的作用,也是糖尿病肾病发生发展的重要一环[25]。有研究认为:AGE受体和RAGE受体与其配体的结合在肾脏组织中引起氧化应激和慢性炎症反应将导致肾功能丧失,可通过阻断AGE-RAGE信号通路改善糖尿病肾病进展[26]。KEGG分析结果显示富集在AGE-RAGE信号通路上的AKT1、IL6、VEGFA、CASP3、NOS3、CCL2、IL1B在PPI网络中有较高的自由度值,可见这些靶点是HFW治疗糖尿病肾病的关键靶点。其中AKT1参与多种生物学过程,其过度激活可影响葡萄糖体内 稳 定[27],也 可 发 挥 抗 凋 亡 及 抗 氧 化 应 激 作 用[28];NOS3可能会造成一氧化氮合成的异常,影响糖尿病 肾 病 的 进 程[29];IL6、VEGFA、CASP3、CCL2、IL1B均为参与指导或者介导炎症反应和免疫反应的潜在核心靶点[30-33]。TNF信号通路在炎症反应、细胞增殖和细胞死亡中具有至关重要的作用,TNF受体诱导NF-κB信号传导异常导致慢性炎症,从而促使糖尿病肾损伤的发生[34]。HIF-1作为氧稳态的主要调节剂,主要参与循环系统疾病的缺氧代偿反应、免疫反应、新生血管的生成与调节等[35],HIF-1信号通路上的关键靶点HIF-1α可介导与肾间质细胞纤维化有关的多种细胞因子的表达。研究表明可通过抑制HIF-1α的表达,进而抑制高糖培养的大鼠肾小球系膜细胞的炎症和纤维化[36]。IL-17信号通路被认为与多种免疫疾病和慢性炎症有关[37],研究发现IL-17A可抑制信号转导和转录激活剂的磷酸化,可有效治疗、预防和逆转糖尿病遗传模型中已建立的肾病[38]。血管生成的过度和不足都与糖尿病并发症的进展有关,VEGF是参与新血管形成的关键介质。研究表明通过抑制VEGF信号传导可降低肾脏的脂毒性,使足细胞对胰岛素信号传导重新敏感,抑制糖尿病肾病的发展,并预防肾功能不全[39]。这些信号通路在糖尿病肾病的发生发展中均占有重要的位置。本研究KEGG富集分析结果表明HFW可能通过介导炎症反应、免疫反应、氧化应激、细胞增殖和细胞死亡,从而起到治疗糖尿病肾病作用。
综上所述,本研究采用网络药理学方法探讨HFW治疗糖尿病肾病的潜在作用机制,结果表明:HFW发挥糖尿病肾病的治疗作用可能通过介导炎症反应、免疫反应、氧化应激、细胞增殖和细胞凋亡。本研究为进一步研究HFW治疗糖尿病肾病提供临床和实验的参考依据,但不足之处是未考虑中药的提取方法、剂型剂量等因素的影响。
