深层温压条件下有机酸热稳定性模拟研究
——以乙酸和乙二酸为例
2021-08-31李靖李源遽李朋朋周世新陈克非张臣孙泽祥
李靖,李源遽,李朋朋,4,周世新,陈克非,4,张臣,4,孙泽祥,4
1.中国科学院西北生态环境资源研究院,兰州 730000
2.甘肃省油气资源研究重点实验室,兰州 730000
3.北京大学深圳研究院,广东深圳 518000
4.中国科学院大学,北京 100049
0 引言
随着经济的迅速发展,我国油气资源的需求量日益增大,而原油产量增长缓慢。近五年我国原油年产量保持在2亿吨左右,但原油的消费量逐年增加,2019年我国原油对外依存度已超过70%[1]。从国家能源安全的角度出发,同时考虑浅层油气可采资源量日渐殆尽且抽采率低的现状,迫切需要面向深层—超深层寻找油气资源;而超深井钻井及超高温钻井液技术等工程技术的突破为向深层—超深层进行油气资源勘探提供了条件[2]。
深层是一个比较笼统的概念,由于不同含油气盆地地温梯度、储层孔渗特征、勘探目的层系不同,对深层的定义也不相同[3⁃5]。目前国际上相对认可的深层标准是其埋深大于等于4 500 m[2];我国国土资源部发布的《石油天然气储量计算规范》将埋深为3 500~4 500 m的地层定义为深层,埋深大于4 500 m的地层定义为超深层[6]。
一般认为,随着埋深的增加,上覆岩层压实作用和胶结作用增大,孔隙度和渗透率逐渐减小。然而,钻井岩芯镜下观测、地震资料解释等显示,在深层—超深层(埋深大于3 500 m)部分层段仍存在异常高孔隙度发育区,这与次生孔隙的大量发育密切相关[7⁃8]。深层、超深层的异常高孔隙度发育区为油气成藏提供了条件,因此研究深层条件下储集层次生孔隙的形成机制对深层—超深层油气的勘探有着重要的意义[2,7⁃8]。前人研究表明,表生淋滤、热循环对流和有机酸溶蚀作用均可在储集层中形成一定规模的次生孔隙[9]。其中,有机酸溶蚀作用是储集层中次生孔隙形成的重要机制,这与国内外许多盆地和地区(例如美国加利福尼亚州圣华金河谷地区、德克萨斯州科珀斯克里斯蒂地区和帕洛杜罗盆地、路易斯安那州西南部地区,我国塔里木盆地、柴达木盆地、渤海湾盆地)油田水中检测到高浓度的有机酸的事实相吻合[7,10⁃11]。沉积盆地的水溶液中的有机酸种类非常丰富,包括一元和二元羧酸、氨基酸、苯酚、甲酚等,其中分布广泛且浓度相对较高的一元和二元羧酸分别是乙酸和乙二酸[12]。关于有机酸的成因[13⁃15]、有机酸溶蚀矿物种类及效果[16⁃17],前人进行了大量的实验研究,取得了诸多研究成果和认识。但对于深层、超深层中,由于埋深增加导致的温度、压力升高的情况下有机酸的热稳定性及其影响因素,以往研究仍相对薄弱且存在一定争议。
模拟实验研究显示,在温度高达350℃时,有机酸 仍 可 稳 定 存 在[18⁃21]。McCollomet al.[18]分 析 了 不 同条件下乙酸的分解速率,发现即使在有强氧化剂(赤铁矿)存在的情况下,乙酸的分解速率依然很低,因此不少学者认为在没有较强的催化剂存在的地层中乙酸能保存相对较长的时间(大于五十亿年)[18,22⁃23]。但部分沉积盆地的地质资料显示只有在80℃~140℃地层水中的有机酸才具有较高的浓度,当温度达到250℃时有机酸的浓度很低[24⁃27]。造成实际地质资料与室内实验结果差异的原因可能是实际地质环境中除温度外流体压力、pH值、有机酸与矿物的反应等因素也会对有机酸热稳定性产生影响。早期的研究者认为流体pH值越低,有机酸的分解速率越高[22⁃23],而McCollomet al.[18]则认为高pH值不一定会抑制乙酸的分解。此外,研究者对深层、超深层中高流体压力和静岩压力对有机酸热稳定性的影响关注度较低。
鉴于此,本文以油田水中具有代表性的一元和二元有机酸(乙酸和乙二酸)为例,通过模拟实验,对两者在深层高温高压条件的热稳定性及其影响因素进行了分析,以期为深层—超深层储集岩中有机酸赋存形式以及次生孔隙发育特征研究提供借鉴。
1 样品与方法
1.1 实验样品
本次研究选择的有机酸样品为浓度为36%的乙酸(醋酸)试剂和乙二酸(草酸)固体颗粒,为配比得到不同pH值且具有相近有机酸根离子浓度的实验溶液,研究中还使用了乙酸钠(醋酸钠)固体颗粒。乙酸试剂、乙二酸和乙酸钠固体颗粒的纯度级别均为分析纯。在进行实验前,利用煮沸处理的去离子水对乙酸、乙酸钠和乙二酸进行配比,得到不同的实验初始溶液,实验初始溶液的pH值和有机酸根离子浓度见表1。实际地层中,有机酸对矿物的溶蚀作用会使pH值等流体特征发生改变,进而可能会对有机酸的热稳定性产生影响。对于碎屑岩储层来说,长石类矿物是最易与有机酸发生反应的矿物之一[25]。为探讨可溶蚀矿物对有机酸热稳定性的影响,同时考虑覆压实验矿物颗粒的支撑性,本次研究选择了钾长石矿物作为对比实验的研究对象。实验所使用的钾长石矿物采集于中国甘肃北山地区的花岗伟晶岩。在去除花岗伟晶岩表面风化层后,初步破碎,筛选出钾长石颗粒,然后磨碎、筛分出1 mm左右的颗粒作为后续实验的反应物,其化学组成见表2。
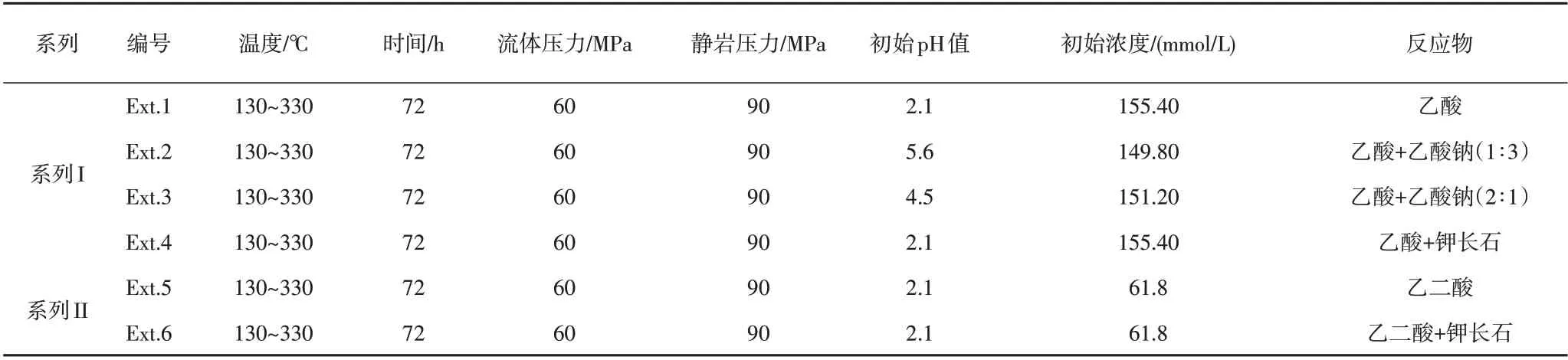
表1 模拟实验的模拟条件Table 1 Simulated conditions for the experiments

表2 钾长石化学成分Table 2 Chemical compositions of K⁃feldspar
1.2 实验方法
本次研究利用WYMN⁃3型高温高压水—岩模拟仪进行模拟实验。该装置模拟环境为半开放系统;实验中由流体压力泵模拟流体压力,由机械压力系统模拟静岩压力。实验装置结构图和实验原理参见文献[28]。基于静水压力梯度10 MPa/km、上地壳平均密度2.67 g/cm3、平均地温梯度25℃/km、地表平均气温15℃等参数,按照国土资源部的定义,深层(埋深3 500~4 500 m)的流体压力、静岩压力、地层温度条件约为35~45 MPa、93.45~120 MPa、102.5℃~127.5℃;超深层(埋深大于4 500 m)的流体压力、静岩压力、地层温度条件约为>45 MPa、>120 MPa、>127.5℃。前人关于有机酸热稳定性的研究多关注温度的影响[18,22⁃23],对流体压力、静岩压力的影响关注度较低。Liet al.[28]分析了流体压力和静岩压力均为45 MPa条件下乙酸的热稳定性,但其静岩压力低于深层条件;王慧媛等[29]分析了覆载压力为143.4~1153 MPa时乙二酸的热稳定性,但该研究中并未分析溶液pH值、可溶蚀矿物等对乙二酸热稳定性的影响。因此,参照深层、超深层的温压条件,同时考虑支撑物的抗压能力,本次研究选取的实验温度为130℃~330℃,实验流体压力为60 MPa,实验静岩压力为90 MPa(表1)。本次研究共设计了两个系列六组实验(系列I包括Ext.1、Ext.2、Ext.3、Ext.4,系列II包括Ext.5、Ext.6),每组实验包含130℃、180℃、230℃、280℃、330℃五个温度点,每个温度点模拟实验独立进行,模拟时间为72 h。实验结束后分别收集气体产物和实验流体,并对气体产物组分和流体中离子浓度进行测定。在Ext.1、Ext.2、Ext.3和Ext.5实验中,样品仓中装入多孔滤片作为支撑物;在Ext.4和Ext.6实验中,样品仓中支撑物为钾长石颗粒。实验开始前,利用氮气吹扫装置对样品仓中的空气进行排除并抽真空,后注入实验溶液开始实验。实验的升温速率、模拟温度、流体压力、静岩压力、模拟时间等由仪器配套软件自动控制。
实验收集的气体产物采用美国安捷伦公司制造的型号为6890N的气相色谱仪进行测定,所采用的色谱柱为HP⁃PLOT⁃Q。模拟仪剩余流体中的离子浓度采用美国戴安公司制造的ICS3000型离子色谱仪进行测定。离子色谱仪的测试精度为0.1 mg/L,采用的色谱柱为Dionex As19⁃Ag19离子交换色谱柱。
2 实验结果
对于系列I,当温度低于180℃时∑乙酸浓度(乙酸和乙酸根的浓度总和)变化微弱,分解产物CO2和CH4的浓度几乎为0(图1)。当温度从180℃上升到230℃,∑乙酸浓度略微下降,CO2和CH4浓度缓慢上升。对于系列I的Ext.1、Ext.2、Ext.3、Ext.4而言,当温度小于230℃时∑乙酸浓度、CO2和CH4浓度变化幅度均非常小。当温度高于230℃,∑乙酸浓度迅速下降,且随着温度继续增加∑乙酸浓度降幅增大,相应乙酸分解的产物CO2和CH4浓度呈现升高的变化趋势,这表明在该温度区间乙酸迅速地发生分解反应。对于系列I的Ext.1、Ext.2、Ext.3、Ext.4而言,∑乙酸浓度降低幅度呈Ext.2>Ext.4>Ext.3>Ext.1,CO2和CH4浓度升高幅度也显示出相同的变化规律。上述实验现象表明温度、pH值、钾长石对乙酸的热稳定性均有影响。

图1 实验系列I中乙酸与乙酸盐总浓度(a)和气体产物浓度(b)特征(∑乙酸:乙酸和乙酸根的浓度总和)Fig.1 Concentrations of acetate acid in series I experiments(∑acetic acid:total concentration of acetic acid and acetate):(a)acetate;and(b)gas products
系列II不同温度条件下剩余流体离子浓度如图2所示。∑乙二酸浓度(乙二酸和乙二酸盐的浓度总和)随着温度变化呈现减小趋势,但不同时间段降幅不同,其中温度在180℃~230℃之间降幅最快,在130℃~180℃和230℃~330℃范围内降幅较慢。当温度低于180℃,乙二酸的分解速率较低,仅有不到10%的乙二酸发生了分解;180℃~230℃时,乙二酸的浓度明显降低,50%~60%的乙二酸发生了分解;当温度高于230℃时乙二酸浓度降幅再次变慢,可能归因于反应体系中剩余反应物浓度低(小于初始浓度的20%)。当温度高于180℃,乙二酸发生了大规模的分解反应,这与文献[30]报道乙二酸发生分解反应的温度一致。
在测试温度的范围内,加入钾长石实验Ext.6的∑乙二酸浓度始终低于不加钾长石的相同条件实验Ext.5(图2),这表明Ext.6中乙二酸的分解速率更快,钾长石的存在加速了乙二酸的分解。
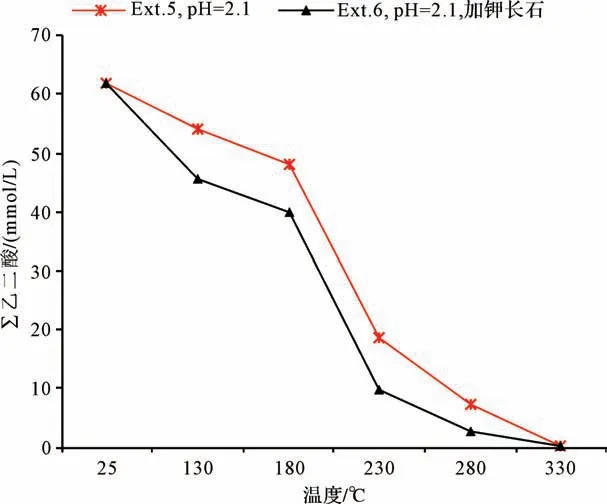
图2 实验系列II中乙二酸和乙二酸盐总浓度特征(∑乙二酸:乙二酸与乙二酸盐总浓度)Fig.2 Concentrations of oxalic acid and oxalate in series II experiments(∑oxalic acid:total concentration of oxalic acid and oxalate)
3 有机酸热稳定性评价及影响因素分析
3.1 有机酸分解反应的动力学参数
3.1.1 反应速率
前人研究证实,有机酸的分解过程可以用一阶函数表示[18],即:

式中:k为有机酸分解反应的反应速率常数,无量纲;t为反应时间,s;m为有机酸浓度,mmol/L。
对公式(1)进行积分可得公式(2):

式中:m0为有机酸初始浓度,mmol/L;mt为t时刻的有机酸浓度,mmol/L。
因此,利用有机酸浓度变化与时间的关系,可计算有机酸分解反应的反应速率k。
在高温高压模拟过程中,乙酸的分解途径有两种:脱羧反应(CH3COOH→CO2+CH4)和氧化反应(CH3COOH+2H2O→2CO2+4H4)[28]。由于氧化反应不生成CH4,利用实验产物中CH4和CO2的浓度,可分别计算脱羧反应的反应速率常数kdecar和氧化反应的反应速率常数koxi。实验产物CH4和CO2的浓度与乙酸初始浓度、时间和反应速率的关系如公式(3)和(4):
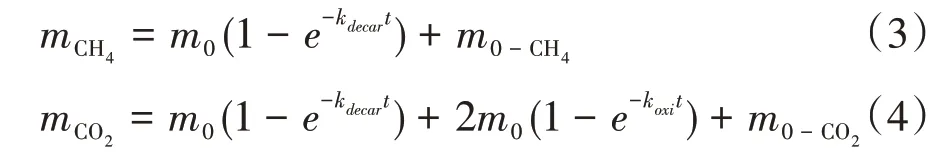
式中:mCH4为t时刻CH4的浓度,mmol/L;mCO2表示t时刻CO2的浓度,mmol/L;m0-CH4为CH4的初始浓度,mmol/L;m0-CO2为CO2的初始浓度,mmol/L。
由于在模拟实验前,采用煮沸的去离子水稀释乙酸和乙二酸,可以认为此时体系中没有CH4和CO2,故假定t=0时,m0-CH4和m0-CO2为0。因此,利用有机酸、CH4和CO2浓度与时间的关系,可计算脱羧反应和氧化反应的反应速率常数。
乙酸分解反应的反应速率常数k、脱羧反应的反应速率常数kdecar、氧化反应的反应速率常数koxi与温度的关系如图3所示。对于每组实验而言,随着温度的增加,k和kdecar先缓慢增加(温度小于230℃)后迅速增加,而koxi呈先增大后减小的趋势,在280℃达到最大值。这表明随着温度增加,乙酸分解反应和脱羧反应更加剧烈,而氧化反应则在280℃时最剧烈。
在乙酸的模拟实验中,当温度低于230℃时,分解反应总速率、脱羧反应速率和氧化反应速率均较小,可能是因为未达到脱羧作用和氧化作用的起始温度,乙酸进行分解反应非常困难或非常缓慢。当温度高于230℃,在相同的温度条件下,具有更高初始pH值模拟实验的反应速率更高(初始pH值Ext.2>Ext.3>Ext.1,反应速率呈相同序列降低)。而在相同初始pH值的条件下,加入钾长石的模拟实验Ext.4的分解速率明显高于纯乙酸溶解模拟实验Ext.1。
乙二酸分解反应的总反应速率可由公式(2)计算获得,其与温度的关系如图4。乙二酸的分解速率同样随着温度的增加而显著增加,表明温度越高乙二酸分解反应越剧烈。在所测试温度范围内,加入钾长石模拟实验Ext.6的反应速率明显高于无钾长石模拟实验Ext.5,表明实验体系中钾长石的存在可加快乙二酸的分解。
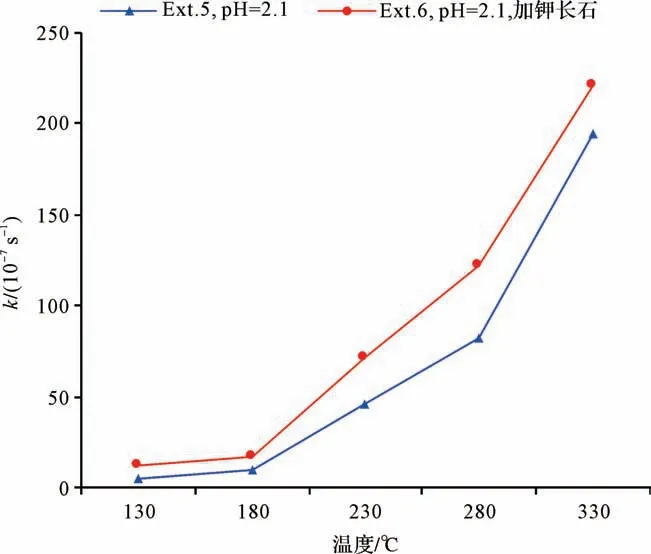
图4 实验系列II中乙二酸分解反应速率(k)与温度的关系Fig.4 Series II experiments:relationship between temperature and determined rate constant k
乙二酸的分解反应的反应速率常数明显高于乙酸,尤其在温度高于180℃时,两者差距可达2~3个数量级(图3,4)。上述现象表明乙二酸的热稳定性相对较差,更容易分解,这和油田水中观测到的现象(乙酸的浓度明显高于乙二酸)相吻合。
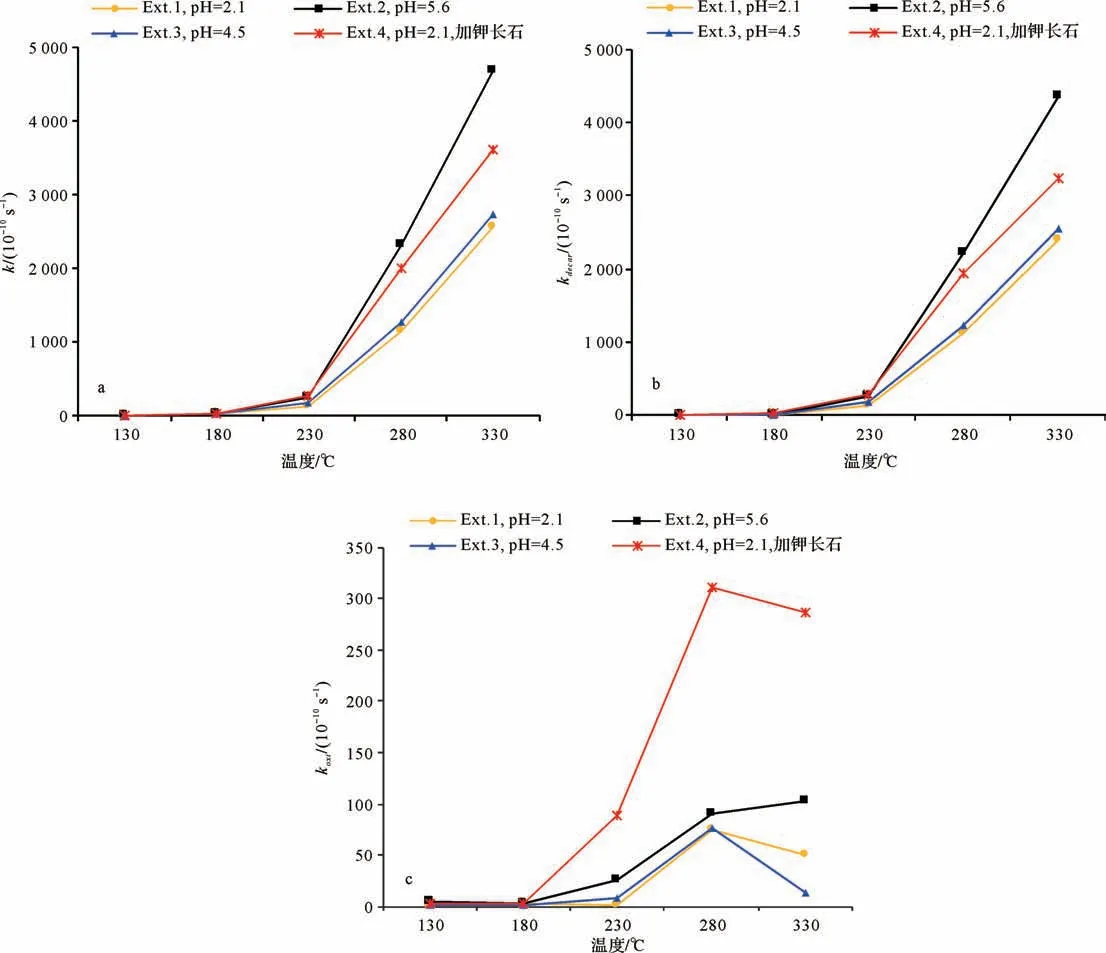
图3 实验系列I中分解反应速率k(a)、脱羧反应速率kdecar(b)、氧化反应速率koxi(c)与温度关系Fig.3 Series I experiments:relationships between temperature and(a)determined rate constant k;(b)decarboxylation rate constants kdecar;and(c)oxidation rate constants koxi
3.1.2 活化能
基于实验温度和反应速率常数等参数,利用阿伦尼乌斯公式(5)可计算反应进行的活化能。

式中:A为指前因子,s-1;Ea为活化能,表征反应进行的难易程度,J/mol;T为绝对温度,K;R为摩尔气体常数,8.314 J/K·mol。
对公式(5)两边同时进行对数运算,可得公式(6):

对lnk和1/T进行线性拟合(图5)后,拟合直线的截距为lnA,直线的斜率为−Ea。计算得到各组实验有机酸分解的热力学参数A和Ea见表3。对于系列I而言,Ext.1、Ext.2、Ext.3、Ext.4的Ea值相差不大,这表明pH值与钾长石的加入对乙酸分解反应进行的难易程度影响较小,四组实验乙酸经分解反应后浓度不同与不同实验条件下反应速率有密切关系。对于系列II而言,有钾长石存在的模拟实验(Ext.5)的Ea值高于不加钾长石乙二酸模拟实验(Ext.6),表明钾长石降低了模拟实验中乙二酸的分解难度。
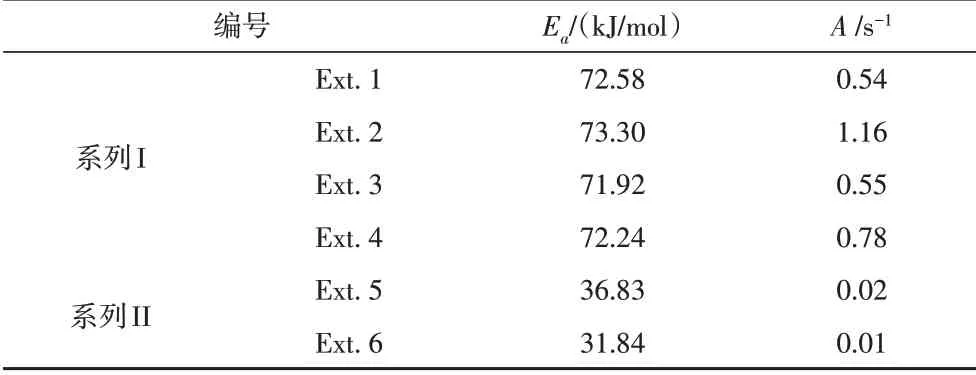
表3 有机酸分解的动力学参数Table 3 Kinetic parameters for organic acid decomposition

图5 有机酸热稳定性实验中ln k与1/T的关系Fig.5 Relationship between ln k and 1/T in experiments
系列I的Ea值明显高于系列II,这也和实验现象相吻合。当温度低于230℃,乙酸进行分解反应非常困难,乙酸的剩余浓度几乎无变化,而此条件下,乙二酸发生分解反应的现象显著,其浓度明显减小;当温度高于230℃,乙酸达到分解反应的Ea,乙酸分解反应迅速进行,浓度急剧下降。
3.2 乙酸和乙二酸热稳定性的影响因素
3.2.1 温度
活化能Ea反映一个特定的反应能够发生必须跨越的能峰(最小能量),通常不会随着温度的变化而变化。化学反应能否发生取决反应物之间是否存在有效碰撞(活化分子之间的碰撞)。当温度低于反应起始温度时,反应体系中活化分子比例低,无法形成有效碰撞,故反应无法进行。当温度高于反应起始温度,反应体系中活化分子的比例增加并形成有效碰撞,化学反应发生。当温度继续升高,反应物分子活动更为剧烈,有效碰撞频率迅速增加,进而反应速率常数随之增加。对于系列I而言,当温度低于230℃,乙酸分解反应所需的Ea未达到,尽管反应物的碰撞频率随着温度升高而增加,但并未形成有效碰撞,故反应速率常数相对较小。当温度大于230℃,反应体系中活化分子比例增加,形成有效碰撞,乙酸根离子中两个碳原子之间的共价键发生异裂,乙酸分解反应顺利进行。温度越高,分子活动越剧烈,乙酸根离子中两个碳原子之间的共价键发生异裂的可能性也就越大,故乙酸分解反应速率常数随着温度的升高而急剧增加(图3)。对于系列II而言,乙二酸分解反应速率常数随温度升高呈现出相似的变化趋势。因此,有机酸分解存在特定起始温度,根据本次研究的实验结果,乙酸和乙二酸大规模分解的起始温度分别为230℃和180℃。当达到分解反应的起始温度后,随着温度升高,乙酸和乙二酸的分解速率显著升高;而相同温度下,乙二酸的分解速率比乙酸高2~3个数量级。
3.2.2 pH值
实验Ext.1、Ext.3、Ext.2中,初始反应溶液具有相近的乙酸根离子浓度,而初始pH值依次升高(表1)。三组实验计算得到的活化能Ea(72.58 kJ/mol、71.92 kJ/mol、73.30 kJ/mol,表3)较为接近,而反应速率则有明显的增大趋势(图3),表明反应体系中溶液的pH值对乙酸的分解难度(活化能)影响较小,而对乙酸分解反应速率影响较大。高pH值的实验溶液体系中,乙酸的分解速率较高。大部分脱羧反应属于离子型反应历程,即羧酸先离解生成羧酸根负离子和氢离子,随后羧酸根离子与烷基相连的C-C共价键断裂,生成烃基负离子并放出CO2,最后烃基负离子获得氢离子形成烷烃使反应完成[30]。乙酸属于弱酸,在溶液中不能完全电离;通常pH值低的溶液中氢离子浓度较高,抑制了乙酸分子的电离,使游离的乙酸根离子浓度降低,进而降低了乙酸脱羧反应的反应速率。
3.2.3 压力
Liet al.[28]探讨了不同流体压力和静岩压力组合对乙酸热稳定性的影响,结果显示高流体压力和静岩压力均会降低乙酸的分解速率,而且静岩压力的影响更为显著。王慧媛等[29]采用水热金刚石压腔高温高压模拟装置对不同温度、压力条件下乙二酸的脱羧反应进行了研究,结果显示随着流体压力升高,乙二酸脱羧反应发生的温度逐渐升高(反应发生的温压条件为224.95℃/381.9 MPa、237.45℃/616.7 MPa、279.85℃/1 153 MPa),表明高压流体的可以显著提高乙二酸分解反应发生的温度。此外,本次乙酸热稳定性模拟实验所采用的流体压力和静岩压力分别为60 MPa和90 MPa,计算得到的在280℃和330℃条件下乙酸分解反应速率分别为1.3×10-8s-1和11.6×10-8s-1,明显低于Liet al.[28]利用相同实验溶液、在相同温度、较低流体压力(45 MPa)和静岩压力(45 MPa)模拟得到的乙酸分解反应速率(4.1~6.0×10-8s-1和51~59×10-8s-1)。因此,高的流体压力和静岩压力均会抑制乙酸和乙二酸的分解,在提高有机酸分解反应起始温度的同时降低分解反应速率。
3.2.4 钾长石
在乙酸热稳定性模拟实验中,Ext.1和Ext.4的初始反应溶液具有相同的pH值和乙酸根离子浓度(表1),Ext.4中加入了钾长石矿物。两组实验中乙酸根离子浓度均于230℃开始明显下降(图1a),但加入钾长石的实验Ext.4中乙酸根离子分解速率更快(图3a),表明钾长石的存在对乙酸分解反应发生的起始温度影响较小,但会显著提高乙酸的分解速率。钾长石作为一种稳定且广泛分布的铝硅酸盐可以与乙酸溶液中的氢离子发生反应,升高反应流体的pH值,从而增加反应体系中乙酸根离子浓度,使乙酸脱羧反应速率升高。本次研究的实验数据也证实了这一点,从图3b中可以看出,当温度高于230℃时加入钾长石矿物实验Ext.4的脱羧反应速率明显高于未加入钾长石实验Ext.1。此外,Ext.4实验的氧化反应速率同样明显高于Ext.1,表明钾长石的存在同样促进了乙酸(盐)氧化反应的发生。
在乙二酸模拟实验中,Ext.5和Ext.6的初始反应溶液具有相同的pH值和乙二酸根离子浓度(表1),加入钾长石模拟实验Ext.6的活化能Ea(31.84 kJ/mol)略微低于无钾长石实验Ext.5(36.83 kJ/mol,表3),且Ext.6的反应速率更高(图4)。以上现象表明钾长石可能作为正催化剂略微地降低了乙二酸分解反应的难度;同时钾长石同样提高了乙二酸的分解速率,其机理可能与对乙酸分解反应的影响机理相同。
4 地质意义
储集层次生孔隙的发育为油气成藏提供了有利条件。大量钻井取芯样品的镜下观测、实验研究和地震资料解释已证实深层、超深层存在次生孔隙发育区[2,7⁃8],而有机酸溶蚀作用是其主要成因之一[9]。分析高温、高压条件下有机酸的分解机制可以深入理解深层、超深层中的流体特征变化,而探讨利于有机酸保存的地层条件可以为深层、超深层油气勘探提供支持,因此评价深层、超深层条件下有机酸的热稳定性及其影响因素具有理论和实践双重意义。
随着埋深的增加,储集层的温度和压力均会增加。在上覆岩层压实作用下储集层的原生孔隙空间迅速减小。此时储集层中流体因压实作用被分隔开,导致其流动性变差,同时有机质生烃作用使流体总量增加,从而造成地层孔隙中流体压力高于静水压力,即超压现象。世界上许多地质实例已证实某些盆地或层段存在超压现象,包括欧洲北海盆地、美国犹他盆地、印尼马哈甘三角洲、美国伦巴德盆地、非洲刚果盆地等[31⁃34]。前人研究显示,超压的发育会抑制有机质的演化。付小东等[35]利用温—压双控模拟仪开展生烃模拟实验发现,高静岩压力和流体压力可延迟成熟阶段原油的生成并延缓过成熟阶段原油向烃类的转化。Haoet al.[36]基于有机质热演化过程中的体积膨胀效应和产物浓度变化速率揭示了超压对有机质演化的抑制作用。Carret al.[37]基于热力学第一定律提出超压的存在使有机质演化过程中烃类的生成需要额外克服一定的水压做功,进而提高反应所需的活化能。Ugunaet al.[38⁃39]也支持该观点,并提出有机质演化过程中生成的液态产物压缩系数小且黏度大,其受到超压的抑制作用相比气态产物更加明显。原油和有机酸碳同位素对比以及有机酸模拟实验结果显示,有机酸的主要来源可分为两种:有机质生烃过程中的热降解作用[14]和烃类的水解作用[13]。有机质生烃的延迟对上述两类反应都有滞后的作用。因此,在超压环境下有机酸可在更大的埋深下生成,为次生孔隙的发育和油气成藏提供条件。
尽管深层、超深层中的高地层温度会加速有机酸的分解,但其高静岩压力和流体压力能在提高有机酸分解反应起始温度的同时降低分解反应速率,为有机酸的保存提供条件。虽然钾长石矿物和实验体系的高pH值会加速有机酸的分解,但其对有机酸分解反应的起始温度影响甚微。基于本次研究的实验结果,在静岩压力为90 MPa、流体压力为60 MPa的条件下,当温度达到230℃时乙酸仍能大量存在。以我国塔里木盆地为例,其现今平均地温梯度为20℃/km[40],230℃对应的埋深约为10 750 m;虽然此等埋深条件下,地层的静岩压力和流体压力均显著高于本次研究的实验条件,但高的静岩压力和流体压力对有机酸的保存更为有利。因此推测,塔里木盆地深度达10 000 m的地层中有机酸仍能稳定存在,为该盆地深层、超深层优质储层的形成提供条件。而塔里木盆地塔深1井的钻探实践证实:在井深8 408 m处存在溶蚀孔洞并有油气显示[2]。深层、超深层的高压环境可以使有机酸稳定保存,使深层、超深层发育优质储层、乃至形成工业性油气藏成为可能。
5 结论
(1)在相同的温压条件下,乙二酸分解反应所需的活化能比乙酸低大约40 kJ/mol,且乙二酸分解反应的反应速率常数比乙酸高2~3个数量级。表明乙二酸比乙酸更容易分解,且分解反应的速率更高。当温度分别高于180℃和230℃,乙二酸和乙酸发生明显的分解反应。乙酸和乙二酸分解反应的反应速率常数随着温度的增加而急剧增加。
(2)脱羧反应是有机酸分解的主要反应过程,属于离子型反应历程,即有机酸首先电离成氢离子和羧酸跟离子,随后羧酸根离子发生分解。反应体系的pH值越高,有机酸根离子浓度越高,其分解反应越容易进行。反应体系中钾长石的存在明显提高了乙酸和乙二酸分解反应的反应速率,但对反应活化能和反应起始温度影响较低。
(3)高流体压力和静岩压力均会抑制乙酸和乙二酸的分解,在提高有机酸分解反应起始温度的同时降低分解反应速率。因此,相对高压、低地温的地层环境更有利于有机酸的保存,低地温梯度的沉积盆地形成深层—超深层优质储层的可能性更高。
