猪瘟病毒对ST细胞NF-κB信号通路炎性因子表达量的影响
2021-08-31杨齐之贤易蓉鑫周祖灵孙永科杨玉艾
杨齐之贤,易蓉鑫,周祖灵,孙永科,杨玉艾
(云南农业大学动物医学院,云南昆明 650201)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的高度接触性、致死性传染病,我国猪瘟呈现向非典型性方向发展的特征[1]。研究表明,核因子-κB(nuclear factor-kappa B,NF-κB)与病毒感染有着密切的关系,在抗病毒免疫和炎症反应中也发挥着重要的调控作用[2]。
当细胞处于未激活状态时,NF-κB与IκB蛋白以无活性的方式存在于细胞中,当IKK复合物接收的信号被传递到IκB蛋白上,使IκBα蛋白磷酸化后降解,活化p65蛋白(RelA),p50/p65结合而成的异二聚体表现出NF-κB活性从而被转移到细胞核内,诱导靶基因的表达,NF-κB通路的经典途径被激活[3],与经典途径相关的基因是NFKBIA、IKBKB、RelA基因。IKKα蛋白是IKK复合物的亚基之一,IKKα能够调控NF-κB的活性,并且激活NF-κB信号通路下游相关基因的表达[4],是非经典途径必须亚基之一,因此,检测编码IKKα的CHUK基因是关键。
Lee S M等[5]研究表明,猪繁殖与呼吸综合征病毒(PRRSV)激活了NF-κB途径。Chen L J等[6]研究表明,CSFV感染PK-15细胞不会影响NF-κB信号通路,并且p65/RelA没有明显从细胞质中转移至细胞核。Bensaude E等[7]研究表明,CSFV感染会激活NF-κB信号通路,并导致各种促炎因子上调。目前,关于CSFV感染猪睾丸上皮细胞系(swine testis,ST)对NF-κB相关基因表达的影响还尚未见报道,CSFV感染ST细胞后是否激活了NF-κB通路的经典途径和非经典途径还不明确。因此,本试验采用荧光定量PCR的方法检测CSFV感染ST细胞后NF-κB信号通路CHUK、IKBKB、NFKBIA、RelA基因mRNA表达量的变化情况,从基因水平分析CSFV感染ST细胞后对NF-κB信号通路上、下游的影响[8-9],并通过Western blot检测了p65蛋白在胞浆和胞核内的表达,进一步验证CSFV感染ST细胞后激活NF-κB通路的经典途径。本研究初步探索了机体感染猪瘟病毒对NF-κB通路上、下游炎性因子的影响,为猪瘟的有效防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 猪睾丸上皮细胞系(ST)和猪瘟病毒(CSFV)由云南农业大学细胞保存中心保存。
1.1.2 主要试剂 DMEM高糖培养液、新生胎牛血清、胰蛋白酶,HyClone公司产品;ExTaqDNA聚合酶、DNA Marker DL 5 000,宝生物工程(大连)有限公司产品;Transcriptor First Strand cDNA Synthesis Kit,罗氏公司产品;Trizol、TransStart®Tip Green qPCR SuperMix,北京全式金生物技术有限公司产品。
1.1.3 主要仪器设备 倒置相差显微镜,明美光电有限公司产品;CO2恒温培养箱,美墨尔特贸易有限公司产品; PCR仪,东胜国际贸易有限公司产品;电泳凝胶成像系统,上海天能科技有限公司产品;酶标仪,帝肯贸易有限公司产品;荧光定量PCR仪,美国Bio-Rad公司产品;电泳仪,北京六一生物科技有限公司产品。
1.2 方法
1.2.1 ST细胞的复苏与培养 在无菌离心管中加入9 mL DMEM培养液备用,从液氮罐中取出冻存的ST细胞迅速放入40℃水浴中溶化至冰水混合状态,轻轻吹打数次转入准备好的离心管中,1 000 r/min室温离心3 min,将沉淀转入含有100 mL/L血清的DMEM中,37℃、体积分数为5% CO2培养36 h~48 h,显微镜下观察细胞生长状况,在细胞呈现单层生长时传代。弃培养液,用PBS清洗2次,加入胰蛋白酶消化10 min~15 min,细胞大部分脱落后加入血清终止消化,反复吹打至细胞成单个,加入培养液继续培养。
1.2.2 MTT法检测CSFV对ST细胞增殖影响 取对数生长期的ST细胞,用预热至37℃ D-hank's液反复冲洗2次~3次。用2.5 g/L胰蛋白酶1 mL消化单层培养细胞,加入含100 mL/L新生牛血清的DMEM培养液终止消化。1 000 r/min室温离心5 min,用培养液重悬离心后的细胞,然后每孔接种1×104个细胞于96孔培养板中。将培养板移入CO2孵箱中,在37℃、体积分数为5% CO2及饱和湿度条件下孵育。细胞约长成80%的丰度时接种不同浓度的CSFV(0.01、0.05、0.1、0.5 MOI的浓度),每一浓度设6个重复孔,阴性对照组为不加CSFV,空白对照组为不加细胞只加CSFV。吸附1 h(期间每15 min轻轻晃动1次)。用D-hank's洗去未吸附的病毒,然后用含20 mL/L胎牛血清的DMEM维持液培养细胞,于0、12、24、48、72 h后,每孔加入10 μL MTT溶液,在细胞培养箱内继续孵育4 h。每孔加入100 μL Formazan溶解液,在细胞培养箱内再继续孵育。直至在普通光学显微镜下观察发现Formazan全部溶解。通常37℃孵育4 h左右,紫色结晶会全部溶解。在570 nm测定吸光度。
1.2.3 CSFV的接种与培养 取对数生长期的ST细胞,接种CSFV,吸附1 h后,加入细胞培养液DMEM(含20 mL/L血清)10 mL 作用4、8、12、16、24、48 h后收集细胞。
1.2.4 总RNA的提取和cDNA的合成 取对数生长期的ST细胞,接种CSFV,吸附1 h后,加入细胞培养液DMEM(含20 mL/L血清)10 mL 作用4、8、12、16、24、48 h后收集细胞,参照北京全式金生物技术有限公司生产的试剂盒的说明书的步骤提取总RNA,提取完成后进行cDNA的合成。反转录体系为:5×EasyScript®All-in-One SuperMix for qPCR 4 μL,gDNA Rwmover 1 μL,Total mRNA 2 μL,RNase-free water 13 μL。反转录条件:42℃ 15 min,85℃ 5 s。反转录产物置-20℃保存备用。
1.2.5 引物的合成 参考GenBank公布的猪的CHUK、IKBKB、NFKBIA、RelA基因的序列设计PCR扩增的上、下游引物,由上海生工生物工程技术服务有限公司合成。引物序列见表1。

表1 荧光定量PCR引物序列
1.2.6CHUK、IKBKB、NFKBIA、RelA基因PCR扩增 参照北京全式金生物技术有限公司生产的试剂盒的说明书的步骤进行,PCR扩增体系:2×EasyTaq®PCR SuperMix 12.5 μL,Template 1 μL,Forward Primer 1 μL,Reverse Primer 1 μL,nuclease-free water 补齐至25 μL。PCR扩增程序:94℃ 3 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共35个循环;最后72℃ 10 min。15 g/L琼脂糖凝胶电泳检测PCR产物。
1.2.7CHUK、IKBKB、NFKBIA、RelA基因荧光定量PCR扩增 根据每一个基因标准参照质粒,按测定计算的分子数,作相应倍比稀释使其2 μL分别含有质粒分子数为102、103、104、105、106、107,然后进行模板标准曲线的制备,将提取的样品总RNA 1 000 ng反转录产物和稀释的基因标准参照质粒分别加入荧光定量RT-PCR反应体系中,每个样品设置3个重复。qPCR扩增体系为:2×TransStart®Tip Green qPCR SuperMix 10 μL,Template 2 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,ddH2O 7 μL补齐至25 μL。扩增程序:94℃ 30 s;94℃ 5 s,60℃ 15 s,72℃ s,共45个循环。
1.2.8 数据统计分析 用2-△△CT法计算各个样品相对于内参基因的表达量。前提是内参基因的扩增效率与目的基因的扩增效率基本一致,即可以用以下的公式对mRNA的表达量进行计算:mRNA的表达量=2-△△CT。
1.2.9 Western blot 胞浆和胞核蛋白的提取参照上海生工生物工程技术服务有限公司生产的试剂盒说明书的步骤进行:收集CSFV感染24 h的ST细胞,用PBS洗1遍,用细胞刮刀收集细胞,500 r/min离心2 min~3 min,弃上清留沉淀备用。加入200 μL的提前与100 mmol/L PMSF混匀的浆蛋白抽提试剂,涡旋混合15 s使细胞沉淀与溶液充分混匀形成单细胞悬液;冰浴10 min;剧烈涡旋10 s,4℃、14 000 r/min离心10 min;吸取上清至预冷的EP管中备用,上清即为胞浆蛋白;完全吸取上清后向沉淀中加入100 μL蛋白抽提试剂,混匀即为细胞核。用BCA法测定蛋白浓度。
将样品加入6×buffer中煮沸5 min使蛋白质变性,4℃、12 000 r/min离心15 min,取上清加入SDS-PAGE泳道中,恒流跑胶;电泳完毕后转印至PVDF膜上,转印12 h,然后用脱脂奶粉封闭1 h;用TBST缓冲液洗膜3次~4次,每次5 min;4℃过夜孵育一抗;TBST洗膜3次,每次5 min;加入二抗孵育1 h;TBST洗膜,每次10 min;将PVDF膜加入显色液中避光显色30 min,用显影剂显像,定影剂定影后保存结果。
2 结果
2.1 MTT法检测CSFV对ST细胞增殖影响
根据MTT法的检测,发现0.05 MOI及以上病毒滴度的CSFV感染ST细胞24 h,对抑制ST细胞的生长达到50%,而0.01 MOI的CSFV感染ST细胞 48 h后,细胞的生长活性显著下降至20%。因此,在接下来的试验中都选择0.01 MOI的剂量接毒(图1)。

图1 CSFV感染对ST细胞活性的影响
2.2 CSFV普通PCR扩增
CSFV经RT-PCR扩增后,用15 g/L的琼脂糖凝胶进行电泳,获得单一且符合预期大小的条带,说明CSFV感染ST细胞,可以进行后续试验(图2)。
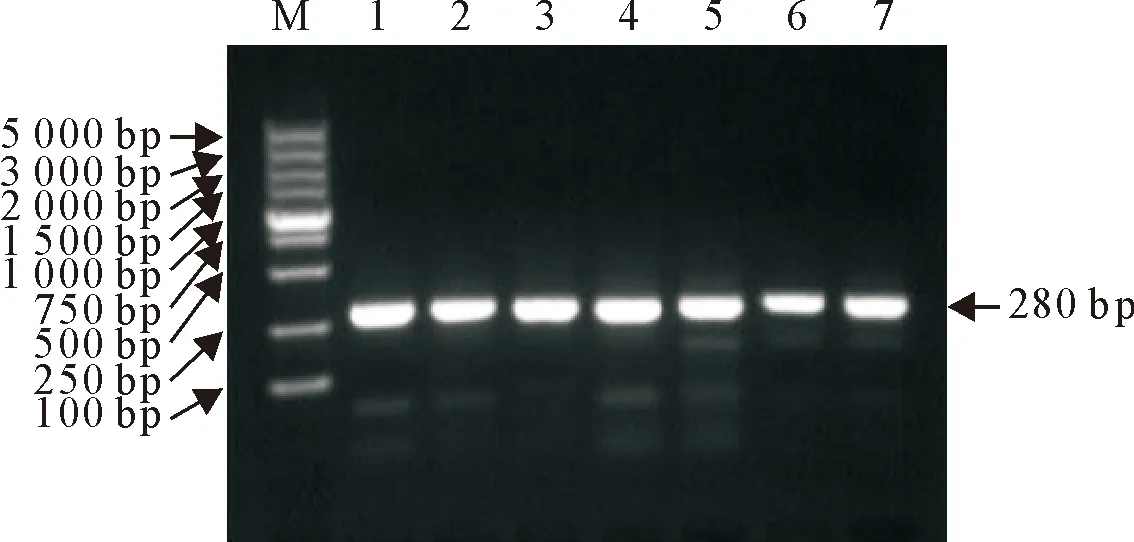
M.DNA 标准DL 5 000; 1.CSFV感染4 h; 2.CSFV感染8 h; 3.CSFV感染12 h; 4.CSFV感染16 h; 5.CSFV感染24 h; 6.CSFV感染48 h; 7.阳性对照
2.3 NFKBIA、RelA、IKBKB、CHUK基因的PCR扩增
NFKBIA基因经RT-PCR扩增后,各PCR产物用15 g/L的琼脂糖凝胶进行电泳,获得单一且符合预期大小的条带,说明引物具有特异性,条带大小为108 bp(图3)。

M.DNA标准DL 5 000; 1.CSFV感染4 h; 2.CSFV感染8 h; 3.CSFV感染12 h; 4.CSFV感染16 h; 5.CSFV感染24 h; 6.CSFV感染48 h
RelA基因经RT-PCR扩增后,各PCR产物用15 g/L的琼脂糖凝胶进行电泳,获得单一且符合预期大小的条带,说明引物具有特异性,条带大小为145 bp(图4)。

M.DNA标准DL 5 000; 1.CSFV感染4 h; 2.CSFV感染8 h; 3.CSFV感染12 h; 4.CSFV感染16 h; 5.CSFV感染24 h; 6.CSFV感染48 h
IKBKB基因经RT-PCR扩增后,各PCR产物用15 g/L的琼脂糖凝胶进行电泳,获得单一且符合预期大小的条带,说明引物具有特异性,条带大小为110 bp(图5)。

M.DNA标准DL 5 000; 1.CSFV感染4 h; 2.CSFV感染8 h; 3.CSFV感染12 h; 4.CSFV感染16 h; 5.CSFV感染24 h; 6.CSFV感染48 h
CHUK基因经RT-PCR扩增后,各PCR产物用15 g/L的琼脂糖凝胶进行电泳,获得单一且符合预期大小的条带,说明引物具有特异性,条带大小为101 bp(图6)。

M.DNA标准DL 5 000; 1.CSFV感染4 h; 2.CSFV感染8 h; 3.CSFV感染12 h; 4.CSFV感染16 h; 5.CSFV感染24 h; 6.CSFV感染48 h
2.4 NFKBIA、RelA、IKBKB、CHUK基因的转录
CSFV在感染ST细胞后,NFKBIA基因的mRNA表达水平显著下调;NFKBIA基因的mRNA表达在感染后4 h呈现明显的持续下降的趋势, 差异显著(P<0.05)(图7);
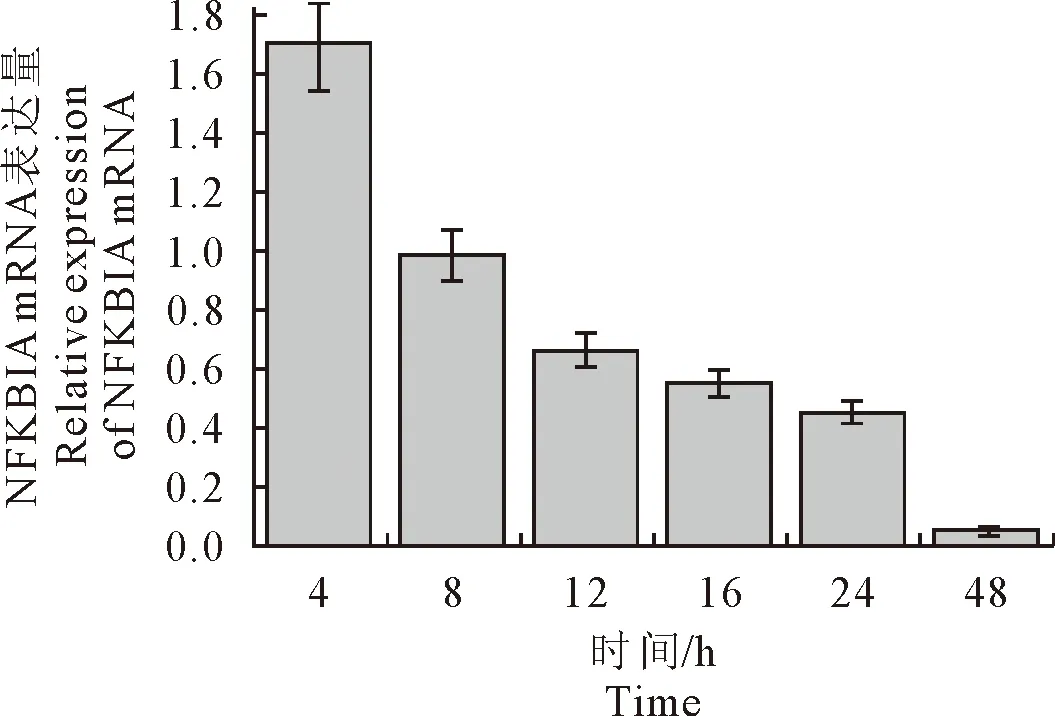
图7 不同时间CSFV感染 NFKBIA mRNA转录水平的变化
CSFV在感染ST细胞后,RelA基因的表达差异不显著(P>0.05)(图8)。

图8 不同时间CSFV感染 RelA mRNA转录水平的变化
CSFV在感染ST细胞后,IKBKB基因的mRNA表达呈现持续升高的趋势,差异显著(P<0.05)(图9);
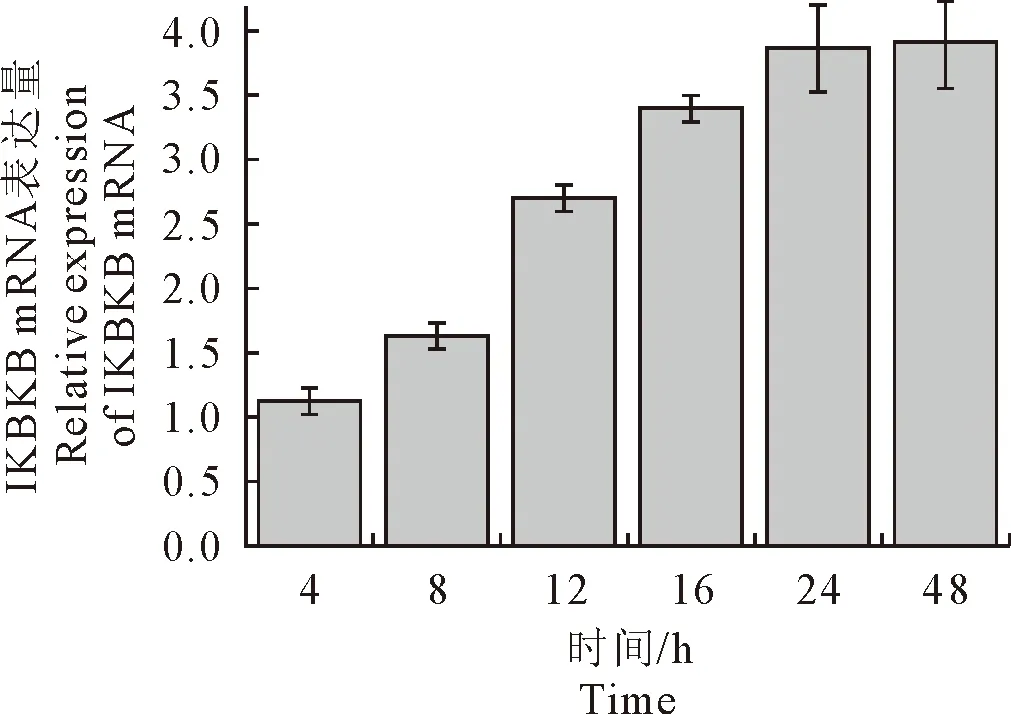
图9 不同时间CSFV感染IKBKB mRNA转录水平的变化
CSFV在感染ST细胞后,CHUK基因的mRNA的表达量呈现上升趋势,差异显著(P<0.05)(图10)。

图10 不同时间CSFV感染CHUK mRNA转录水平的变化
2.5 Western blot检测p65蛋白
CSFV在感染ST细胞24 h后,提取胞浆和胞核蛋白,结果表明p65蛋白在胞浆和胞核中均表达,p65蛋白入核,说明NF-κB通路的经典途径被激活,进一步验证了荧光定量PCR的结果(图11)。
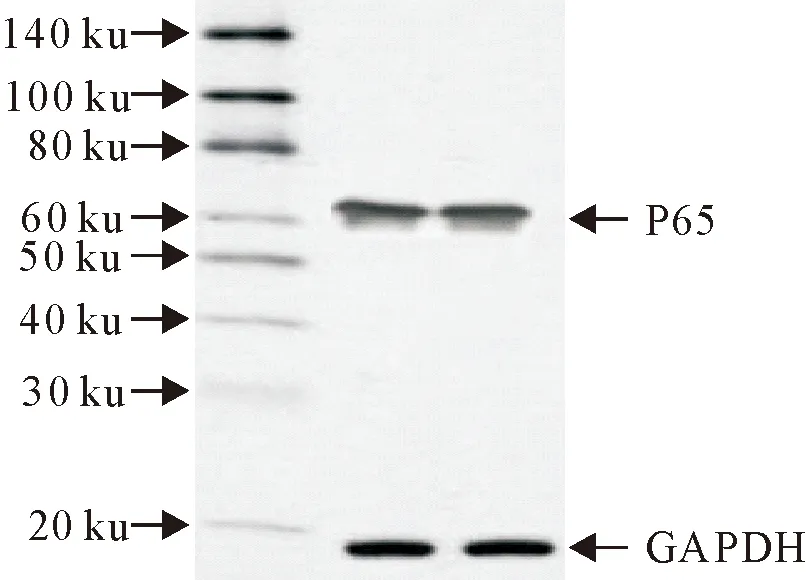
图11 p65和p-p65的表达
3 讨论
目前研究表明,病毒可以控制细胞信号转导途径,NF-κB途径是许多病毒的常见靶标,在炎症、先天性免疫应答、细胞增殖调节和细胞存活中起关键作用[10]。病毒与宿主之间的相互作用可能导致NF-κB途径的激活或抑制,从而导致其抗病毒反应、病毒复制能力和毒力增强[11]。本试验检测了NF-κB通路相关炎性基因mRNA的表达量,Western blot检测p65蛋白在细胞核中的表达。试验结果表明,CSFV感染ST细胞后,激活了NF-κB信号通路的经典和非经典途径,Western blot进一步验证了经典途径的激活,证明IκBα蛋白的降解使NF-κB二聚体释放,导致p65/RelA从细胞质向细胞核移位。
Doceul V等[12]研究表明,CSFV的NPro产物与NF-κB的抑制剂IκB相互作用。NFKBIA基因编码的IκBα蛋白是IκB蛋白家族成员之一,是哺乳动物NF-κB活性最重要的调节物质,NF-κB在细胞中的存在形式通常是同源是异源二聚体的形式存在,不同的二聚体识别不同的DNA结合位点,从而引起基因的的激活、转录或抑制[13]。Li H G等[14]研究表明,p65亚基是病毒诱导IFN-γ表达的NF-κB的关键成分。Li H等[13]研究表明,p65在成年猪中的肺、脾、肝、小肠中表达水平相对较高,间接证实了p65在免疫反应中起到关键作用。p50/p65是最常见的二聚体存在形式,在细胞质中,IκBα与p50/p65异源二聚体结合形成三聚体,覆盖其DNA结合位点,阻止其核易位,使其以无活性的形式存在于细胞质中,当IκBα受到外界刺激时,IκBα在IKK复合物的作用下被磷酸化后导致IκBα降解,使NF-κB游离进入细胞核从而激活其转录活性,NF-κB被激活后,细胞质中的p65转移到细胞核中与DNA结合,使NF-κB的转录更加精确,并且p65的磷酸化还能促使NF-κB相关的细胞因子释放,从而提高NF-κB的转录活性[15-18];基因敲除试验发现IKBKB基因编码的IKKβ和IKKγ是NF-κB所必须的,并在其中发挥着重要作用[19],并且IKKβ对IκBα的磷酸化能力比IKKα高大约60倍,是控制NF-κB信号通路的关键因子,因此IKKβ是经典信号通路中的关键亚基[20]。通过荧光定量PCR对经典途径相关的NFKBIA、RelA、IKBKB基因检测表明了CSFV感染ST细胞激活了NF-κB的经典途径,Western blot进一步验证了此结果。
在非经典途径中,NF-κB的激活主要依赖CHUK基因编码的IKKα对前体p100或p105的加工,使其水解成为有活性的p52,完成信号通路的激活[21]。因此,本试验CHUK基因的mRNA表达量上升的结果可推测得到CSFV感染ST细胞可以激活NF-κB信号通路的非经典途径。本试验验证了猪瘟病毒感染能够激活NF-κB信号通路经典途径和非经典途径,为猪瘟的有效防控提供理论依据。
