全身型重症肌无力的临床和电生理特点分析
2021-08-31曾文双林慧婷李黎娜褚晓凡蔡继福肖海兵
曾文双, 林慧婷, 李黎娜, 褚晓凡, 蔡继福, 肖海兵
重症肌无力(Myasthenia gravis,MG)是一种自身抗体介导的神经-肌肉接头疾病,按其肌无力分布范围可以分为全身型和眼肌型,而后者多数在疾病发展过程中,最终进展为全身型,故全身型MG在整个MG群体中占据了较多的比率。同时,全身型MG在临床表现和治疗反应上异质性较高,这对全身型MG的临床诊疗带来了较大的困扰。近年来,根据其临床特征及抗体结果,国际上将全身型MG进一步分为乙酰胆碱受体(Acetylcholine receptor,AchR)抗体阳性早发型(起病年龄小于50岁)、AchR抗体阳性晚发型(起病年龄大于50岁)、肌肉特异性受体酪氨酸激酶(Muscle-specific receptor tyrosine kinase,MuSK)抗体阳性型、低密度脂蛋白受体相关蛋白4(Low-density lipoprotein receptor-related protein 4,LRP4)抗体阳性型、胸腺瘤型和抗体阴性型[1]。准确的分型诊断和病情评估是全身型MG选取恰当的治疗措施并使患者获益的基石,而重复神经电刺激(Repetitive nerve stimulation,RNS)作为MG诊断的重要手段,也可能在全身型MG分型诊断和病情评估过程中具有潜在的价值。故本研究拟对不同亚型全身型MG的临床特征和RNS结果进行比较,分析RNS结果与全身型MG疾病严重程度之间的关系,为进一步拓展全身型MG分型诊断和病情评估的方法作出初步的探索。
1 材料与方法
1.1 研究对象 本研究为回顾性研究,收集2016年7月至2020年7月香港大学深圳医院神经内科就诊或住院的全身型MG患者。结果101例全身型MG患者纳入研究,其中早发AchR抗体阳性全身型52例(51.5%)、晚发AchR抗体阳性全身型23例(22.8%)、胸腺瘤型22例(21.8%)、MuSK抗体阳性型4例(4.0%)。
1.2 纳入标准 (1)骨骼肌波动性无力和病态易疲劳;(2)累及眼外肌和眼轮匝肌以外的肌肉;(3)就诊时尚未接受免疫治疗;(4)AchR抗体或Musk抗体阳性;(5)重复神经电刺激阳性;(6)新斯的明试验阳性,其中(4)、(5)、(6)条至少具备其一。
1.3 排除标准 除外Lambert-Eaton肌无力综合征、先天性肌无力综合征和肉毒毒素中毒等其它神经肌肉接头疾病。
1.4 资料收集 收集患者性别、起病年龄、病程、定量重症肌无力评分(Quantitative Myasthenia Gravis score,QMGs)和美国重症肌无力协会(MG Foundation America,MGFA)临床分级、AchR抗体滴度、重复神经电刺激和胸腺CT结果。
1.5 抗体检测 所有患者使用黄头采血管采集外周静脉血3 ml送广州欧蒙医学检验所,经ELISA法检测AchR抗体滴度,如抗体滴度>0.50 nmol/L,则认定为AchR抗体阳性;经ELISA法检测MuSK抗体滴度,如抗体滴度>0.05 nmol/L,且经CBA法定性为阳性,则认定为MuSK抗体阳性。
1.6 RNS检查 分别对面神经、副神经、尺神经进行3 Hz重复电刺激,每根神经连续刺激10次,通过表面电极在眼轮轧肌睑部、斜方肌、小指展肌获取CMAP,记录第四个CMAP较第一个CMAP的波幅下降比率,如波幅下降比率≥10%,则判定该肌肉RNS阳性,记录RNS阳性肌肉的分布范围、单块被检肌肉最大波幅下降比率和所有被检肌肉总波幅下降比率。
1.7 胸腺CT检查 由两位具有相关经验的影像科医生对胸腺CT结果进行独立判断,以确定是否合并胸腺瘤。
2 结 果
2.1 人口学和免疫学特点 52例早发AchR抗体阳性全身型MG患者中,女性37例(71.2%),男性15例(28.8%),起病年龄35.5(19.8)岁,病程6.0(11.8) m,AchR抗体滴度(8.9±4.6) nmol/L;23例晚发AchR抗体阳性全身型MG患者中,女性15例(65.2%),男性8例(34.8%),起病年龄61.0(10.0)岁,病程6.0(11.0) m,AchR抗体滴度(9.1±4.4) nmol/L;22例胸腺瘤型MG患者中,女性8例(36.4%),男性14例(63.6%),起病年龄46.0(21.8)岁,病程6.0(14.8) m,AchR抗体滴度(10.1±3.5) nmol/L;4例MuSK抗体阳性型MG患者中,女性2例(50%),男性2例(50%),起病年龄60.5(17.8)岁,病程3.5(8.0) m。非MuSK抗体阳性全身型MG中,女性患者所占比率具有显著差异,其中早发AchR抗体阳性全身型比例最高(χ2=8.08,P<0.05),病程、AchR抗体滴度不具有显著差异(见表1)。
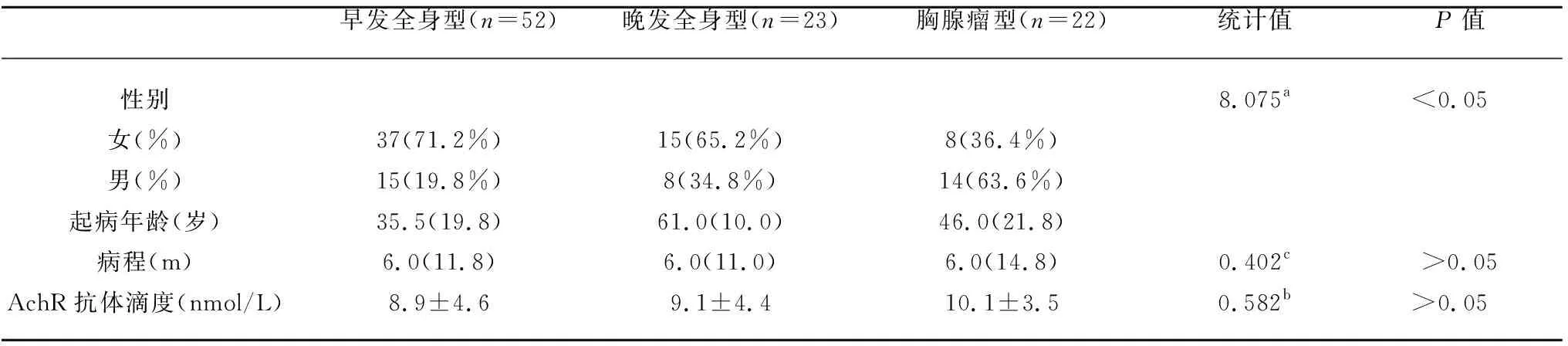
表1 非MuSK抗体阳性全身型MG的人口学和免疫学对照研究
2.2 QMGs和MGFA临床分级 52例早发AchR抗体阳性全身型MG患者中,QMGs(12.4±4.9),MGFA临床分级Ⅱa级28例、Ⅱb级12例、Ⅲa级8例、Ⅲb级3例、Ⅳa级1例,其中中重度受累(临床分级为Ⅲ级或Ⅲ级以上)患者12例(23.1%),呼吸肌/球部肌肉受累为主(临床分级为b级或Ⅴ级)患者15例(28.8%);23例晚发AchR抗体阳性全身型MG患者中,QMGs(11.1±4.4),MGFA临床分级Ⅱa级11例、Ⅱb级10例、Ⅲa级2例,其中中重度受累患者2例(8.7%),呼吸肌/球部肌肉受累为主患者10例(43.5%);22例胸腺瘤型MG患者中,QMGs13.8±5.6,MGFA临床分级Ⅱa级7例、Ⅱb级11例、Ⅲa级1例、Ⅲb级3例,其中中重度受累患者4例(18.2%),呼吸肌/球部肌肉受累为主患者14例(63.6%);4例MuSK抗体阳性型MG患者中,QMGs(12.5±7.1),MGFA临床分级Ⅱa级1例、Ⅲb级1例、Ⅳb级1例、Ⅴ级1例,其中中重度受累患者3例(75%),呼吸肌/球部肌肉受累为主患者3例(75%)。MuSK抗体阳性型MG中,中重度受累患者所占比率、呼吸肌/球部肌肉受累为主患者所占比率均较高;而非MuSK抗体阳性全身型MG中,呼吸肌/球部肌肉受累为主患者所占比率具有显著差异,其中胸腺瘤型比例最高(χ2=6.95,P<0.05),QMG评分、中重度受累患者所占比率不具有显著差异(见表2)。
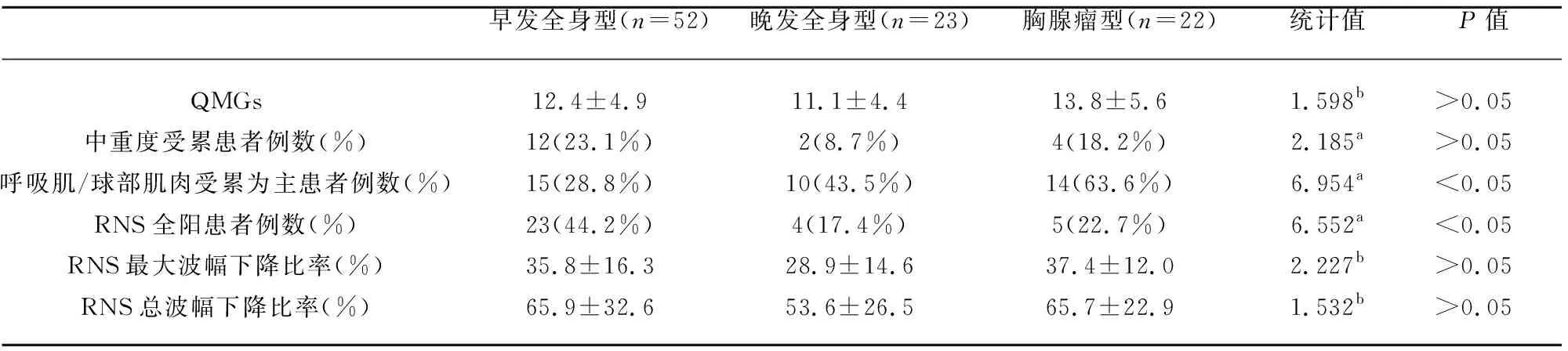
表2 非MuSK抗体阳性全身型MG的临床和电生理参数对照研究
2.3 RNS结果 52例早发AchR抗体阳性全身型MG患者中,被检肌肉RNS均为阳性为23例(44.2%),最大波幅下降比率(35.8±16.3)%,总波幅下降比率(65.9±32.6)%;23例晚发AchR抗体阳性全身型MG患者中,被检肌肉RNS均为阳性为4例(17.4%),最大波幅下降比率(28.9±14.6)%,总波幅下降比率(53.6±26.5)%;22例胸腺瘤型MG患者中,被检肌肉RNS均为阳性为5例(22.7%),最大波幅下降比率(37.4±12.0)%,总波幅下降比率(65.7±22.9)%;4例MuSK抗体阳性型MG患者中,被检肌肉RNS均为阳性为0例(0%),最大波幅下降比率(34.3±13.4)%,总波幅下降比率(62.8±32.1)%。MuSK抗体阳性型MG中,被检肌肉RNS均为阳性患者所占比率明显偏低;而非MuSK抗体阳性全身型MG中,被检肌肉RNS均为阳性患者所占比率具有显著差异,其中早发AchR抗体阳性全身型比率最高(χ2=6.55,P<0.05),最大波幅下降比率、总波幅下降比率不具有显著差异(见表2)。
2.4 QMGs与AchR抗体滴度、RNS结果的相关性 97例非MuSK抗体阳性全身型MG中,QMGs(12.4±5.0),AchR抗体滴度(9.2±4.3) nmol/L,RNS最大波幅下降比率(34.5±15.2)%,RNS总波幅下降比率(62.9±29.4)%,其中QMGs与RNS最大波幅下降比率(r=0.398,P<0.01)、RNS总波幅下降比率(r=0.433,P<0.01)呈明显正相关关系,QMGs与 AchR抗体滴度之间无明显相关性(见表3)。

表3 非MuSK抗体阳性全身型MG的QMG评分与AchR抗体滴度、RNS结果的相关分析
3 讨 论
在本研究的101例全身型MG患者中,早发AchR抗体阳性全身型占比51.5%,晚发AchR抗体阳性全身型占比22.8%,胸腺瘤型占比21.8%,MuSK抗体阳性型占比4.0%,与此前国内研究结果基本一致[2,3],但与欧美国家存在一定差别。后者晚发AchR抗体阳性全身型占比较高,且MuSK抗体阳性型占比也高于国内,考虑与地域和人种差异有关[4,5]。非MuSK抗体阳性全身型MG中,性别构成比率也存在显著差别,其中早发AchR抗体阳性全身型MG女性患者所占比率较高,而胸腺瘤型MG男性患者所占比率较高,与之前国内外文献报道一致,考虑与其不同的发病机制有关[2,6,7]。
在97例非MuSK抗体阳性全身型MG患者中,呼吸肌/球部肌肉受累为主患者所占比率存在显著差异,其中胸腺瘤型MG比率最高,这提示胸腺瘤型MG更多和更早地累及呼吸肌/球部肌肉,与此前国外文献报道相符[7]。故而,临床上对于早期出现呼吸肌/球部肌肉受累的MG患者,需要更为仔细地筛查是否合并胸腺瘤;同时,对于胸腺瘤型MG患者,也需要更加关注呼吸肌/球部肌肉功能的评估,以便更为及时地做出治疗方式的调整。
在97例非MuSK抗体阳性全身型MG患者中,被检肌肉RNS均为阳性患者所占比率具有显著差异,其中早发AchR抗体阳性全身型MG比率最高;此前也有国外研究发现,早发型MG相对于晚发型MG具有更高的RNS阳性率,而AchR抗体阳性全身型较AchR抗体阴性全身型RNS阳性的比率更高[2,8]。上述结果显示,早发AchR抗体阳性全身型MG较其它亚型具有更高的RNS阳性率,其RNS阳性肌肉的分布范围也较其它亚型更为广泛,这提示RNS在早发AchR抗体阳性全身型MG的诊断过程中具有更高的临床价值;同时,对于RNS阳性肌肉分布范围较广泛的早发型MG患者,需要重点筛查是否AchR抗体阳性。
在97例非MuSK抗体阳性全身型MG患者中,QMGs与AchR抗体滴度之间无明显相关性,这与此前国外报道相符[8]。与之相反,QMGs与RNS最大波幅下降比率、RNS总波幅下降比率呈明显正相关关系,这与此前国外研究结果一致[9,10],提示RNS结果可以用于全身型MG疾病严重程度的评估,其与临床评估相结合,能更为全面客观地评价全身型MG患者的肌肉受累和治疗改善情况,特别是对于临床评估配合欠佳的患者,RNS结果具有更大的优势。
在4例MuSK抗体阳性型MG患者中,相对于非MuSK抗体阳性型MG,中重度受累患者所占比率、呼吸肌/球部肌肉受累为主患者所占比率均较高,而被检肌肉RNS均为阳性患者所占比率较低,提示MuSK抗体阳性型MG病情进展更快,也更容易累及呼吸肌/球部肌肉,但RNS阳性率相对偏低,有国外研究报道选取肢体近端肌肉或面部肌肉检查,可以提高其RNS阳性率[5]。本研究MuSK抗体阳性型MG病例数量偏少,相关结论还需要后续进一步扩大病例数量予以验证。
综上所述,不同亚型全身型MG的人群分布、性别占比、主要受累肌肉、受累肌肉受累程度及分布范围均具有一定的差别,这在全身型MG的分型诊断方面具有很大的参考价值;RNS结果与全身型MG疾病严重程度具有高度相关性,提示RNS不仅可以用于全身型MG的临床诊断,在病情评估方面也具有重要临床价值,值得大力推广。
