体外膜氧合在暴发性心肌炎救治中的应用
2021-08-31龚志云李双磊
龚志云,李双磊,吴 杨,张 欣
暴发性心肌炎(fulminant myocarditis, FM)是急性心肌炎最为严重的类型,患者可很快出现严重心力衰竭、低血压或心源性休克以及严重心律失常,维持循环、恢复心脏功能是救治的中心环节,体外膜氧合(extracorporeal membrane oxygenation,ECMO)等机械循环支持(mechanical circulatory support,MCS)治疗的应用通过支持循环功能,保证重要脏器灌注,帮助患者度过急性发病期,提高FM 患者的生存率[1-3]。
目前国内ECMO 技术应用于FM 的报道尚不多,本文回顾性分析了本中心近年来应用ECMO 治疗的FM 患者的临床资料,总结分析如下:
1 资料与方法
1.1 研究对象 2015 年 8 月至 2019 年 12 月间解放军总医院第一医学中心收治的10 例FM 并接受ECMO 支持治疗的病例。 诊断参照成人FM 诊断和治疗中国专家共识临床诊断标准[1]:急性起病,有病毒感染前驱症状,继而出现严重血流动力学障碍,实验室检测显示心肌严重受损,超声心动图可见弥漫性室壁运动障碍。
1.2 研究方法 收集患者的基本信息、就诊入院时情况、ECMO 与其他生命支持治疗的应用、ECMO 治疗前后的病情变化、并发症发生和转归情况等临床资料;总结FM 患者的临床特点,观察比较 ECMO治疗前后的指标变化,分析ECMO 在救治FM 中的作用。
1.3 统计学方法 采用SPSS 22.0 软件进行统计分析。 数据的正态性通过 Shapiro-Wilk 检验进行检验,对正态性数据使用均数±标准差()表示,对非正态性数据以中位数(范围)表示;对ECMO 运行前后指标比较采用配对样本t 检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 入院时资料 10 例患者均为女性;9 例为成人,1 例儿童,平均年龄(28.8±13.1)岁(见表 1);患者起病至就诊入院中位间隔时间 4.0(2.1 ~19.0)d,均伴胸闷不适,8 例有发热病史,3 例心悸,2 例胸痛;就诊时肌钙蛋白 T(cardiac troponin T, cTnT)中位值为 2.22(0.20,13.60)μg/L,肌酸激酶同工酶(creatine kinase isoenzyme, CKMB) 中位值 39.62(14.48,297.40) μg/L,平均脑利钠肽前体(NT-proBNP)值(9 951.6±7 417.5)ng/L,平均血乳酸值(2.8±1.5)mmol/L。
2.2 ECMO 及其他生命支持治疗 ECMO 置入前均大剂量血管活性药物不能维持循环,8 例患者出现室颤或室速。 ECMO 置入距起病间隔时间为6.0(2.8~24.9)d,距就诊入院间隔时间为 36.7(1.8 ~238.0)h(见表 2)。 ECMO 置入地点为 ICU 6 例,手术室3 例,急诊抢救间1 例;其中2 例于外院置入ECMO 后辅助下转运至本院。 均采用静脉-动脉(veno-artey,V-A)ECMO 辅助,成人采用股动静脉置管,儿童病例经颈动静脉置管。
9 例患者于ECMO 辅助前行气管插管机械通气,1 例辅助19 d 后因脑出血而行气管插管。 全组病例气管插管距就诊入院间隔时间为 21.5(0.3 ~439.2)h,其中 2 例于急诊抢救间行气管插管。 1 例于ECMO 辅助4 d 后拔除气管插管,继续行清醒ECMO 辅助;其余病例均于 ECMO 撤除后拔除。 见表1。
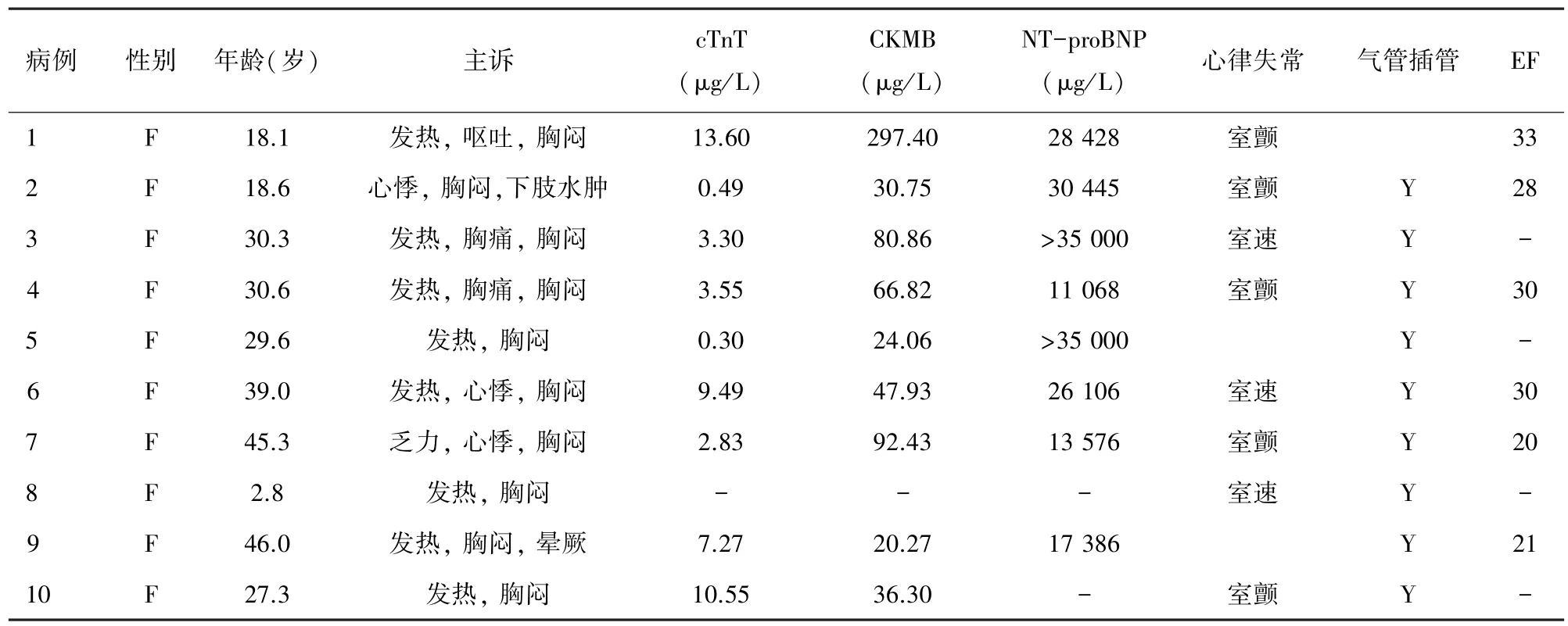
表1 ECMO 使用前患者的病例资料
治疗过程中共5 例患者接受主动脉内球囊反搏(intra-aortic ballon pump, IABP)辅助循环。 4 例于ECMO 治疗前置入,因辅助效果不佳分别于1.2 h、11.9 h、12.5 h 和 18.7 h 后接受 ECMO 治疗;1 例于ECMO 辅助 12 d 撤机前置入。 1 例患者 ECMO 辅助9 d 后拔除IABP,辅助28 d 撤机前再次置入IABP,其余均于ECMO 撤机后拔除。 见表2。
ECMO 辅助期间有6 例行持续肾脏替代治疗(continuous renal replacement therapy, CRRT),均采用与ECMO 管路并联方式连接。 见表2。

表2 ECMO 使用后的患者的临床资料、并发症及临床转归
2.3 ECMO 治疗前后指标变化 cTnT 和 CKMB 就诊时达峰值,治疗过程中呈下降趋势(见图1)。
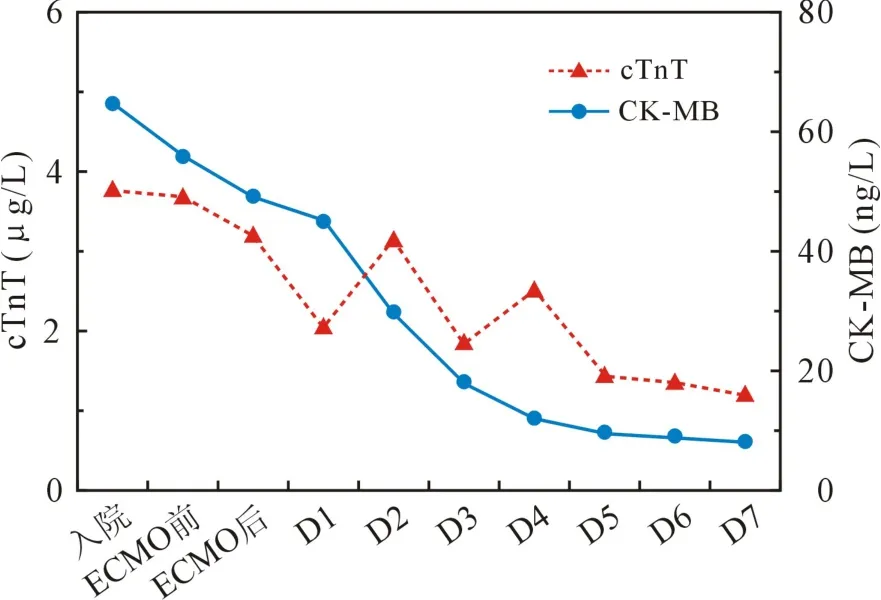
图1 肌钙蛋白T 和肌酸激酶同工酶变化趋势
NT-proBNP(部分值超出检验上限值35 000 ng/L,均取 35 000 ng/L 计算)于 ECMO 治疗前上升至(24 626.1±9 442.2) ng/L,ECMO 治疗后当天复查即呈下降趋势,辅助 24 h 后降至(10 141.7±9 789.4)ng/L(见图 2);与 ECMO 治疗前比较,辅助 24 h 后(第一天,D1)NT-proBNP 值明显降低(P=0.014)。血乳酸水平(超出检验上限值15 mmol/L 者取值为15 mmol/L)ECMO 前上升至(10.8±5.6)mmol/L,ECMO辅助 24 h 后(D1)降至(3.1±1.7)mmol/L,明显降低(P=0.007)。

图2 脑利钠肽前体与血乳酸变化趋势
丙氨酸转氨酶于ECMO 治疗当天达峰值,此后呈稳定下降趋势;血肌酐亦于ECMO 治疗当天达峰值,辅助第二天(D2)降至最低,此后随着ECMO 治疗时间延长,呈上升趋势(见图3)。
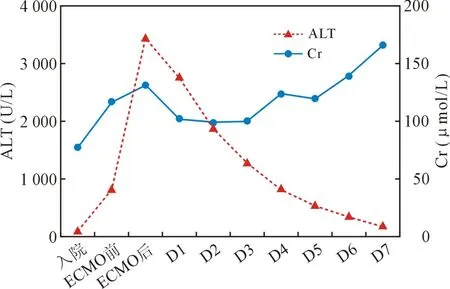
图3 丙氨酸转氨酶与血肌酐变化趋势
2.4 并发症与临床转归 ECMO 治疗中位时间5.8(2.8~28.2)d;成功撤机 8 例,存活出院 7 例。 ECMO辅助<1 周的患者6 例,均撤机成功,但病例7 于EC⁃MO 治疗前陷入昏迷,撤机后仍持续昏迷、伴瞳孔不等大,转入当地医院治疗期间死亡,该患者同时并发消化道出血。 ECMO 辅助>1 周的患者 4 例,2 例撤机成功但发生脑出血,1 例辅助12.8 d 撤机失败死亡,1 例儿童辅助15.4 d 后心功能未恢复,接受心脏移植后康复出院。 病例4 例于辅助7.6 d 撤机当天脑出血,行脑室引流无效,脑死亡行器官捐献;病例1于辅助19 d 时脑出血,去骨瓣减压无效死亡,该患者同时并发肱动脉穿刺部位出血行手术止血。 见表2。
3 讨 论
FM 时心肌弥漫性损伤,泵功能受损,导致严重血流动力学障碍和恶性心律失常,加之肺淤血和肺部炎症损伤,难以维持全身血液和氧的供应,会出现肺、肝、肾等多器官功能衰竭[1,4]。 本研究检验指标的变化趋势反映了FM 从心肌损伤其他脏器功能受损的发展过程。 就诊时cTnT 和CKMB 等心肌损伤指标即达峰值,NT-proBNP 和血乳酸亦明显升高;入院后NT-proBNP 和血乳酸继续升高,肝肾功能指标随后出现恶化。
当FM 进展到“崩溃”阶段,积极采用以MCS 为核心的各项生命支持治疗措施是降低病死率的关键[1-2,4]。 呼吸支持可以改善肺功能,降低心脏负荷;CRRT 治疗有助于清除毒素和炎性因子,超滤可以减轻心脏负荷。 本组病例中,综合运用了呼吸支持、CRRT、IABP 和 ECMO 等生命支持措施,其中最为关键的是有效的MCS 治疗。 数据显示,ECMO辅助治疗后NT-proBNP 和乳酸水平迅速下降,肝肾功能指标亦随之好转,表明ECMO 作为MCS 工具,可以提供有效循环支持,纠正FM 带来的循环功能障碍。
目前可用的MCS 装置包括IABP、轴流泵(Im⁃pella)、ECMO 和心室辅助(ventricular assistance de⁃vice, VAD)等。 但目前 Impella 和 VAD 在国内尚未常规开展。 IABP 可以降低左室后负荷,增加大约15%的心输出量,是最常用的MCS 设备,也是FM 的一线 MCS 设备[1-2]。 Li 等[2]的研究中 75%的 FM 患者仅应用IABP 取得良好效果。 但在部分患者,尤其是合并严重右心功能不全或快速性心律失常时,单纯应用IABP 难以有效辅助循环,此时应立即启用ECMO 治疗[1]。 本组有 4 例患者首先应用 IABP 治疗,均于24 h 内进一步接受ECMO 治疗。
对于FM,何时应用ECMO 治疗目前并无明确一致意见,但在多系统器官衰竭开始或恶化之前尽早启用有助于降低病死率。 临床评估应用指征时,血管活性药物逐步加量,NT-proBNP 和乳酸水平持续上升,肝、肾功能指标出现恶化等可作为参考。 同时还应考虑到,由于心肌受损,FM 容易出现恶性心律失常而使病情加剧恶化。 本组病例中,8/10 例出现室颤或室速等恶性心律失常。 ECMO 的延迟使用可能导致救治失败。 本组1 例患者ECMO 辅助前因低血压、呼吸衰竭及室速等原因致昏迷,虽经ECMO 支持治疗后心功能恢复并成功撤机,神经功能未能恢复而致预后不佳。
值得注意的是,FM 早期表现与普通急性心肌炎并无明确“界限”,同时其病因以病毒感染最为常见[4],前期症状缺乏特异性,患者症状加重就诊时病情往往已进入快速进展期。 本组病例中,约半数患者于就诊24 h 内接受气管插管,36 h 内接受ECMO治疗。 临床上对于符合急性心肌炎诊断的患者,须警惕病情急剧恶化可能,应严密观察,一旦出现血流动力学障碍,积极应用MCS 治疗。
ECMO 可以有效支持循环,但治疗期间可能因机械问题、凝血功能紊乱、感染等导致严重并发症,其中出血是常见并发症之一[5]。 本组有3 例患者并发4 例次出血,包括消化道出血、穿刺部位出血和脑出血;2 例脑出血导致死亡。 研究显示,中枢神经系统并发症是ECMO 治疗患者死亡的常见原因之一,其在V-A ECMO 更为常见,且与ECMO 持续时间相关[6-7]。 Fletcher 等[8]所报道的 ECMO 治疗病例中脑出血发生率达21%。
患者预后取决于心功能恢复和并发症发生的情况。 度过急性期后,大部分FM 患者心功能可以恢复[1,9]。 本组 10 例患者中,最终有 8 例心功能恢复,成功撤机。 文献报道ECMO 治疗的FM 患者撤机成功率为 66%~76%[10-13]。 但随着 ECMO 辅助时间延长,患者预后变差。 本组ECMO 支持时间<1 周的6例患者,仅1 例因ECMO 支持前神经功能障碍而致最终预后不佳,其余均康复;而支持超过1 周的4 例患者1 例撤机失败,2 例死于并发症,1 例接受心脏移植后存活。
少部分FM 患者心功能难以恢复。 部分病理类型如巨细胞性心肌炎和嗜酸性细胞心肌炎心功能恢复机会较低[4];Chou 等[14]的研究显示,CKMB 峰值水平、严重室内传导阻滞和恶性心律失常是心功能不恢复的预测因子。 对于心功能长时间不恢复的患者,心脏移植可以作为一个最后选择。 Ghelani 等[15]报道ECMO 或MCS 治疗的119 例儿童心肌炎病例中,有23 例(19.3%)接受心脏移植;其他文献报道ECMO 治疗的FM 病例接受心脏移植的比例为4%~8%[10,12,16]。 对于心脏移植的合适时机目前仍无确定意见。 文献报道中,FM ECMO 中位辅助时间为 7.1~9.9 d[10-11,13]。
综上,FM 患者出现严重血流动力学障碍时,积极应用ECMO 可以提供有效循环支持,纠正循环功能障碍,保证器官和组织灌注,为患者心功能恢复或心脏移植提供机会。
