腰交感神经毁损治疗下肢冷觉异常的疗效观察 *
2021-08-31赵婷伟李美睿李京玉吴大胜张广建
赵婷伟 李美睿 李京玉 金 丽 吴大胜 张广建△
(1 延边大学附属医院疼痛科,延吉 133000;2 吉林省人民医院疼痛科,长春 130021)
临床上下肢冷觉异常的病例屡见不鲜,其突出表现为下肢发凉、惧冷,即使在炎热的夏季都需要穿秋冬季下衣,令病人苦不堪言。病人经血管外科、风湿科、神经内科和中医科等多学科诊治难以见效。研究报道发现[1~3]:腰交感神经毁损不仅通过扩张下肢血管、建立侧支循环以改善下肢缺血性和神经病理性疼痛,而且可显著增加下肢的温热、舒适感。目前国内外学者对腰交感神经毁损治疗下肢发凉、惧冷等温度觉异常的临床报告和基础研究甚少。我科采用CT 引导下腰交感神经毁损治疗下肢冷觉异常获得良好的疗效。
方 法
1. 一般资料
本研究经延边大学附属医院医学伦理委员会批准(2019077),选取2019 年10 月至2020 年10 月疼痛科收治的以下肢冷觉异常为主要表现的病例为研究对象。符合纳入标准的病人23 例,其中男8 例、女15 例,年龄56~81 岁,平均 (68.6±7.9) 岁,病程1~21 年,平均 (5.6±3.1) 年,单侧病例6 例,双侧病例17 例。
纳入标准:①单侧或双侧下肢冷凉感,腘窝和足背皮肤温度≥36.0℃;②室温≤25.0℃不能耐受暴露下肢;③中、西医非手术治疗无效;④腰椎MRI 和下肢动静脉彩超排除脊柱和血管性病变;⑤病人知情同意配合治疗与评估。
排除标准:①下肢动脉硬化闭塞症;②糖尿病周围神经病变;③腰椎管狭窄症等引起的下肢冷凉;④其他介入手术禁忌证(出凝血异常、局部严重感染等)。
2. 治疗方法
病人取俯卧位,腹下垫枕,开放静脉通道,监测心电和血压。于L2椎体进行CT 平扫,确定进针点、角度和穿刺路径。常规消毒和铺单,1%利多卡因局部麻醉。CT 引导下采用15 cm 射频套管针在L2椎体横突下缘穿刺至椎体前外缘,拔出射频套管针芯,插入射频电极行感觉运动测试无异常后注射1 ml 碘海醇,CT 平扫见造影剂沿椎体与腰大肌之间的椎前筋膜下间隙扩散(见图1、2),注入1%盐酸利多卡因1 ml,5 min 后出现下肢温热感(且无下肢肌力和感觉减退),行80℃连续射频(物理毁损)2 min 后拔出射频电极,注入抗炎镇痛混合液(配制方法:注射用盐酸罗哌卡因0.5 ml + 复方倍他米松注射液0.5 ml + 生理盐水1 ml)1 ml,观察10 min 待药物扩散吸收起效后,再次CT 平扫观察造影剂扩散情况无误后缓慢注入无水乙醇(化学毁损)1 ml;插入射频针芯并快速拔出套管针,敷贴针孔固定,术后俯卧位,心电、血压监护2 小时。

图1 单侧腰2 交感神经节穿刺和造影
3. 观察指标
评估术前、术后1 天、7 天、30 天、90 天、180天各时间点的足背外侧冷觉阈值 (cold sensory threshold, CST) 和冷痛觉阈值 (cold pain threshold, CPT)、腘窝和足背温度(3 次体温枪平均值)、第一足趾末端血流灌注指数 (perfusion index, PI)和匹兹堡睡眠质量指数 (Pittsburgh sleep quality index, PSQI)评分:PSQI 用于评估受试者的睡眠质量,量表由18个自评条目和5 个他评条目组成。其中18 个自评条目可组合成7 个因子,每个因子按0~3 分等级记分,各因子得分总和为匹兹堡睡眠质量指数总分,5 个他评项目不参与记分。PSQI 总分范围为0~21,得分越高,表示睡眠质量越差,一般认为≥8 有临床意义。
4. 统计学分析
采用SPSS 22.0 统计软件进行数据分析,计量资料以均数±标准差(±SD)表示,采用独立样本t检验,P< 0.05 为差异具有统计学意义。
结 果
本研究符合纳入标准的病人23 例,单侧病例6例,双侧病例17 例,所有病人均无不良并发症发生。
与术前相比,所有病人术后1 天、7 天、30 天、90 天、180 天各时间点足背外侧CST 显著降低(P<0.01,见图3),CPT 在术后第1 天开始的6 个月内显著降低(P< 0.05,见图4);与术前相比,术后1 天、7 天、30 天、90 天、180 天腘窝和足背温度有所升高,但差异无统计学意义(见图5、6);与术前相比,术后1 天、7 天、30 天、90 天、180天各时间点第一足趾末端PI 明显增高(P< 0.01,见图7),同时PSQI 改善显著(P< 0.05,见图8)。

图2 双侧腰2 交感神经节穿刺

图3 术前、术后各时间点CST 变化(n = 23)
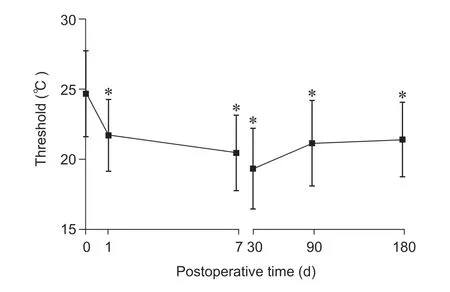
图4 术前、术后各时间点CPT 变化(n = 23)

图5 术前、术后各时间点腘窝温度变化 (n = 23)

图6 术前、术后各时间点足背温度变化(n = 23)
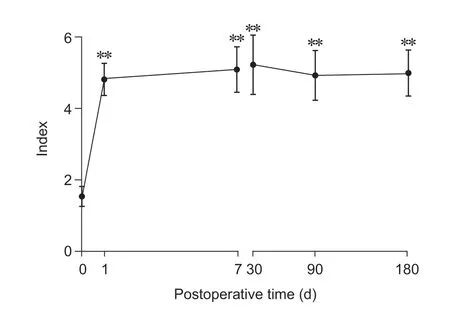
图7 术前、术后各时间点第一足趾末端PI 变化(n = 23)
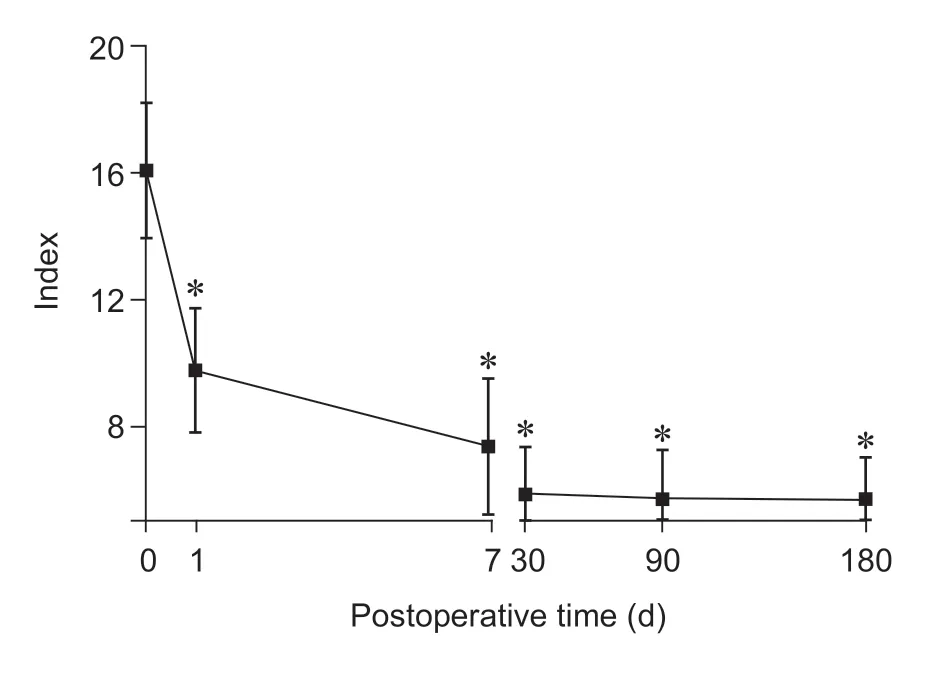
图8 术前、术后各时间点PSQI 变化(n = 23)
讨 论
腰交感神经毁损术是在CT 引导下,经皮穿刺采用无水乙醇等神经破坏药物对腰交感神经进行破坏、灭活,达到化学性切除腰交感神经的目的。目前该技术主要应用于多种下肢血管神经相关性病痛的治疗上,其疗效已得到较广泛认可。但临床上以下肢发凉、惧冷为突出表现的冷觉异常病人,经多学科诊治也难以见效,应引起临床医师的关注。目前下肢发凉、惧冷等温度觉异常的病因不明、发病机制复杂、相关基础和临床研究报告极少。
传统观点认为,导致下肢发凉的主要病因是下肢血管病变和组织缺血。腰交感神经毁损对交感神经可产生持久的阻滞效应,通过减少血浆内皮素(endothelin, ET) 的释放,使其与降钙素基因相关肽(calcitonin gene-related peptide, CGRP) 达到动态平衡,通过纠正血管活性物质代谢失衡,进一步改善下肢组织灌注,从而提高下肢皮温[4,5]。本研究发现术后1 天的腘窝和足背温度升高0.5~0.6 ℃以及第一足趾末端PI 显著增高,同时下肢发凉感转为热舒适。其机制与腰交感神经阻滞后、抑制其传出活动及交感神经节后 α1肾上腺素受体、引起下肢动脉扩张和血流增加密切相关[6]。本研究采用精确CT 引导下穿刺,在物理毁损(连续射频)的基础上联合化学毁损(无水乙醇),旨在达到彻底毁损腰交感神经,这种双重毁损的有效性与刘宏鹏[7]报道的治疗股骨头坏死疼痛一致。
本研究对象为双下肢动静脉血管彩超血管无显著病变、血运良好的下肢冷觉异常病人。因此,传统的血管病变并不是下肢发凉、惧冷的唯一因素,腰交感神经毁损对下肢冷觉异常的改善可能存在其他病理生理机制。Iwase 等[8]研究认为,神经功能异常时,背根神经节中的交感神经纤维芽生是交感-感觉耦联形成的主要机制,交感芽支形成篮状细胞样的突起围绕背根神经节的细胞体,形成二者间联系。交感神经持续阻滞在降低交感神经初级纤维反应性的同时,感觉冲动传递也受到抑制。冷感受器主要分布于皮肤和黏膜的C 神经纤维及Aδ 神经纤维的末梢上,低温刺激兴奋初级传入神经元的感觉神经末梢,随即产生动作电位,兴奋脊髓、脑干网状结构和下丘脑的冷敏感神经元,产生冷觉反应[9]。腰交感神经毁损后,可反馈性地作用于脊髓、脑干网状结构和下丘脑的交感神经中枢,调节冷觉的传导。有研究显示[10,11]:介导产生冷觉的受体是冷和薄荷醇受体-1 (cold and menthol receptors -1, CMR1),该受体也是瞬时感受器电位 (transient receptor potential, TRP) 兴奋性离子通道家族的成员,家族成员TRPM8 和TRPA1 是感受冷刺激的主要通道。TRPM8 主要参与非伤害性冷刺激及部分伤害性冷刺激的介导,温度在22~27℃可被激活,诱导冷觉感受,即产生发凉、惧冷感。本研究观察到病人术后第1 天开始的6 个月内的CST 和CPT 显著降低,表明腰交感神经毁损可降低下肢冷觉和冷痛觉阈值而改善下肢冷觉异常,但其具体机制需要深入研究,同时腰交感神经神经毁损可显著改善病人PSQI,提高睡眠质量。
综上所述,采用CT 引导下腰交感神经毁损对下肢冷觉异常安全显效。但由于本研究样本例数较少,学习曲线较陡,且观察指标有限,因此本研究还有一定的局限性,还需要进一步大样本、多指标的相关基础和临床研究。
