抑制芳香烃受体表达促进人脐带间充质干细胞的增殖和软骨分化
2021-08-31王新伟赵英杰李素素王越业贾成艳
王新伟,赵英杰,李素素,王越业,贾成艳,常 艳,魏 伟
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)可以从婴儿脐带组织中获得,具有良好的多向分化潜能,相较于其他来源间充质干细胞(mesenchymal stem cells,MSCs)成软骨分化能力更强,并且脐带组织临床上取材方便,所以hUC-MSCs目前被广泛用于软骨组织工程中。芳香烃受体(aryl hydrocarbon receptor,AhR)属于Per-Arnt-Sim同源域家族成员蛋白,是一种配体激活的核转录因子,可被污染物、微生物、食物和新陈代谢等提供的小分子活化。AhR参与许多重要的生物学过程,如细胞迁移和细胞分化并影响骨骼发育。已有研究表明AhR参与调控MSCs的成脂和成骨分化能力,但对其成软骨分化能力的影响还不清楚。基于以上研究背景,该研究使用小干扰RNA方法抑制hUC-MSCs中AhR的表达,观察AhR敲低后hUC-MSCs增殖以及成软骨分化能力的变化。
1 材料与方法
1.1 材料
hUC-MSCs由南京康雅生物科技有限公司提供;DMEM-F12培养基和软骨分化诱导培养基购自以色列BI公司;胎牛血清购自澳大利亚Science Cell公司;AhR-homo-1432 inhibitor 转染试剂、Lipofectamine2000及Opti-MEM购自上海吉凯基因生物科技有限公司;实时荧光定量PCR试剂盒和引物分别购自南京诺唯赞生物科技股份有限公司和上海生工生物股份有限公司;SOX-9和COL2A1抗体购自美国Santa Cruz公司;CCK-8检测试剂盒购自合肥鼎秀生物科技有限公司;阿利新蓝染色试剂购自武汉赛维尔生物科技有限公司;CD34、CD45、CD73和CD105流式抗体购自美国BioLegend公司;BCA蛋白含量检测试剂盒购自上海碧云天生物科技有限公司。1.2 主要仪器
Tecan Infinite M 1000 PRO酶标仪(瑞士Tecan);Olympus显微成像系统(日本Olympus);FC 500型贝克曼流式细胞仪(美国Beckman Coulter);7500荧光定量PCR仪(美国Thermo Fisher Scientific);LAS 4000 Mini型化学发光成像分析仪(美国GE Healthcare Life Sciences)。1.3 实验方法
1.3.1
hUC-
MSCs的表面分子标记物检测 采用流式细胞仪检测细胞表面分子标记物,取贴壁hUC-MSCs,0.25%胰酶消化重悬至1.5×10/ml,各管分别加入单克隆抗体 CD34、CD45、CD70和CD105,同时每管样品设立同型阴性对照。室温避光孵育45 min,用 PBS 洗去未结合抗体并重悬细胞,流式细胞仪进行检测分析。1.3.2
质粒转染hUC-
MSCs 用Opti-MEM稀释AhR-homo-1432 inhibitor 转染试剂及Lipofectamine2000,然后将转染试剂稀释液分别与Lipofectamine2000稀释液混合,当细胞融合度为30%时加入转染试剂混合液,37 ℃、5% CO条件下培养6 h后更换新鲜培养基继续培养。同法转染AhR-homo-1432 inhibitor control设为阴性对照组。1.3.3
细胞增殖能力检测 将hUC-MSCs以细胞密度为3.0×10个/孔接种于96孔板中培养,分为Control、si-NC和si-AhR组,每组设定6个副孔。按照上述方法转染细胞,细胞转染成功后继续培养用于CCK-8实验,每组检测4个时间点:第1、3、5和7天,λ=450 nm,测定OD值,绘制细胞生长曲线。1.3.4
诱导hUC-
MSCs成软骨分化 将hUC-MSCs以细胞密度为1.0×10个/孔接种于24孔细胞板中培养,分为Control、si-NC和si-AhR组,每组设定3个副孔。按照上述方法转染细胞,细胞转染成功后继续培养至细胞汇集度为80%,更换软骨分化诱导培养基培养7 d,3 d换一次液,用于下一步实验。1.3.5
RNA提取、cDNA合成及实时荧光定量PCR 各组hUC-MSCs软骨诱导分化培养7 d后,使用TRIzol试剂分别提取各组细胞总RNA,用HiScript®II Reverse Transcriptase试剂盒合成cDNA。配置实时荧光定量PCR反应体系,AceQ qPCR SYBR Green Master Mix 10 μl,DEPC水6.8 μl,上下游引物和50×ROX Reference Dye 1各0.4 μl,cDNA模板2 μl,体系总体积20 μl。置于美国赛默飞公司7500荧光定量PCR仪上进行反应,检测AhR、SOX-9和COL2A1的mRNA表达,si-NC组细胞作为阴性对照,GAPDH作为内参。所用引物均由上海生工生物工程公司设定,见表1。
表1 实时荧光定量PCR引物序列
1.3.6
Western blot 各组hUC-MSCs软骨诱导分化培养7 d后,弃去培养基并用PBS清洗,在24孔板每孔中加入适量的含有蛋白酶抑制剂的蛋白裂解液,冰上裂解30 min。将细胞刮下,收集于1.5 ml EP管并反复冻融,使细胞充分裂解。4 ℃、12 000 r/min离心15 min,取上清液。根据说明书,使用BCA蛋白浓度检测试剂盒对蛋白进行定量。在提取的上清液中加入蛋白上样缓冲液煮沸后得到蛋白样本。SDS-聚丙烯酰胺凝胶电泳法将蛋白转移至PVDF上,用5%的脱脂牛奶封闭2 h,与相应一抗4 ℃孵育过夜,与二抗结合2 h后,通过发光成像分析仪显影。1.3.7
阿利新蓝染色 各组hUC-MSCs软骨分化诱导7 d后,弃去培养基并用PBS清洗,在24孔细胞板中每孔加入4%中性甲醛固定30 min,然后加入阿利新蓝染色液染色30 min,PBS清洗后镜下观察。
2 结果
2.1 hUC-MSCs鉴定
流式细胞仪检测hUC-MSCs表面分子标记物CD34、CD45、CD73和CD105的表达。其中CD34表达0.6%,CD45表达1.5%,二者均呈阴性表达(阴性率<5%),CD73表达99.8%,CD105表达99.2%,二者均呈阳性表达(阳性率>95%),这与MSCs的特点相符(图1)。
图1 流式细胞仪检测hUC-MSCs表面分子标记物表达
2.2 hUC-MSCs转染效率
显微镜下观察可发现hUC-MSCs大多以多角形或梭形为主,细胞大小均一,胞质丰富,胞核大且核仁清晰。与Control组比较,转染后第5天的hUC-MSCs形态无变化。实时荧光定量PCR测定转染效率结果表明:与Control组比较,si-NC组AhR的mRNA表达差异无统计学意义(P
>0.05);而与si-NC组比较,si-AhR组AhR的mRNA表达明显降低(F
=8.658,P
<0.05)。Western blot测定转染效率结果表明:与Control组比较,si-NC组AhR的蛋白表达差异无统计学意义(P
>0.05);而与si-NC组比较,si-AhR组AhR的蛋白表达明显降低(F
=6.798,P
<0.05)。以上结果说明转染AhR-homo-1432 inhibitor可以有效沉默hUC-MSCs中的AhR表达(图2~4)。
图2 正常hUC-MSCs与转染后hUC-MSCs ×100A:Control组;B:si-NC组;C:si-AhR组
2.3 AhR干扰后hUC-MSCs的增殖反应
CCK-8测定结果显示转染后第1天起,si-NC组hUC-MSCs的细胞活力与Control组比较差异无统计学意义;而si-AhR组hUC-MSCs的细胞活力与si-NC组比较有升高,且在第5天和第7天差异有统计学意义(F
=7.449,P
<0.05;F
=6.414,P
<0.05)。见图5。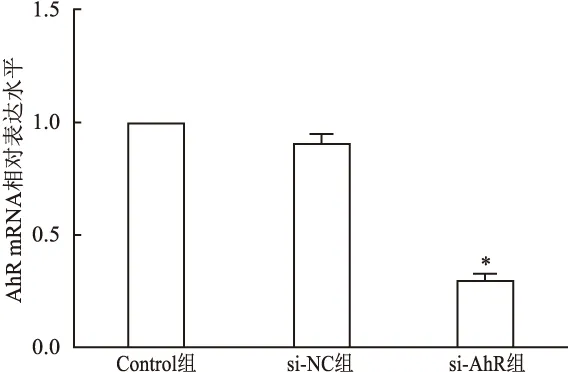
图3 转染后hUC-MSCs的AhR mRNA表达与si-NC组比较:*P<0.05
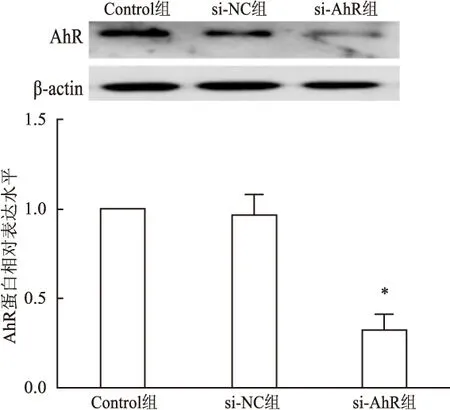
图4 转染后hUC-MSCs的AhR蛋白表达A:Western blot检测β-actin和AhR的表达;B:根据A的结果进行条带灰度分析;与si-NC组比较:*P<0.05
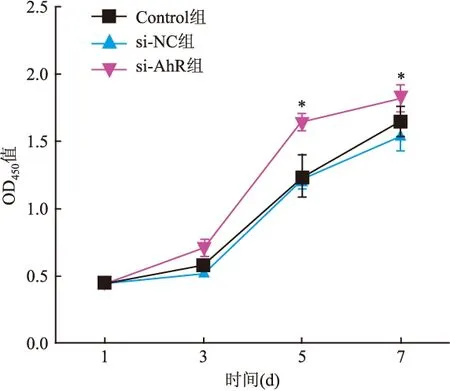
图5 AhR干扰后hUC-MSCs的细胞活力与si-NC组比较:*P<0.05
2.4 AhR干扰后hUC-MSCs软骨分化标志物SOX-9和COL2A1的mRNA和蛋白表达
实时定量荧光PCR结果显示:与Control组比较,si-NC组的SOX-9和COL2A1 mRNA表达差异无统计学意义(P
>0.05);而与si-NC组比较,si-AhR组SOX-9和COL2A1 mRNA表达明显升高,差异有统计学意义(F
=12.258,P
<0.05;F
=13.124,P
<0.05)。Western blot结果表明:与Control组比较,si-NC组的SOX-9和COL2A1在蛋白水平上表达差异无统计学意义(P
>0.05);而与si-NC组比较,si-AhR组SOX-9和COL2A1在蛋白水平上表达明显升高,差异有统计学意义(F
=9.323,P
<0.05 ;F
=6.750,P
<0.05)(图6、7)。
图6 AhR干扰后SOX-9和COL2A1 的mRNA表达与si-NC组比较:*P<0.05
2.5 AhR干扰后hUC-MSCs蛋白聚糖表达
软骨分化诱导7 d后,进行阿利新蓝染色,可见Control、si-NC和si-AhR组均有蓝染,si-NC组与Control组蓝染差异无统计学意义;si-AhR组与si-NC组比较,蓝染明显增强,蛋白聚糖含量增多,说明hUC-MSCs软骨分化程度更高(图8)。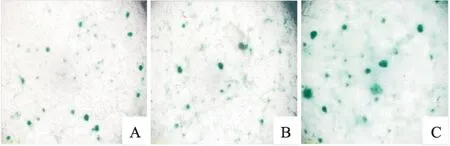
图8 hUC-MSCs成软骨诱导后阿利新蓝染色结果A:Control组; B:si-NC组;C:si-AhR组
3 讨论
关节软骨主要由软骨细胞和细胞外基质组成,无血管和神经系统,软骨细胞增殖能力极弱且缺乏再生能力,导致软骨损伤后难以自我修复。目前临床治疗关节软骨损伤的方法有骨髓刺激修复和软骨细胞移植修复,但取得的软骨修复效果不能让人满意。随着科学技术的发展,基于干细胞的相关疗法为治疗软骨损伤提供了新的治疗方向。MSCs作为一种多功能干细胞,具备自我更新和多向分化功能,可分化为骨细胞和软骨细胞,修复受损软骨组织,同时还具有抗炎和免疫调控功能,这为软骨损伤的治疗带来新方向和新思路。hUC-MSCs来源于新生儿脐带,具备MSCs的各种特性,且与其他来源的MSCs比较,具备更强的分化和增殖能力,因此更具有临床应用价值。
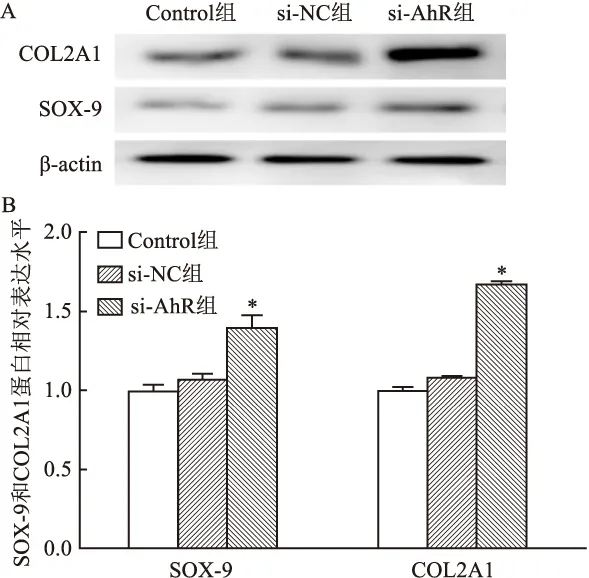
图7 AhR干扰后SOX-9和COL2A1的蛋白表达A:Western blot检测β-actin、SOX-9和COL2A1的表达:B:根据A的结果进行条带灰度分析;与si-NC组比较:*P<0.05
在本研究中,为了探究AhR对hUC-MSCs增殖和软骨分化的影响,通过小干扰抑制hUC-MSCs中AhR的表达,用CCK-8法检测hUC-MSCs增殖能力的变化,结果表明在第5天和第7天,AhR干扰的hUC-MSCs细胞活力增强。软骨分化诱导培养7天检测相关指标,结果表明AhR干扰的hUC-MSCs软骨分化标志物SOX-9和COL2A1的mRNA和蛋白表达量增加,蛋白聚糖表达增多,提示AhR干扰后的hUC-MSCs的软骨分化能力更强。综上所述,通过干扰AhR表达可以促进hUC-MSCs的增殖和软骨细胞分化能力,提示AhR可作为调控hUC-MSCs软骨分化的潜在靶点,值得进一步研究和确认,这对于软骨损伤相关疾病的治疗和预防有着重要意义。
