植物乳杆菌AR495抑制巨噬细胞RAW264.7 向破骨细胞分化的研究
2021-08-30孙文妮谭卓铭文富民陈乐荫王光强艾连中夏永军上海理工大学医疗器械与食品学院上海食品微生物工程技术研究中心上海200093
孙文妮, 杨 茜, 谭卓铭, 文富民, 陈乐荫, 于 婧, 王光强, 艾连中, 夏永军 上海理工大学医疗器械与食品学院 上海食品微生物工程技术研究中心,上海 200093
骨质疏松症是由于人体骨代谢异常所致的全身性骨量减少,骨骼微细结构破坏,骨脆性增加导致骨折危险性明显增加的一种疾病[1]。破骨细胞是一种巨大的多核细胞,起源于单核巨噬细胞/单核系造血前体细胞,在骨吸收过程中破骨细胞的形成和活性异常可导致骨质疏松[2]。目前对骨质疏松患者的治疗主要用激素替代疗法,在长期服用过程中会增加患乳腺癌和心血管疾病的风险[3]。
益生菌是一类对宿主有益的微生物[4],其中包括多种不同种属的微生物,如乳酸菌、肠球菌、双歧杆菌等[5]。益生菌具有调节肠道菌群平衡、保护肠道黏膜屏障、提高机体免疫力、产生抗菌化合物抵御病原体侵害等多种作用[6]。大量研究证明,乳酸菌对高胆固醇、动脉粥样硬化、高血压与糖尿病等疾病有较好的改善作用[7]。
益生菌的状态对其功能发挥有重要影响。在临床实验中,口服巴氏灭活的阿克曼氏菌具有降低总胆固醇、减轻体重、减少脂肪量和髋部周长等效果,而活菌却没有这些功效[8]。一些乳酸菌如干酪乳杆菌、嗜酸乳杆菌和鼠李糖乳杆菌细胞壁可通过调节免疫炎症和氧化应激来减轻LPS诱导的结肠炎[9]。发酵乳杆菌的细胞壁蛋白能够粘附于派尔淋巴结(PPs)上诱导Th1型反应而抑制病原体[10]。
近年来研究发现,益生菌在缓解骨质疏松方面有较好的应用潜力[11]。鼠李糖乳杆菌[12]、副干酪乳杆菌[13]和嗜酸乳杆菌[14]等均被证实能够通过免疫调节来减少骨吸收,抑制破骨细胞生成。课题组前期研究筛选获得一株具有缓解骨质疏松功能的植物乳杆菌AR495,能够减少小鼠骨质流失。但其对破骨细胞的分化以及相应通路未知。本文考察了植物乳杆菌AR495不同处理方式(活菌、死菌等)对核因子-κB受体活化因子配基(RANKL)诱导的RAW264.7细胞向破骨细胞分化的影响,为解析其缓解骨质疏松机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1菌株
植物乳杆菌AR495系从发酵食品中筛选获得,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.14004。
1.1.2主要试剂和仪器
SYBR Green(上海翌圣生物技术有限公司,中国);DMEM完全培养基、胎牛血清、胰蛋白酶、PBS缓冲液、RANKL(美国GIBCO);MRS培养基(北京陆桥技术股份有限公司,中国);抗酒石酸酸性磷酸酶染液(南京建成生物工程研究所,中国);CCK8检测试剂盒、抗酒石酸酸性磷酸酶试剂盒(上海碧云天生物技术有限公司,中国);RAW 264.7细胞株(中国科学院上海生命科学研究院细胞资源中心,中国);IL-1β ELISA快速检测试剂盒、TNF-α ELISA快速检测试剂盒(上海通蔚生物科技有限公司,中国)。Trizol、异丙醇、三氯乙酸、无水乙醇和DEPC水均购自生工(上海,中国)。HPX.9162MBE型电热恒温培养箱 (上海沪粤明科学仪器有限公司,中国);SpectraMax i3x型酶标仪(奥地利美谷分子);UV2600型紫外分光光度计(日本岛津);湘仪L500台式低速自动平衡离心机(湖南湘仪实验室仪器开发有限公司,中国);Ruskinn 低氧厌氧培养工作站(英国Ruskinn);LightCycle96实时荧光定量PCR仪(瑞士Roche公司);Bio-rad S1000梯度PCR仪(美国伯乐Bio-rad);倒置显微镜(DMi8,德国Leica公司);自动细胞计数器(Countess Ⅱ,美国Invitrogen公司)。
1.2 方法
1.2.1不同活性成分分组及其处理方法
将活化后的AR495接种至液体MRs培养基中,培养18 h,取1 mL培养液4 000 r/min离心10 min,取上清;将沉淀用无菌的PBS洗涤2次后重悬,得活菌;重悬后的菌体于100 ℃中水浴中热灭活5 min;重悬后的死菌超声破碎45 min,4 000 r/min离心10 min,取上清得胞内物;取沉淀得细胞壁。将除活菌和死菌外的组分过0.44 mm水相滤头除菌。其中发酵液组以MRs培养基作为对照,消除培养基成分的干扰。

表1 不同活性成分分组及其处理方法
1.2.2细胞活力测定
将RAW264.7细胞以1×104cell/mL的浓度铺于96孔板中,以DMEM完全培养基进行培养,然后分为8组,设5副孔,第1组设置为空白对照,第2组为RANKL诱导组,第3至8组为RANKL+活性成分组,第2至8组均以50 ng/mL RANKL诱导5 d,第3至8组于第3 d时加入不同组分共培养,且添加不同组分的组均调整到细胞浓度为106CFU/mL。第5 d,每孔加入10 μL CCK8试剂,于37 ℃培养箱避光孵育1 h后在450 nm下测吸光度[15]。
1.2.3细胞计数与细胞形态学观察
将RAW264.7细胞以1×104cell/mL的浓度铺于加细胞爬片的12孔板中,细胞分组方法同1.2.2。第5 d时,取出细胞爬片,按照抗酒石酸酸性磷酸酶染液试剂盒操作说明书进行染色。倒置显微镜观察,拍照。每个处理条件拍8个随机视野,对细胞核数量大于2个的多核破骨细胞进行计数[16]。
1.2.4TRAP酶活测定
将RAW264.7细胞以1×104cell/mL的浓度铺于每孔含有2 mL DMEM完全培养基的12孔板中。细胞分组方法同1.2.2。第5 d时取培养液上清。按试剂盒操作说明书中步骤检测TRAP酶活力[17]。
1.2.5ELISA测定细胞因子
取不同组分共培养5 d后的细胞培养液,离心获取上清。用ELISA快速检测试剂盒检测细胞因子IL-1β与TNF-α的含量[18]。
1.2.6实时荧光定量
将RAW264.7细胞以1×104cell/mL的浓度铺于12孔板中,在与不同组分共培养5 d后,每孔中加入1 mL Trizol,轻轻吹打细胞,收集液体于1.5 mL离心管内,于-80 ℃冰箱保存。Trizol法提取细胞的RNA,反转录获得cDNA,进行实时荧光定量。

表2 实时荧光定量使用的引物
1.2.7数据统计分析
所有数据以均值±标准误表示。使用统计软件SPSS22.0对数据进行单因素方差分析(One-way ANOVA),当P<0.05有统计学差异。
2 结果与讨论
2.1 植物乳杆菌AR495对RAW264.7细胞活力的影响
CCK-8试剂盒常被用于药物筛选,可以测定在不同浓度药物下细胞的存活率。由表3可以看出,在AR495的菌浓为106CFU/mL时,不同组分和RAW264.7细胞共培养都会降低细胞的相对活力。其中除模型组外,与巨噬细胞共培养的各组分之间均无显著差异。这说明各组分对细胞的活力影响相似,排除了细胞相对活力对其他指标的影响。
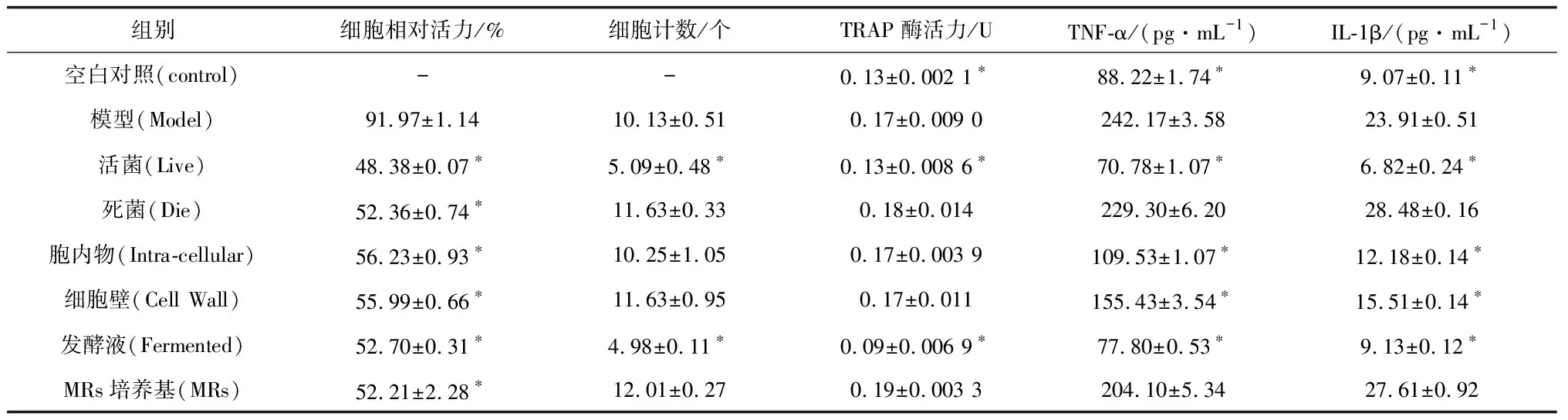
表3 植物乳杆菌AR495与RAW264.7共培养后RAW264.7向破骨细胞分化的相关指标
2.2 植物乳杆菌AR495对RAW264.7细胞形态影响
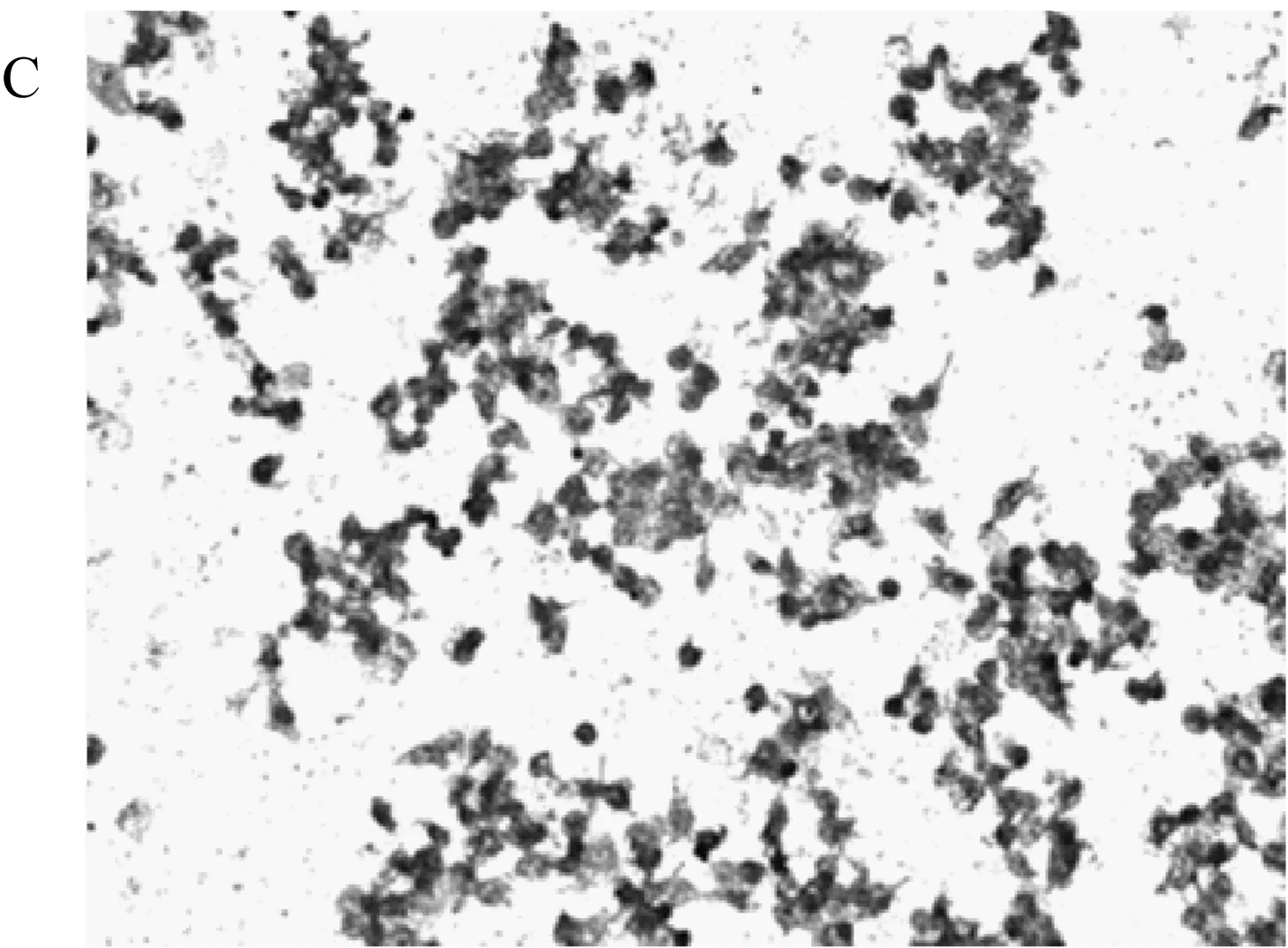
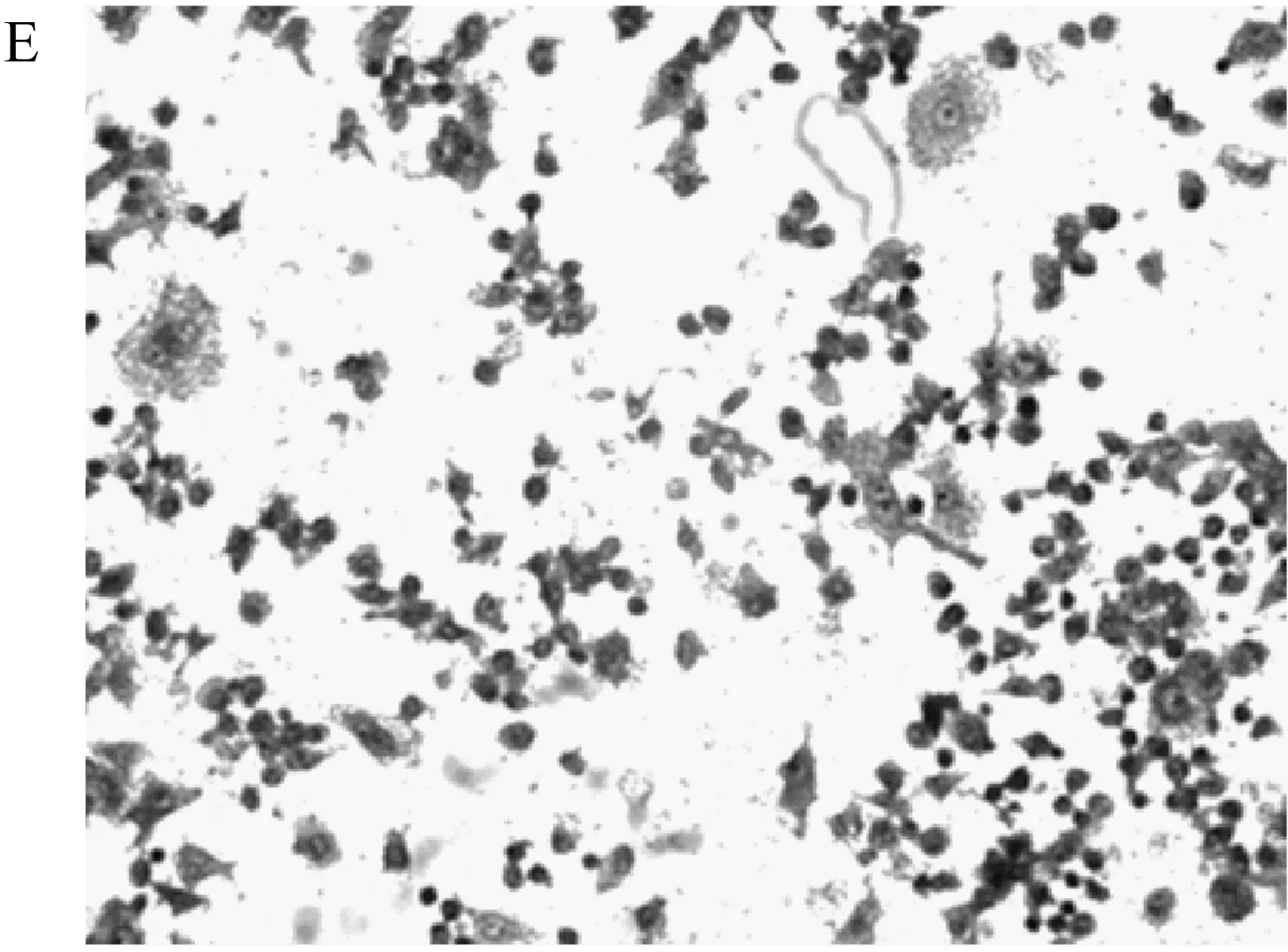
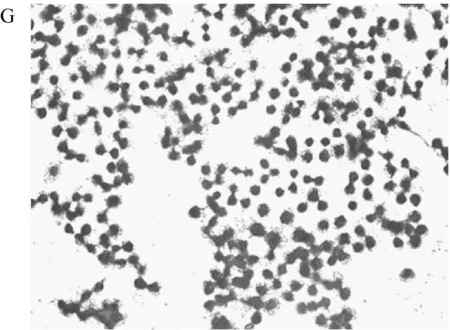
破骨细胞分化的镜检结果能直观的显示不同组分对破骨细胞分化的抑制效果。不同组分与巨噬细胞RAW264.7共培养的结果在200倍镜头下如图1所示。图中深色单核圆形的细胞为未分化的RAW264.7细胞,颜色较浅的多核不规则细胞为分化后的破骨细胞。从不同处理组共培养后细胞的染色图中可以看出,在AR495活菌与发酵液处理组中,每个视野下的破骨细胞数量明显低于其他各组。巨噬细胞RAW264.7经过RANKL诱导后,RANKL与巨噬细胞表面的RANK配体结合,启动破骨前体细胞的分化,并最终融合成多核的破骨细胞[19]。而AR495活菌与发酵液均能有效的抑制这种分化的过程。
由每个视野下破骨细胞数量的统计结果(表3)可看出,活菌组的破骨细胞数量降低了49.75%,发酵液组的破骨细胞数量降低了50.84%,而其他组的破骨细胞数量相对于模型组没有显著性差异。SUN[20]等利用神经肽FF干预破骨细胞分化,细胞形态变化与本研究抑制,同样减少了多核破骨细胞数量。
2.3 植物乳杆菌AR495对RAW264.7 TRAP酶活影响
抗酒石酸酸性磷酸酶(TRAP)是一种糖基化的含金属蛋白酶,在破骨细胞中高度表达,抗酒石酸酸性磷酸酶可以被破骨细胞释放到血液中,几乎被认为是是机体破骨活性的唯一血液指标[21]。表3为植物乳杆菌AR495不同处理组与巨噬细胞共培养后,每孔细胞内产生的TRAP酶活力变化。由表3可知,活菌组与发酵液组的TRAP酶活力与模型组相比降低了20.89%与49.24%,而其余各组分的TRAP酶活力与模型组相比,都不具有显著性差异。发酵液组表现出了比活菌组更好的抑制TRAP酶的表达的能力,有效的抑制了破骨细胞的分化。与黄俊飞[22]等人施用西瑞香素抑制TRAP酶活力的结果相一致。

2.4 植物乳杆菌AR495对RAW264.7细胞炎症因子影响
肿瘤坏死因子-α(TNF-α)可介导白介素-1β(IL-1β)等细胞因子的产生,这些因子在协同作用下,会诱导破骨细胞前体分化为破骨细胞[23]。因此评价了AR495不同组分对细胞因子TNF-α与IL-1β的抑制作用。如表3所示,活菌组相对于模型组TNF-α与IL-1β的含量分别降低了141.39 pg/mL和17.09 pg/mL;发酵液组相对于模型组TNF-α与IL-1β的含量分别降低了164.37 pg/mL和14.78 pg/mL,这两组与空白组之间均没有显著性差异,说明细胞内TNF-α与IL-1β的表达被抑制到与正常巨噬细胞接近的水平。而其他各组如细胞壁与胞内物组虽然相比模型组显著性的抑制了TNF-α与IL-1β的表达,但是没有活菌组与发酵液组的抑制效果更明显。活菌与发酵液这两种组分都显示出了对促进破骨细胞分化的细胞因子的显著抑制效果。
2.5 植物乳杆菌AR495对RAW264.7相关通路基因表达影响
图2显示了与AR495不同处理组与巨噬细胞共培养后细胞内信号蛋白的相对表达情况,与模型组相比较,活菌组与发酵液组均显著性的抑制了TLR4、MyD88、TRAF6、NF-κB信号蛋白的表达。

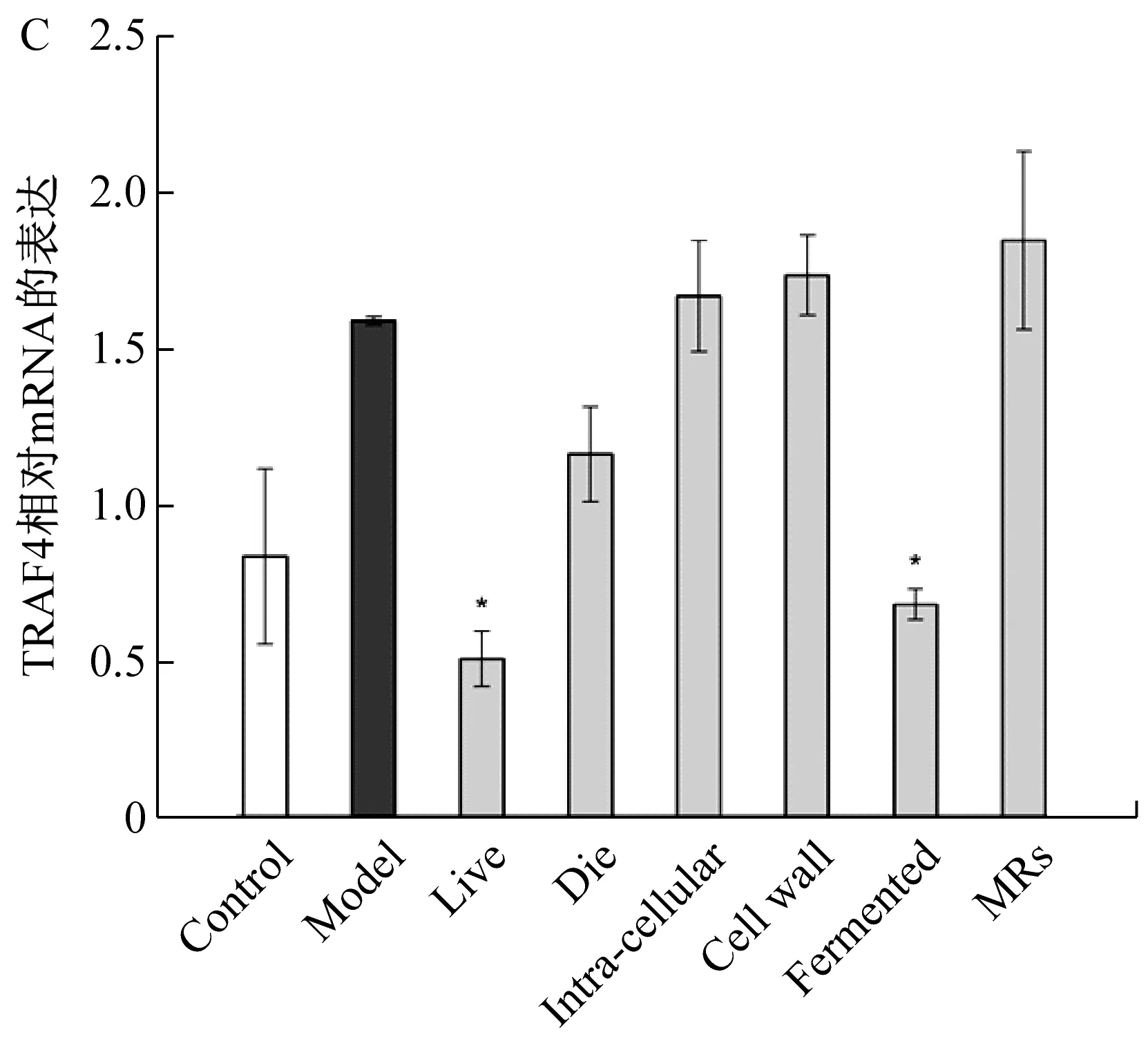
核因子κB受体活化因子配体(RANKL)能够特异性的结合并激活破骨前体细胞膜上的核因子κB受体活化因子配基(RANK),TNF受体相关因子6(TRAF-6)将RANK的信号直接刺激NFκB的活化,并转运活化后的NFκB进入细胞核,诱导了破骨细胞的形成,增强骨代谢机制[24]。去甲异波尔定同样通过调节此通路抑制了破骨细胞分化[25]。Toll样受体4(TLR4)介导的髓样分化因子88(MyD88)依赖途径会活化核因子κB(NF-κB)[26],这是一条重要的炎症通路。活菌与发酵液组对该条通路的调节与VIJAYAN[27]等人研究蛋氨酸下调破骨细胞前体中的TLR4/MyD88/NF-κB信号传导的结果相一致。而NF-κB是RANKL/TRAF 6通路与TLR4/MyD88通路的交汇点,这两条通路共同通过NF-κB介导下游的信号因子,诱导破骨细胞分化,引起炎症反应。从结果中可以看出,这两种组分是通过分别调节RANKL/TRAF6通路与TLR4/MyD88通路来共同抑制破骨细胞分化的。
3 结论
本实验通过分析巨噬细胞活力与形态、TRAP酶活力以及细胞炎症因子结果表明,AR495的活菌与发酵液均能显著的抑制TRAP酶的活力以及破骨细胞的分化,抑制细胞因子TNF-α与IL-1的产生。同时通过调节RANKL/TRAF 6通路与TLR4/MyD88通路蛋白的表达来抑制破骨细胞的分化。本研究为进一步解析植物乳杆菌AR495缓解骨质疏松机制奠定了基础。
