藜麦甾醇提取工艺优化及脂肪酸组成分析
2021-08-27刘雅谦李琳孙万成罗毅皓
刘雅谦,李琳,孙万成,罗毅皓
(青海大学农牧学院,青海 西宁 810016)
藜麦(Chenopodium quinoa)是一种古老的假谷物,属于黎科,主要分布在我国的甘肃、青海、内蒙古等地。藜麦富含蛋白质、脂类、纤维素、维生素和矿物质,对极端的环境条件有很好的适应性[1-2],已有大量的研究报道了藜麦的营养价值,但对于藜麦油脂的研究较少见。研究表明[3],藜麦油脂中包含大量的生物活性化合物(包括棕榈酸、长链脂肪酸、植物甾醇、角鲨烯),可应用于功能性食品开发[4]。
植物甾醇(phytosterol,PS)是植物细胞膜的重要结构成分,被誉为“生命的钥匙”,已有大量的报道[5]证明植物甾醇具有降低低密度脂蛋白胆固醇的特性。近年来对于藜麦具有的抗氧化[6]、抗炎[7]、抗肿瘤[8]及促进动物生长[9]等功能特性也相继被证实。目前提取植物甾醇的方法,提取率相对较低且溶剂耗费较大,如溶剂提取法、超声波辅助提取法和皂化法等。
超临界CO2提取技术可以排除残留液体溶剂的污染,且具有更高的扩散率(10-4cm2/s)[10],对于亲脂性化合物有更高的亲和力[11]。超临界CO2提取技术通过改变温度和压力来调节溶剂溶解力,以获得高纯度的脂质;通过降低压力将溶解的溶质从CO2中分离出来[12]。华正根等[13]从灵芝中提取三萜和甾醇成分,发现超临界CO2萃取法的提取效果显著大于乙醇回流法。超临界CO2萃取法适用于大规模提取不同类型的基质,用于生产食品、药品、化妆品和其它高价值的脂质和生物活性物质[14]。目前有关超临界CO2-皂化法协同辅助提取植物甾醇的研究鲜有报道。因此本试验探究超临界CO2法和皂化法协同提取藜麦甾醇的工艺条件,并对藜麦油脂中的脂肪酸进行成分分析,以期为藜麦资源的深度开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
藜麦:市售;β-谷甾醇标准品(≥98%):北京世纪奥科生物技术有限公司;三氯化铁(FeCl3·6H2O)、浓磷酸、浓硫酸、无水乙醇、正己烷、甲醇、三氟化硼:天津巴斯夫化学试剂有限公司;无水硫酸钠、氢氧化钾:唐山三孚硅业股份有限公司;二氧化碳(纯度>99.99%):西宁磊豪商贸有限公司;所有试剂均为分析纯。
1.1.2 仪器与设备
超临界萃取装置(Spe-ed SFE-NP):上海帝博思生物科技有限公司;可见分光光度计(722N):上海佑科仪器仪表有限公司;电热鼓风干燥箱(DGX-9073B):上海南荣实验室设备有限公司;氮吹仪(DN-12A):上海比朗仪器制造有限公司;气质联用仪(TSQTM9000):赛默飞世尔科技有限公司;数显恒温水浴锅(HH-6):常州金坛良友仪器有限公司;旋转蒸发仪(RE-2000A):济南欧莱博科学仪器有限公司;台式高速冷冻离心机(TCL-16M):上海卢湘仪离心机仪器有限公司。
1.2 试验方法
1.2.1 藜麦甾醇的提取
将藜麦清洗除杂,烘箱干燥后,粉碎机粉碎,过40目筛。准确称取30 g藜麦粉置于超临界CO2萃取釜中,在一定的压力和温度下萃取一段时间后得到藜麦油脂,将藜麦油脂进行离心,离心后的上清液放入具塞试管中,加入2 mol/L KOH-乙醇溶液,在70℃水浴锅内进行皂化2 h,冷却后,将其转移至分液漏斗,加入正己烷,振摇数分钟,将正己烷层取出,旋转蒸发正己烷,用无水乙醇溶出,最终定容至10 mL。以备藜麦甾醇含量的测定。以萃取温度、萃取时间、萃取压力为因素,考察不同条件下藜麦甾醇得率。
1.2.2 单因素试验
本研究以萃取压力、萃取温度、萃取时间为单因素进行试验,并计算藜麦甾醇的得率,确定最优工艺条件。单因素试验水平参照文献[17]设计,CO2流量控制为5 mL/min。固定条件:萃取压力25 MPa,萃取温度50℃,萃取时间2 h,选取一个因素为变量,固定另外两个条件。分别考察不同萃取压力(15、20、25、30、35 MPa)、不同萃取温度(40、45、50、55、60 ℃)、不同萃取时间(1.0、1.5、2.0、2.5、3.0 h)对藜麦甾醇得率的影响。
1.2.3 正交试验
在超临界CO2-皂化法提取藜麦甾醇单因素试验基础上,设计三因素三水平L9(33)正交试验表来确定藜麦甾醇提取的最佳方案。试验因素水平表见表1。

表1 正交试验因素水平Table 1 Factor level of orthogonal test
1.2.4 藜麦甾醇得率的测定
精确称取5 mL的藜麦甾醇提取物样品溶液,用无水乙醇进行稀释,利用硫磷铁法检测样品溶液,在530 nm处测定吸光值,配制一系列浓度梯度β-谷甾醇溶液,绘制吸光度-β-谷甾醇浓度标准曲线,利用回归方程求出藜麦甾醇的质量浓度,具体方法见参考文献[15],计算公式如下。

式中:X为藜麦甾醇得率,mg/g;C为提取液吸光度对应甾醇标准溶液质量浓度,mg/mL;V为定容体积,mL;B为稀释倍数;M为藜麦油脂的质量,g。
1.2.5 气相色谱串联质谱法(gas chromatography-mass spectrometer,GC-MS)前处理及分析
GC-MS前处理及分析参考文献[16]中的方法。
1.2.6 数据分析
试验数据采用IBM SPSS Statistics 23软件和Excel软件进行数据处理与分析。每个样品重复测定3次,数据用平均值±标准差的形式表示。
2 结果与分析
2.1 β-谷甾醇标准曲线
β-谷甾醇标准曲线见图1。

图1 β-谷甾醇标准曲线Fig.1 The standard curve of β-sitosterol
由图1得到回归方程y=15.564x-0.003 8,相关系数R2为0.999,根据方程可知β-谷甾醇标准曲线的回归性较好,可进行定量分析。
2.2 单因素试验分析
2.2.1 萃取压力对藜麦甾醇提取效果的影响
不同萃取压力对藜麦甾醇得率的影响见图2。

图2 不同萃取压力对藜麦甾醇得率的影响Fig.2 Effect of different extraction pressure on the yield of quinoa sterol
由图2可知,藜麦甾醇得率随着萃取压力的增加呈现出先上升后下降的趋势。随着萃取压力的增大,藜麦甾醇得率逐渐提高,这可能是由于压力的增加导致CO2的密度增大,被萃取物的溶解度增加,在压力为25 MPa时,藜麦甾醇得率达到最大值,为19.56 mg/g。但当压力继续增高,藜麦甾醇得率开始下降,可能是由于随着萃取压力的增加,CO2气体的扩散系数下降,从而不利于藜麦甾醇的提取。因此选择萃取压力为25 MPa。
2.2.2 萃取温度对藜麦甾醇提取效果的影响
萃取温度也是影响超临界CO2萃取能力的主要因素之一。系统温度的升高会降低CO2的密度,这可能导致溶剂的溶解能力降低[18]。另一方面,温度升高会增加扩散率和蒸汽压力,从而有助于分子轻松释放到溶剂中。因此,施加温度的净效应取决于分子蒸汽压和萃取剂密度的变化[19]。不同萃取温度对藜麦甾醇得率的影响见图3。
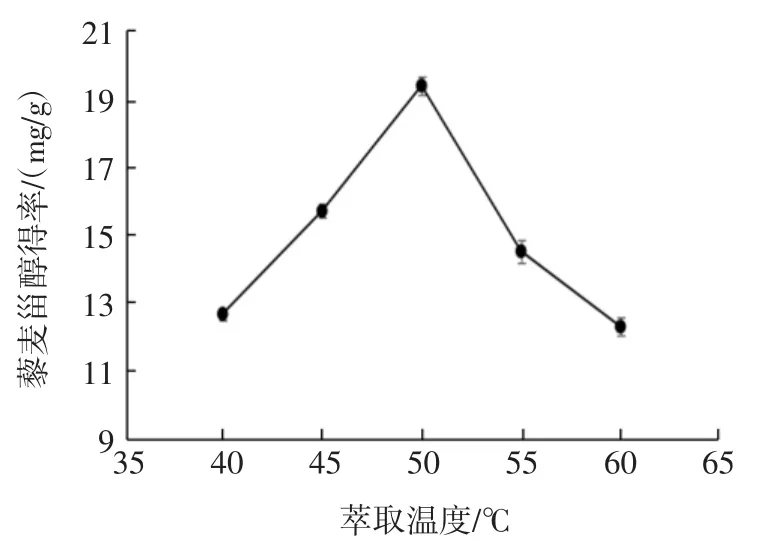
图3 不同萃取温度对藜麦甾醇得率的影响Fig.3 Effect of different extraction temperature on the yield of quinoa sterol
由图3可知,在40℃~50℃范围内,随着温度的升高,藜麦甾醇得率逐渐增加。在50℃时达到最大值,为19.44 mg/g。在50℃~60℃范围内,随着温度继续升高,藜麦甾醇得率开始下降,此阶段可能是CO2密度起主要作用。因此选取萃取温度为50℃。
2.2.3 萃取时间对藜麦甾醇提取效果的影响
不同萃取时间对藜麦甾醇得率的影响见图4。

图4 不同萃取时间对藜麦甾醇得率的影响Fig.4 Effect of different extraction time on the yield of quinoa sterol
由图4可知,萃取时间在1.0 h~2.0 h内,随着萃取时间的延长,藜麦甾醇得率逐渐增加,2.0 h后保持稳定,分析原因可能是,在1.0 h~2.0 h内,CO2流体逐渐进入到物料中,并将物料内成分溶解,最后通过强大的气流将藜麦甾醇萃取出来,当时间到达2.0 h时,藜麦甾醇几乎全部被萃取出,考虑到过高的时间浪费成本,因此选取萃取时间为2.0 h。
2.3 正交试验分析
根据单因素试验结果确定出超临界CO2-皂化法提取藜麦甾醇的适宜条件为:萃取压力25 MPa,萃取温度50℃,萃取时间2 h,在此基础上以藜麦甾醇得率为评价指标进行正交试验。正交试验结果见表2,正交试验中各检测指标方差分析结果见表3。

表2 正交试验结果Table 2 Results of orthogonal experiment

表3 藜麦甾醇得率方差分析Table 3 Variance analysis of quinoa sterol extraction rate
由表2分析可知,根据K1、K2、K3可以确定出萃取藜麦甾醇的最优试验组合为A2B2C3,即萃取压力为25 MPa,萃取温度为50℃,萃取时间为2 h。这3个因素对藜麦甾醇得率的影响大小顺序为:A>C>B,即萃取压力>萃取时间>萃取温度。按照最优的工艺进行验证试验,平均操作3次,藜麦甾醇的得率为20.20 mg/g。此时藜麦甾醇的得率最高,与正交试验优化出的结果相同,表明该工艺的稳定可行。李会珍等[20]采用超声波辅助萃取法提取紫苏中的甾醇,最终紫苏甾醇得率可达2.604 mg/g。李波等[21]采用微波辅助提取法提取大豆油中植物甾醇,提取率可达到36.22%。还有研究表明[22]利用皂化-超声波法提取玉米须中的植物甾醇,得率可达10.588 6 mg/g。马永芹[23]利用超临界CO2萃取米糠甾醇油,在最佳的工艺条件下制取米糠油中甾醇含量为2.274%,研究结果的不尽相同可能与原料中甾醇的含量以及提取方法的不同有关。本试验利用超临界CO2-皂化法提取藜麦中的甾醇,藜麦甾醇的得率相对较高,该提取方法可能优于超声波辅助提取法和微波辅助提取法。
F检验结果表明,萃取压力、萃取温度和萃取时间对藜麦甾醇得率的影响有显著性差异(p<0.05)。
2.4 气相色谱-质谱检测
利用GC-MS对藜麦油脂进行成分分析,得到藜麦油脂的色谱图见图5,脂肪酸组成成分分析见表4。

表4 藜麦油脂GC-MS成分分析Table 4 GC-MS analysis of components of quinoa oil
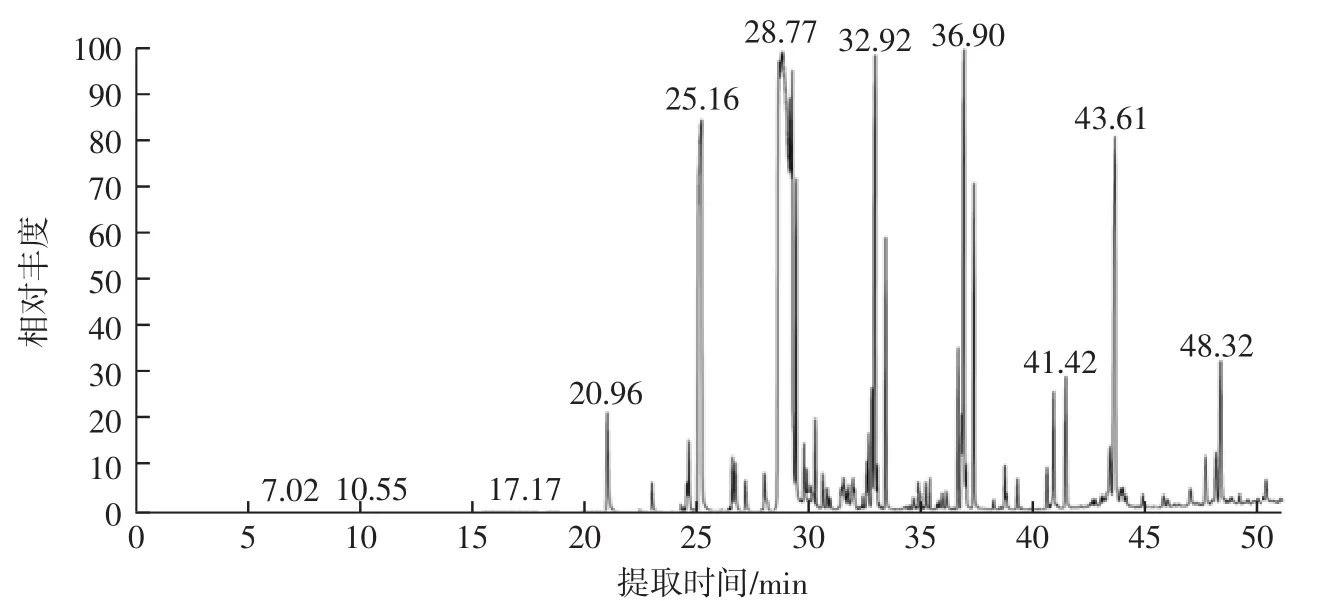
图5 GC-MS色谱图Fig.5GC-MS chromatogram
从表4中可以看出藜麦油脂中一共有29种脂肪酸,饱和脂肪酸的含量为25.59%,不饱和脂肪酸的含量为74.59%,单不饱和脂肪酸的含量为28.70%,多不饱和脂肪酸的含量为45.89%,超长链脂肪酸的含量为27.66%,支链脂肪酸的含量为0.63%。多不饱和脂肪酸中以常规的偶数碳脂肪酸为主。饱和脂肪酸中棕榈酸的含量最高,不饱和脂肪酸中亚油酸含量最高。藜麦油脂中主要的脂肪酸为亚油酸、亚麻酸和油酸,棕榈酸的含量相对较低,其中还检测到二十烯酸和介酸,这与Chen等[3]对藜麦采用气相色谱法分析的结果相似。亚油酸是藜麦油脂中含量最多的脂肪酸,Ryan等[25]利用溶剂提取法提取藜麦油脂,气相色谱法测定藜麦油脂中脂肪酸,结果同样发现亚油酸(48.07%)含量最高,其次是油酸(29.49%)和棕榈酸(9.18%)含量较高,结果与本次研究结果有差异,可能与藜麦品种以及提油方法不同有关。另外,本次检测结果中含有0.63%的支链脂肪酸,这是其他研究人员对于藜麦脂肪酸分析中尚未见报道的。
从表4中可以看到参考文献[24]中研究人员对藜麦油脂脂肪酸检测的结果,一共检测出26种脂肪酸,检测出的脂肪酸种类与本次研究结果相似,但也具有一定的差异,其中亚麻酸的含量为30.96%,亚油酸的含量为21.94%。棕榈酸的含量为7.15%,超长链脂肪酸的含量为15.37%,而本次试验检测结果中亚油酸含量为25.03%,亚麻酸的含量为18.85%,棕榈酸含量为7.96%,超长链脂肪酸含量为27.66%。该研究人员还检测出了藜麦油脂中的反油酸以及二十碳五烯酸等,这些都是本次检测所没有检测到的。这些检测结果的差异可能与藜麦品种不同有关。该研究人员检测的结果中ω-3∶ω-6脂肪酸为1.3,而本次研究结果为0.7。表明本次的研究结果中ω-6系列的脂肪酸相对含量较高。这两种脂肪酸的平衡在人类饮食中很重要[26]。在现代人的饮食中,建议食用富含ω-3和ω-6系列脂肪酸的食物,因为这两种必需脂肪酸在人体中不合成。
亚油酸是人体健康必不可缺的一种多不饱和脂肪酸,属于ω-6系列,多数研究报道了亚油酸能够降低低密度脂蛋白胆固醇,预防心血管疾病的发生[27-28],是生产功能性食品补充剂的常用成分,还具有降低炎症反应的作用,例如,Lowry等[29]研究证明了亚油酸通过降低一氧化氮合酶降低脂多糖刺激的BV-2小胶质细胞NO的释放。亚麻酸属于ω-3系列,ω-3脂肪酸可调节神经系统、血压和发炎过程[30],是人类健康饮食中不可或缺的一部分。亚麻酸能够促进动物生长,增强免疫力和抗氧化能力,改善肉质并降低血脂[31],可用作保健品和医药品。超长链脂肪酸是脂质介质的前体,也是细胞脂质如鞘脂和甘油磷脂的组成成分。油酸对人体也有一定的积极作用,膳食油酸对老年人的认知具有保护作用[32]。研究表明[33],二十碳五烯酸和二十二碳六烯酸具有保护视网膜的潜力。
3 结论
本研究结合超临界CO2-皂化法萃取技术,通过单因素试验和正交试验分析,得到超临界CO2-皂化法萃取藜麦甾醇的最佳工艺条件,即萃取压力为25 MPa,萃取温度为50℃,萃取时间为2.0 h,在此条件下,藜麦甾醇得率可达20.20 mg/g;通过气相色谱-质谱分析得出,从藜麦油脂中共分离鉴定出29种脂肪酸,其中不饱和脂肪酸的相对含量为74.59%,亚油酸、亚麻酸和油酸为藜麦油脂的主要脂肪酸。由于藜麦油脂中植物甾醇以及不饱和脂肪酸的存在,使得藜麦油脂可用于功能性食品和化妆品配方。藜麦油脂极具有开发价值。
