Relaxin-3通过抑制HMGB1介导的NLRP3炎性小体活化抑制AngⅡ诱导的心肌成纤维细胞转分化
2021-08-26翁方中胡朝梁严骏戴伟周瑞祥
翁方中,胡朝梁,严骏,戴伟,周瑞祥
(武汉市第一医院重症医学科,湖北 武汉 430022)
目前,高血压和心肌梗死等心血管疾病发病率较高,是全球主要的死亡原因。延缓心肌纤维化的发展是降低心血管疾病死亡风险的优化策略[1]。心肌成纤维细胞是过量细胞外基质的主要稳态调节器。由于缺氧等病理刺激,心肌成纤维细胞被激活,转化为肌成纤维细胞,后者在心肌纤维化中起着重要作用。肌成纤维细胞分泌过量的细胞外基质,如胶原和基质金属蛋白酶,从而导致心肌僵硬异常、心脏纤维化和心力衰竭[2]。NOD样受体蛋白3(NOD-like receptor protein 3 ,NLRP3)炎性小体由NLRP3、半胱氨酸天冬氨酸特异性蛋白酶-1(cysteinyl aspartate-specific proteinase-1,caspase-1)和凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)组成。NLRP3炎症小体在一些心脏疾病中被激活,如心肌梗死、主动脉瓣疾病、心肌炎、缺血/再灌注损伤、高血压和动脉粥样硬化,参与心脏疾病进展[3]。高迁移率族蛋白B1(high-mobility group box 1 ,HMGB1)是一种广泛存在的核蛋白,可通过诱导NLRP3炎症小体的激活,引起急性损伤和炎症[4]。人松弛素3(relaxin-3)是一种具有类似胰岛素结构的生物活性肽,主要在大脑中表达,可调节觉醒、进食、学习、记忆和中枢对生理应激源的反应[5]。外源性relaxin-3通过抑制NLRP3炎症小体活化,能有效减轻糖尿病大鼠心肌细胞凋亡和心肌纤维化,从而改善糖尿病大鼠心肌损伤[6]。但是,关于relaxin-3对心肌纤维化的作用机制尚未明确。因此,本研究应用血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)处理心肌成纤维细胞,建立体外心肌纤维化模型,旨在探究relaxin-3是否通过HMGB1调控AngⅡ处理的心肌成纤维细胞中NLRP3炎症小体的激活,以期为明确relaxin-3对心肌纤维化的作用机制及开发新的抗纤维化治疗策略提供参考依据。
1 材料与方法
1.1 主要材料
大鼠心肌成纤维细胞购自武汉普诺赛生命科技有限公司;重组relaxin-3购自美国Phoenix Pharmaceuticals; AngⅡ购自美国Sigma公司;过表达载体阴性对照(oe-NC)和HMGB1过表达载体(oe-HMGB1)购自武汉金开瑞生物工程有限公司;Lipofectamine 2000转染试剂购自赛默飞世尔科技(中国)有限公司;细胞计数检测试剂盒(cell counting kit-8,CCK-8)购自美国MedChemExpress;5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EdU)检测试剂盒购自上海碧云天生物技术有限公司;兔单克隆抗体抗α平滑肌肌动蛋白(anti-α smooth muscle actin,α-SMA)、兔单克隆抗体波形蛋白(vimentin)、兔单克隆抗体凋亡相关斑点样蛋白(apoptosis associated speck like protein,ASC)、兔单克隆抗体裂解的含半胱氨酸的天冬氨酸蛋白水解酶-1(cleaved caspase-1)购自英国Abcam公司; 鼠单克隆抗体I型胶原(collagen Ⅰ)、兔多克隆抗体III型胶原(collagen Ⅲ)、兔多克隆NLRP3抗体和鼠单克隆GAPDH抗体购自美国GeneTex公司;兔多克隆HMGB1抗体购自美国Cell Signaling Technology。
1.2 细胞培养
大鼠心肌成纤维细胞用含有10% 胎牛血清(fetal bovine serum,FBS)的杜尔贝科的改良鹰培养基(dulbecco’s modified eagle medium,DMEM)培养基培养,其中DMEM培养基中含有100 IU/mL青霉素和100 μg/mL链霉素。细胞置于37 ℃、5% CO2培养箱内培养,待细胞融合度达到了80%~90%,胰酶液消化细胞,DMEM培养基重悬细胞,继续传代培养或进行铺板操作。
1.3 细胞给药处理
将对数期生长的大鼠心肌成纤维细胞接种于6孔板中,每孔细胞数量为1×106个。细胞继续培养24 h后,将细胞随机分为空白对照组、AngⅡ组和relaxin-3组,AngⅡ组细胞添加2 μmol/L Ang II[7],relaxin-3组细胞添加2 μmol/L Ang II和100 ng/mL relaxin-3[8],空白对照组添加等量磷酸缓冲盐溶液(phosphate buffer saline,PBS)。细胞继续培养24 h后,进行后续实验操作。
1.4 细胞转染
将对数期生长的大鼠心肌成纤维细胞接种于6孔板中,每孔细胞数量为1×106个。细胞继续培养24 h后,将细胞随机分为AngⅡ组、relaxin-3组、relaxin-3+oe-NC组(转染oe-NC)和relaxin-3+oe-HMGB1组(转染oe-HMGB1),将细胞培养基更换为新鲜培养基,按照Lipofectamine 2000转染试剂说明书进行细胞转染。细胞继续培养48 h后,向各组细胞中添加2 μmol/L Ang II,向relaxin-3组、relaxin-3+oe-NC组和relaxin-3+oe-HMGB1组添加100 ng/mL relaxin-3。细胞继续培养24 h后,进行后续实验操作。
1.5 CCK-8检测细胞活力
胰酶液消化对数期生长的大鼠心肌成纤维细胞,新鲜DMEM培养基重悬细胞,取细胞悬液接种于96孔板,每孔5×103个细胞,细胞继续培养24 h后,向细胞中添加CCK-8溶液(10 μL/孔),将细胞置于37 ℃下静置孵育4 h后,用酶标仪测定每孔在450 nm处的光密度(optical density,OD)值。Ang II组细胞活力(%)=OD实验组/OD空白对照组×100%,Relaxin-3组细胞活力(%)=OD实验组/ODAngⅡ组×100%。
1.6 EdU检测试剂盒检测细胞增殖
向给药处理或者是细胞转染后的大鼠心肌成纤维细胞中添加EdU工作液,使其终浓度为10 μmol/L,细胞置于37 ℃下静置孵育2 h。弃去细胞上清液,4%多聚甲醛室温固定细胞15 min。弃去固定液,PBS洗涤细胞后,添加0.3% Triton X-100处理细胞15 min。去除通透液,PBS洗涤细胞后,添加Click-iTTM细胞反应缓冲液室温避光孵育30 min,随后添加4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)室温条件下孵育10 min。PBS洗涤细胞后,荧光显微镜下观察并拍照。EdU阳性细胞数(%)=EdU阳性细胞数/总细胞数×100%。
1.7 Western blot检测细胞中α-SMA、vimentin、collagenⅠ、collagen Ⅲ、NLRP3、ASC、cleaved caspase-1和HMGB1蛋白表达
收集给药处理或细胞转染后的大鼠心肌成纤维细胞,蛋白裂解液裂解细胞后,收集细胞上清液,BCA法测定上清液蛋白浓度。取30 μg蛋白上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和转膜操作。添加5% 牛血清白蛋白(bovine albumin,BSA)封闭液室温条件下孵育3 h。向细胞中添加α-SMA(1∶1 000)、vimentin(1∶2 000)、collagenⅠ(1∶1 000)、collagen Ⅲ(1∶1 000)、NLRP3(1∶2 000)、ASC(1∶2 000)、cleaved caspase-1(1∶1 000)、HMGB1(1∶1 000)和GAPDH(1∶2 000)抗体稀释液,4 ℃下静置孵育过夜。添加特异性二抗(1∶5 000) 辣根过氧化物酶(horseradish peroxidase,HRP)标记亲和纯化山羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG),室温条件下孵育1 h。滴加电化学发光(electrochemiluminescence,ECL)溶液,凝胶成像系统检测蛋白条带,Image J软件分析各蛋白条带的灰度值。
1.8 间接免疫荧光检测细胞中NLRP3的表达
弃去给药处理或细胞转染后的大鼠心肌成纤维细胞的培养基,PBS清洗细胞后,添加4%多聚甲醛室温条件下固定细胞15 min。PBS清洗细胞,添加0.3% Triton X-100处理细胞15 min。PBS清洗细胞后,添加5% BSA封闭液室温条件下封闭30 min。弃去封闭液,添加NLRP3抗体稀释液(1∶200),4 ℃下静置孵育过夜。添加特异性荧光二抗(1∶5 000) Alexa Fluor®偶联二抗,室温条件下避光孵育1 h。滴加DAPI室温条件下孵育10 min。PBS清洗细胞后,荧光显微镜下观察并拍照。Image J软件分析各组细胞荧光强度。
1.9 统计学分析
2 结果
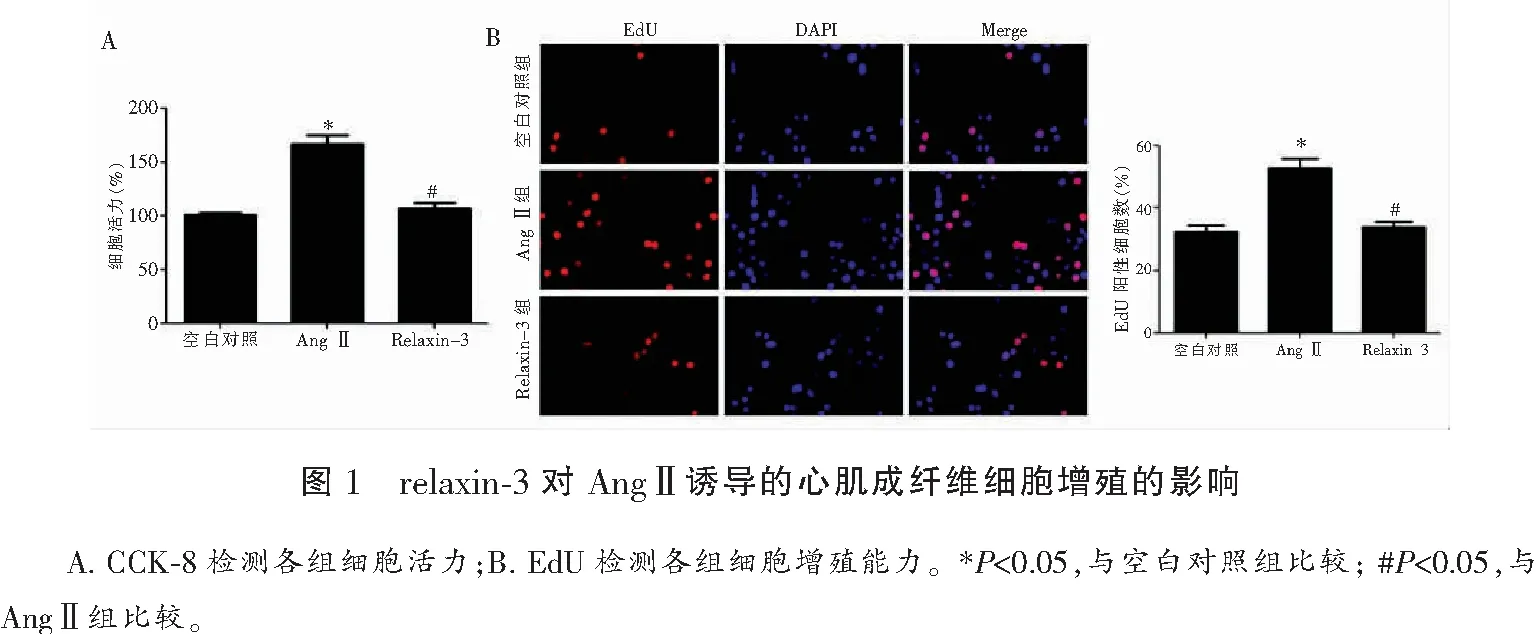
2.1 relaxin-3对AngⅡ诱导的心肌成纤维细胞增殖的影响
与空白对照组相比,AngⅡ组细胞活力明显升高(P<0.05),EdU阳性细胞数明显升高(P<0.05);与AngⅡ组相比,Relaxin-3组细胞活力明显降低(P<0.05),EdU阳性细胞数明显降低(P<0.05)。见图1。
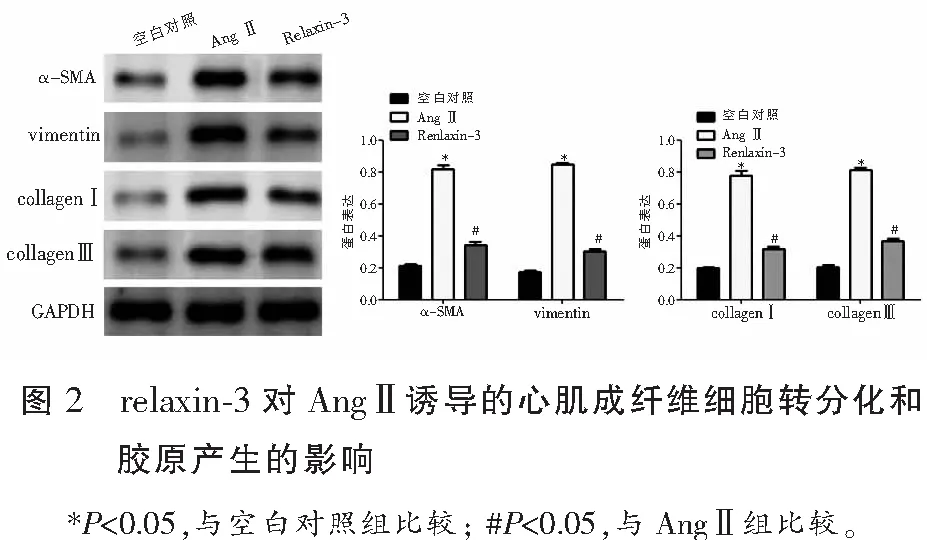
2.2 relaxin-3对AngⅡ诱导的心肌成纤维细胞转分化和胶原产生的影响
与空白对照组相比,AngⅡ组细胞中α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ蛋白的表达水平明显升高(P<0.05);与AngⅡ组相比,relaxin-3组细胞中α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ蛋白表达水平却明显下降(P<0.05)。见图2。
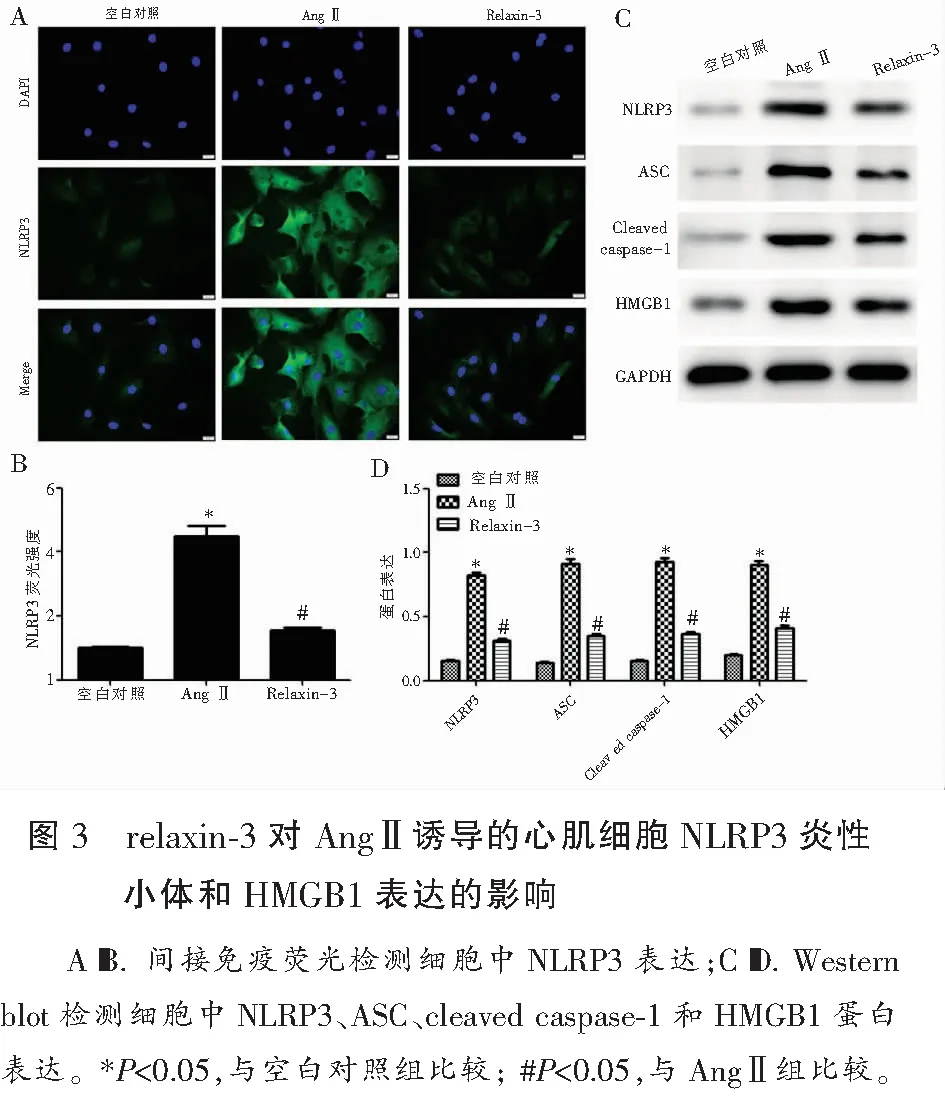
2.3 relaxin-3对AngⅡ诱导的心肌细胞NLRP3炎性小体和HMGB1表达的影响
与空白对照组相比,AngⅡ组细胞中NLRP3荧光强度和NLRP3、ASC、cleaved caspase-1、HMGB1蛋白表达均明显增多(P<0.05);与AngⅡ组相比,relaxin-3组细胞中NLRP3荧光强度和NLRP3、ASC、cleaved caspase-1、HMGB1蛋白表达均明显降低(P<0.05)。见图3。
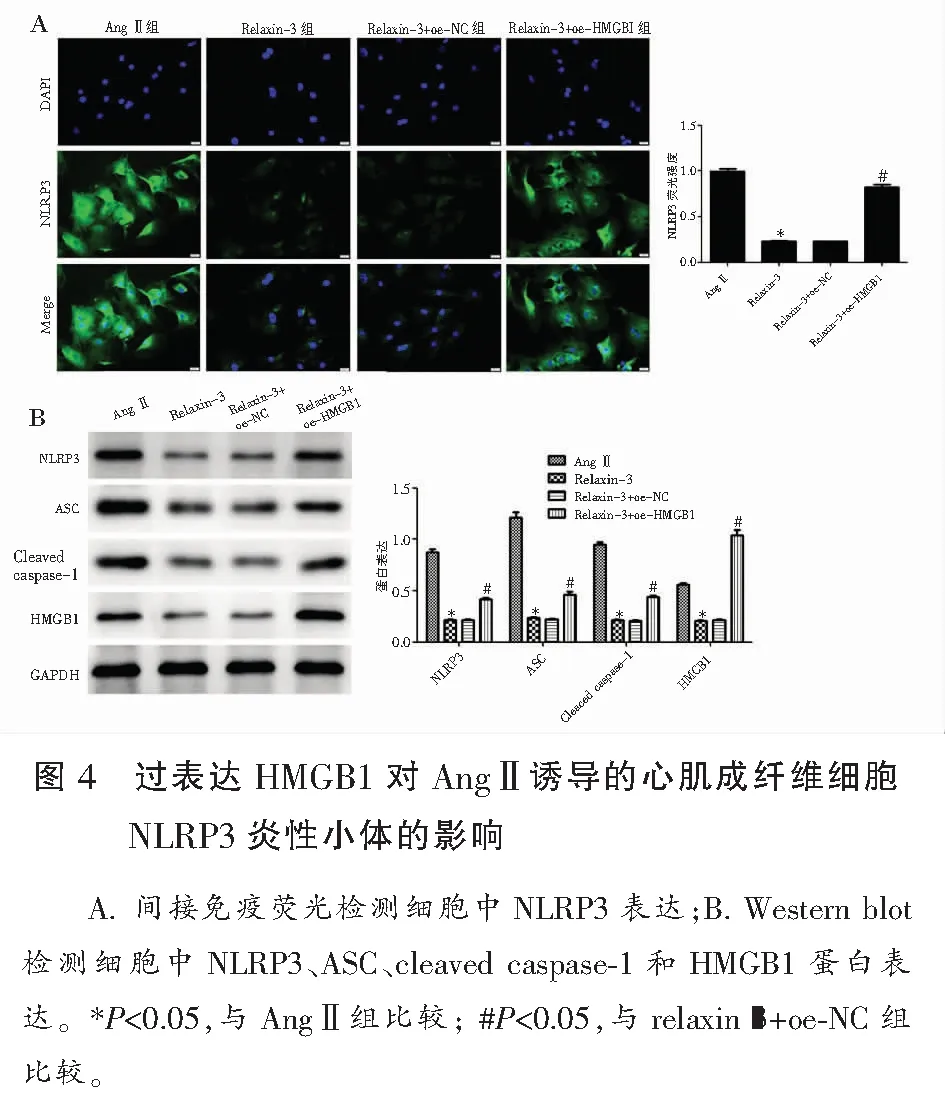
2.4 过表达HMGB1对AngⅡ诱导的心肌成纤维细胞NLRP3炎性小体的影响
与AngⅡ组相比,relaxin-3组细胞中NLRP3荧光强度和NLRP3、ASC、cleaved caspase-1、HMGB1蛋白表达均明显降低(P<0.05);relaxin-3组和relaxin-3+oe-NC组两组间NLRP3荧光强度和NLRP3、ASC、cleaved caspase-1、HMGB1蛋白表达差异无统计学意义(P>0.05);与relaxin-3+oe-NC组相比,relaxin-3+oe-HMGB1组细胞中NLRP3荧光强度和NLRP3、ASC、cleaved caspase-1、HMGB1蛋白表达均明显升高(P<0.05)。见图4。
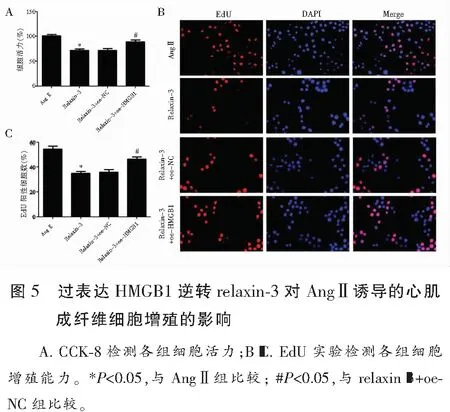
2.5 过表达HMGB1逆转relaxin-3对AngⅡ诱导的心肌成纤维细胞增殖的影响
与AngⅡ组相比,relaxin-3组细胞活力明显降低(P<0.05),EdU阳性细胞数明显降低(P<0.05);relaxin-3组和relaxin-3+oe-NC组两组间细胞活力和EdU阳性细胞数比较,差异无统计学意义(P>0.05);与relaxin-3+oe-NC组相比,relaxin-3+oe-HMGB1组细胞活力明显升高(P<0.05),EdU阳性细胞数明显升高(P<0.05)。见图5。
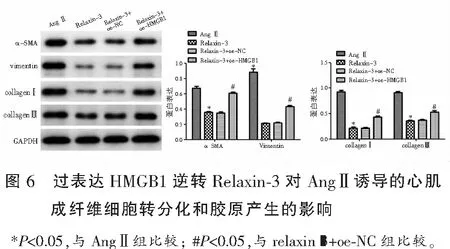
2.6 过表达HMGB1逆转relaxin-3对AngⅡ诱导的心肌成纤维细胞转分化和胶原产生的影响
与AngⅡ组相比,relaxin-3组细胞中α-SMA、vimentin、collagenⅠ和collagen Ⅲ蛋白表达明显降低(P<0.05);relaxin-3组和relaxin-3+oe-NC组两组间α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ蛋白表达差异无统计学意义(P>0.05);与relaxin-3+oe-NC组相比,relaxin-3+oe-HMGB1组细胞中α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ蛋白表达明显升高(P<0.05)。见图6。
3 讨论
纤维化疾病的死亡率极高,每年可导致全球超过80万人死亡,其中大部分是肺和心脏纤维化[9]。损伤后生理性细胞外基质重塑是组织再生的一个自然且至关重要的过程。相反,病理性重塑,包括纤维性胶原的产生,会导致非功能性瘢痕和组织功能受损。虽然心脏纤维化的种类已有较明确的分型,但导致纤维化发生和心脏瘢痕形成过程的致病机制仍未完全清楚[10]。在心脏疾病中,特别是心脏纤维化领域,迫切需要探究纤维化相关致病机制并开发新的、有效的治疗方法。
心肌成纤维细胞向肌成纤维细胞的转化与I型和III型胶原的产生有关,其中I型胶原含量最为丰富[11]。虽然组织修复过程是对组织损伤的一种重要的短期适应,但持续、长期产生的细胞外基质蛋白会导致心肌僵硬和顺应性差,从而导致心功能障碍[12]。因此,靶向抑制心肌成纤维细胞转分化在心肌纤维化过程中起重要作用[13]。松弛素家族多肽受体广泛分布于心、脑、肾和生殖系统,relaxin与其受体结合后可触发抗炎、抗氧化、抗凋亡和抗纤维化途径[14]。relaxin-2是松弛素家族成员之一,可通过抑制纤维化、瘢痕形成和炎症水平来控制子宫内膜异位症病变[15]。本研究应用AngⅡ处理心肌成纤维细胞,建立体外心肌纤维化模型,随后用relaxin-3处理细胞,结果显示,AngⅡ处理可诱导心肌成纤维细胞增殖,还可上调肌成纤维细胞标志物α-SMA和vimentin的表达,以及提高collagen Ⅰ和collagen Ⅲ的表达水平,而relaxin-3处理可明显逆转AngⅡ对心肌成纤维细胞的作用,抑制心肌成纤维细胞增殖,下调肌成纤维细胞标志物α-SMA和vimentin的表达,且降低collagenⅠ和collagen Ⅲ的表达水平。因此,relaxin-3可在AngⅡ诱导的心肌成纤维细胞中发挥抗纤维化作用。
NLRP3炎症小体的激活可促进胶原蛋白的产生和细胞因子白介素-1β(interleukin-1β,IL-1β)的分泌,导致肺、肝和肾等器官的纤维化发展[16]。AngⅡ可促进NLRP3炎症小体介导的胶原合成,导致caspase-1活化和IL-1β分泌,最终导致小鼠心肌纤维化。然而,NLRP3基因缺失可减轻线粒体异常、心脏炎症、氧化应激和纤维化,从而减轻心脏功能紊乱和肥大[17]。人皮肤成纤维细胞中NLRP3炎症小体激活可诱导细胞向肌成纤维细胞分化(α-SMA表达上调和胶原沉积),relaxin-2可通过靶向抑制NLRP3炎症小体激活逆转上述变化[18]。另外,Zhang等[19]指出,高糖通过激活NLRP3炎症小体诱导新生大鼠心肌成纤维细胞胶原合成,导致caspase-1激活、IL-1β和白介素-18(interleukin-18,IL-18)分泌。本研究显示,AngⅡ处理可诱导心肌成纤维细胞中NLRP3、ASC和cleaved caspase-1蛋白表达,而relaxin-3处理可明显逆转AngⅡ处理的心肌成纤维细胞中NLRP3、ASC和cleaved caspase-1蛋白表达,与Zhang等[19]的研究结果基本一致,表明relaxin-3可抑制AngⅡ诱导的心肌成纤维细胞中NLRP3炎性小体激活。
目前,关于relaxin-3抑制NLRP3炎性小体激活的相关机制尚未明确。抑制HMGB1可能是治疗组织纤维化的一种治疗方法[20]。Zhang等[21]的研究结果表明,HMGB1与压力超负荷小鼠较高的死亡率、胶原含量及较低的左室射血分数相关,外源性HMGB1在心肌中的过度表达可促进心肌纤维化、加重了压力超负荷引起的左室功能障碍。敲低HMGB1还可通过抑制NLRP3炎性小体激活在胃溃疡小鼠中发挥抗炎和抗溃疡作用[22]。此外,靶向抑制HMGB1依赖的NLRP3炎性小体失活可明显减轻脂多糖诱导的乳鼠心肌细胞炎症和凋亡,减轻细胞损伤[23]。本研究显示,AngⅡ处理可诱导心肌成纤维细胞中HMGB1蛋白表达,而relaxin-3处理可明显抑制AngⅡ处理的心肌成纤维细胞中HMGB1蛋白表达,进而使relaxin-3和AngⅡ处理的心肌成纤维细胞中NLRP3、ASC和cleaved caspase-1蛋白表达上调,且细胞增殖能力、α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ的表达也均上调。因此,relaxin-3可通过抑制HMGB1/NLRP3炎性小体轴在AngⅡ诱导的心肌成纤维细胞中发挥抗纤维化作用。
综上所述,relaxin-3可通过抑制HMGB1介导的NLRP3炎性小体活化,抑制AngⅡ诱导的心肌成纤维细胞增殖以及α-SMA、vimentin、collagen Ⅰ和collagen Ⅲ的表达,从而发挥抗纤维化作用。
