5种非甾体类抗炎药对小鼠的肝损伤作用
2021-08-26潘阳阳岳亚辉代国年余四九
王 萌,潘阳阳,岳亚辉,代国年,周 璇,芮 弦,余四九
(1 甘肃农业大学 动物医学院,甘肃 兰州 730070;2 中牧实业股份有限公司 兰州生物药厂,甘肃 兰州 730046)
非甾体类抗炎药(non-steroid anti-inflammatory drugs,NSAIDs)是一类不含甾体结构的解热镇痛抗炎药,主要用于治疗各种炎性疾病或缓解各种急慢性疾病所致的急性疼痛或发热[1],兽医临床广泛应用于乳腺炎、子宫内膜炎、关节炎及各种发热和疼痛疾病的治疗,疗效显著[2-4]。NSAIDs的给药剂量、给药途径和用药间隔因病症的不同而异,导致其对肝脏及其他器官产生的副作用也不尽相同[5-6]。由NSAIDs引起的肝脏损伤约占药物性肝损伤的10%,其中特异质性肝损伤约占NASAIDs肝损伤的16%,急性药物性肝损伤的比例约占NASAIDs肝损伤的20%[7]。参与NSAIDs代谢的酶为细胞色素P450(cytochrome P450,CYP450),主要为CYP2C9、CYP3A4、CYP2E1和CYP1A2等,在NSAIDs引起的肝脏损伤中发挥着重要的作用。
阿司匹林(acetylsalicylic acid,ASA)、保泰松(phenylbutazone,PTZ)、吲哚美辛(indomethacin,IDM)、吡罗昔康(piroxicam,PRX)和氟比洛芬(flurbiproten,FBP)是兽医临床常用的NSAIDs,但均会对肝脏功能造成一定影响。研究表明,这5种NSAIDs可由CYP2C9酶通过羟基化作用和去甲基化作用进行催化代谢,但CYP2C9与NSAIDs诱导的肝损伤几乎无相关性[8]。CYP450酶主要存在于肝脏,其中CYP2E1约占肝脏CYP450酶总量的7%,主要参与外源性小分子物质的代谢及前致癌物质和毒物的活化等[9-10]。肝脏CYP2E1水平与药物性肝损伤关系密切,CYP2E1水平升高会导致药物性肝损伤加重,反之会使药物性肝损伤有所缓解[11]。目前,关于NSAIDs对CYP2E1作用的研究尚比较少。为此,本试验以小鼠为研究对象,检测5种NSAIDs对小鼠肝脏的损伤作用及其与CYP2E1的相关性,以期揭示CYP2E1在NSAIDs诱导的肝脏损伤中的作用,为临床上NASIDs的合理应用提供理论参考。
1 材料与方法
1.1 材 料
1.1.1 试验动物 昆明小白鼠70只,雌雄各半,体质量为(20±5) g/只,购自中国科学院兰州兽医研究所,于23~26 ℃环境中饲喂。
1.1.2 药品与试剂 阿司匹林(ASA)、保泰松(PTZ)、吲哚美辛(IDM)、吡罗昔康(PRX)、氟比洛芬(FBP)、对乙酰氨基酚(APAP)、质量分数0.5%羧甲基纤维素钠(CMC-Na)、6-磷酸葡萄糖脱氢酶和6-磷酸葡萄糖,均购于上海源叶生物科技有限公司;将阿司匹林、保泰松、氟比洛芬、吲哚美辛、吡罗昔康5种NSAIDs溶解于0.5%的CMC-Na中,4 ℃保存备用。4-硝基儿茶酚,购自北京索莱宝科技有限公司;谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒,均购自南京建成生物制品研究所。
线粒体提取A液:蔗糖0.086 mg/mL,Tris-HCl 6.057 mg/mL,EDTA 10.240 mg/mL,BSA 4.000 mg/mL。线粒体提取B液:甘露醇0.030 mg/mL,蔗糖0.024 mg/mL,Tris-HCl 0.606 mg/mL,EDTA 0.293 mg/mL。NADP生成系统:1.005 mg/mL 6-磷酸葡萄糖,0.670 mg/mL氯化镁,2.500 mg/mL NADP溶液,0.204 mg/mL磷酸钾缓冲液。
1.1.3 仪 器 CT15RE日立卓上微量高速冷冻离心机,株式会社日立制作所;Scientz-48L冷冻型高通量组织研磨器,宁波新芝生物科技有限公司;SpectraMax i3x多功能酶标测定仪,美国Molecular Devices公司。
1.2 方 法
1.2.1 试验动物的分组和处理 将70只昆明小白鼠随机分为空白对照组(normal control,NC)、对乙酰氨基酚阳性对照组(APAP)及ASA、PTZ、IDM、PRX和FBP组,每组10只。NC组灌胃质量分数0.5%的CMC-Na,APAP组灌胃70 mg/kg的APAP[12],为避免单次给药剂量过大引起小鼠应激或死亡,根据APAP的半衰期每隔3 h给药1次,每天5次,连用3 d。根据参考文献和前期预试验确定5种NSAIDs的给药剂量和给药次数,ASA、PTZ、IDM、PRX和FBP组小鼠分别灌胃50[13], 54[14],2.4[15],2.6[16]和7.5[17]mg/kg剂量的相应NSAIDs,每天2次,连续给药3 d。最后一次灌胃12 h后,称体质量,眼丛静脉采血后脱颈处死小鼠,迅速摘取肝脏组织,在冰浴中用生理盐水反复清洗至肝脏呈土黄色。取部分肝叶用体积分数4%~5%福尔马林溶液固定保存,以备肝组织病理学观察;部分肝组织用于提取肝脏线粒体;其余肝组织于-80 ℃保存备用。血液样本于4 ℃ 、3 000 r/min离心10 min,分离血清,-20 ℃保存备用。
1.2.2 血液生化指标的测定 严格按照相关试剂盒说明书的方法,测定血清中的ALT和AST活性;同时按照试剂盒说明书的操作方法,测定小鼠新鲜肝脏组织MDA、GSH含量及SOD和GSH-Px活性。
1.2.3 组织病理学观察 检查各组肝脏组织损伤和充血部位,剪切为5 mm的薄片,用体积分数4%~5%的福尔马林固定24 h,经过一系列酒精脱水后进行石蜡组织包埋,自动切片机切片(厚3~5 μm),然后摊片、贴片,并在60 ℃干燥箱中烘片30 min,二甲苯脱蜡,常规苏木精-伊红(HE)染色,中性树胶封片,光学显微镜下镜检,观察肝脏组织的病理学变化。
1.2.4 肝脏CYP2E1酶活性的测定 (1)NSAIDs对肝脏CYP2E1酶体内活性的影响。采用差速离心法提取不同处理组小鼠的肝脏线粒体,检测线粒体蛋白浓度。提取肝脏线粒体20 μL,加入0.05 mol/L磷酸钾缓冲液440 μL,5 mol/L对硝基苯酚10 μL,NADP生成系统25 μL,40 U/mL 6-磷酸葡萄糖脱氢酶5 μL,组成线粒体孵育体系。每组设置3个重复,于37 ℃孵育20 min后在535 nm处测定吸光值,计算CYP2E1的活性[18]。
(2)NSAIDs对肝脏CYP2E1酶体外活性的影响。将ASA、PTZ、PRX、IDM和FBP标准品分别溶于质量分数0.5% CMC-Na中,将ASA、PTZ和PRX的浓度分别配制为64,128,256和512 μmol/L,IDM和FBP的浓度分别配制为32,64,128和256 μmol/L[19-21]。将以上不同浓度药物分别加入到NC组小鼠肝线粒体孵育体系中,每组设置3个重复,于37 ℃孵育20 min后,测算CYP2E1的活性,探讨NSAIDs与CYP2E1活性的量效关系。
1.3 数据处理
用SPSS 19.0数据处理软件对试验数据进行方差分析,以P<0.05表示差异显著,P<0.01表示差异极显著;采用Graphpad Prism 7.0进行绘图。
2 结果与分析
2.1 NSAIDs对小鼠血清AST和ALT含量的影响
在急性肝损伤中,血清AST和ALT水平升高说明肝细胞受损严重。由图1可以看出,与NC相比,阳性对照APAP组小鼠血清的AST和ALT水平极显著升高(P<0.01),表明APAP可诱导肝损伤。与NC组相比,5种NSAIDs处理组中,ASA、IDM、PTZ、FBP组小鼠血清ALT和AST水平极显著升高(P<0.01),PRX对小鼠血清ALT和AST均无显著影响(P>0.05),其中以IDM对小鼠血清ALT和AST的诱导作用最强。
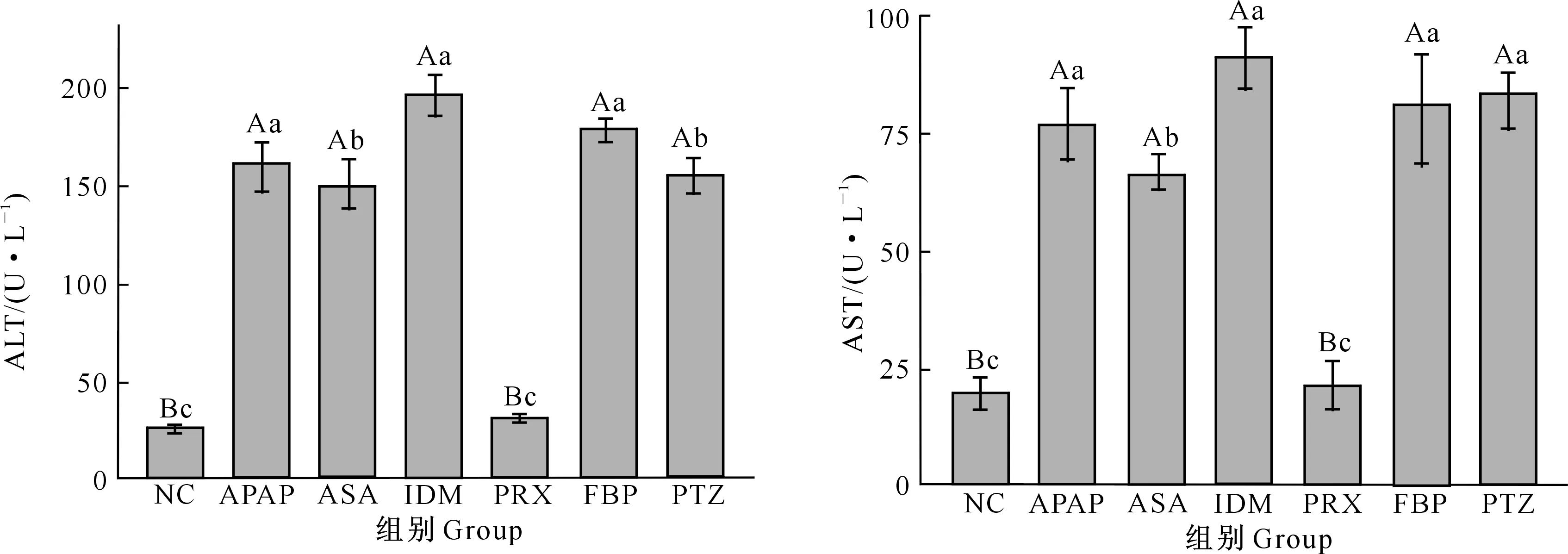
NC.正常对照组;APAP.对乙酰氨基酚组;ASA.阿司匹林组;IDM.吲哚美辛组;PRX.吡罗昔康组;FBP.氟比洛芬组;PTZ.保泰松组。图柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)。下同NC.Normal control;APAP.Acetaminophen positive control;ASA.Acetylsalicylic acid group;IDM.Indomethacin group;PRX.Piroxicam group;FBP.Flurbiprofen group;PTZ.Phenylbutazone group.Different lowercase letters indicate significant differences (P<0.05) and uppercase letters present extremely significant differences (P<0.01).The same below
2.2 NSAIDs对小鼠肝脏抗氧化指标的影响
药物在肝脏代谢过程中容易产生自由基,导致氧化产物MDA含量增多,同时消耗大量的抗氧化酶,进而降低肝细胞内抗氧化防御系统中的SOD、GSH和GSH-Px水平。5种NSAIDs对小鼠肝脏抗氧化指标的影响如图2所示。
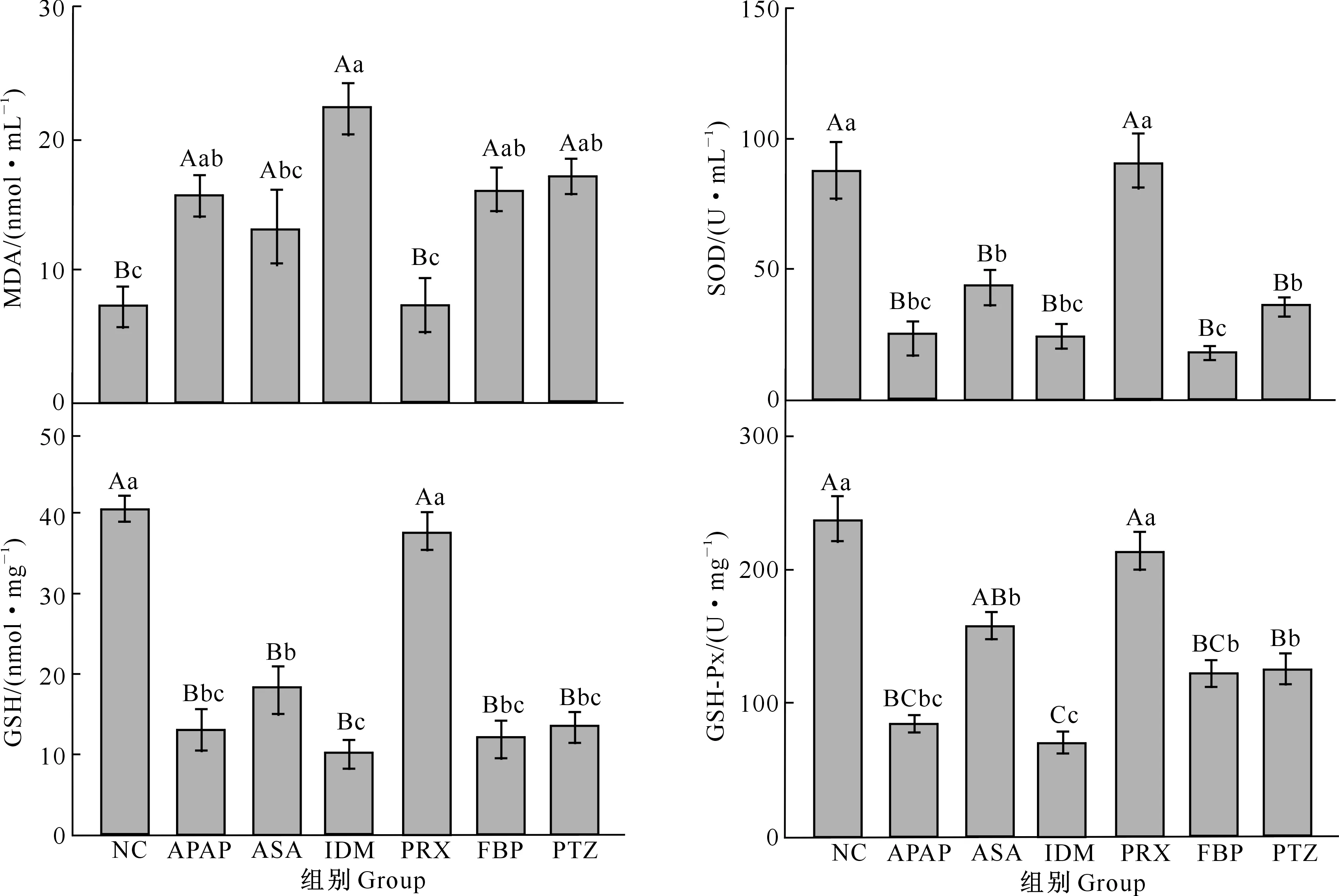
图2 5种NSAIDs对小鼠肝脏抗氧化指标的影响Fig.2 Effects of 5 NSAIDs on oxidative defense markers in liver homogenate
由图2可知,与NC相比,阳性对照组APAP能够极显著增加MDA的含量(P<0.01),极显著降低抗氧化酶SOD、GSH和GSH-Px的水平(P<0.01)。除PRX外,其余4种NSAIDs均能极显著升高MDA,并显著降低抗氧化酶水平,表明ASA、IDM、FBP和PTZ均能降低肝细胞内的抗氧化防御系统水平,进而导致MDA含量升高,使肝细胞处于氧化应激状态。值得注意的是,IDM对MDA的诱导作用和抗氧化酶的抑制作用最强,其次为FBP和PTZ。
2.3 NSAIDs对小鼠肝脏病理组织学变化的影响
观察不同组别小鼠的新鲜肝脏,除NC和PRX组外,其余各组均肉眼可见肝脏外观明显肿胀水肿,边缘圆钝,肝体发黄。在光学显微镜下观察HE染色的肝脏病理切片,结果显示,NC组和PRX组小鼠肝组织(图3-A和E)结构正常,小叶结构完整清晰可见,肝细胞排列整齐,中央静脉和汇管区结构正常,未见肝实质细胞病变。与正常小鼠肝脏切片相比,ASA组小鼠肝细胞(图3-C)轻度水肿,幼稚型肝细胞较多,说明肝细胞处于修复期。
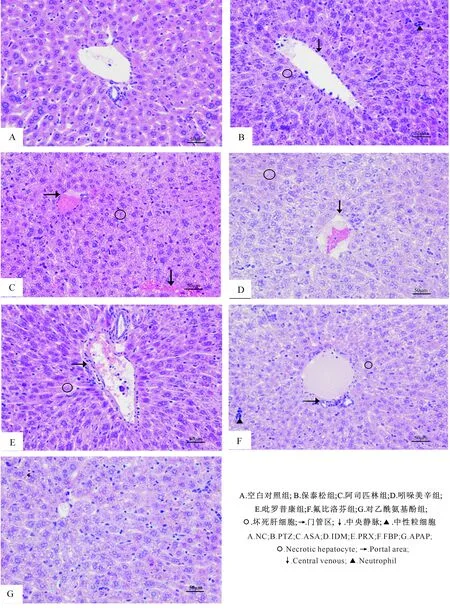
图3 NSAIDs对小鼠肝组织的影响(400×)Fig.3 Effect of NSAIDs on liver of mice
图3-B、D和F显示,PTZ和IDM、FBP均能导致小鼠肝脏出现不同程度的病理变化,主要表现为肝细胞肿大,胞浆内有微细的淡红色颗粒,核淡染;小叶结构不清晰,沿中央静脉和肝索分布有一定数量的炎性细胞和明显的肝细胞坏死。阳性对照APAP组小鼠肝细胞(图3-G)出现水肿,可见炎性细胞聚集和部分肝细胞坏死。
2.4 NSAIDs对小鼠肝脏CYP2E1酶体内活性的影响
由图4可知,与NC组相比,IDM、FBP和PTZ组小鼠肝脏CYP2E1酶活性显著升高(P<0.05),且3组之间无显著差异;ASA和PRX组小鼠肝脏CYP2E1酶活性无显著差异(P>0.05)。与APAP组相比,IDM、FBP和PTZ组小鼠肝脏CYP2E1酶活性无差异显著性。
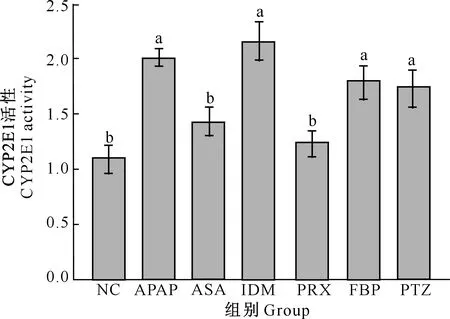
图4 NSAIDs对CYP2E1酶活性的影响Fig.4 Effect of NSAIDs on CYP2E1 activity
2.5 NSAIDs对小鼠肝脏CYP2E1酶体外活性的影响
由图5-A、C可知,不同浓度ASA和PRX对小鼠肝脏CYP2E1酶活性均无显著影响(P>0.05)。图5-B显示,随着浓度的升高,IDM诱导的CYP2E1活性先逐渐升高,当其浓度大于256 μmol/L时活性有所下降。图5-D、E表明,FBP和PTZ浓度与CYP2E1酶活性呈正相关关系,但CYP2E1活性对FBP浓度更敏感。
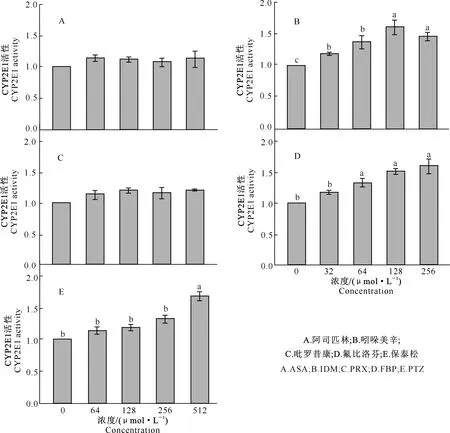
图5 不同浓度梯度NSAIDs对CYP2E1酶活性的影响Fig.5 Effects of NSAIDs with different concentrations on CYP2E1 activity
3 讨 论
NSAIDs在畜禽饲养管理中应用广泛,但在联合用药中易引起药物间相互作用(Drug and drug interaction,DDI)而影响肝脏功能。因此,研究NASIDs对肝脏的影响具有非常重要的意义。本研究检测了肝功指标AST和ALT,结果表明,除PRX外,其他4种NASIDs均对小鼠肝脏有不同程度的损伤作用。与NC组相比,ASA、IDM、FBP和PTZ可诱导小鼠AST水平显著升高;与ASA组相比,IDM、FBP和PTZ组小鼠AST和ALT水平也明显升高。肝脏中的AST存在于线粒体中,当肝细胞发生严重损伤甚至病变时,线粒体受损,AST大量进入血液导致AST水平升高[22],说明IDM、FBP和PTZ对肝细胞线粒体有损伤作用。肝脏中的ALT存在于细胞浆中[23],当肝细胞发生变性时,肝细胞膜通透性增加,ALT从肝细胞流入血液,导致血液中的ALT水平增高[24];当血液中的AST和ALT水平升高时,表示肝细胞受到了严重损伤[25]。肝细胞中的MDA水平可以反映脂质过氧化程度,SOD、GSH和GSH-Px可反映细胞内的抗氧化水平。为了更加直观地观察肝损伤状况,对不同NASIDs处理小鼠肝脏进行的病理学观察发现,PRX和ASA处理小鼠的肝脏病理学变化轻微,结合AST和ALT的分析结果可知,PRX对小鼠肝脏几乎无损伤作用,而ASA组小鼠AST和ALT均明显升高,说明虽然ASA能够引起肝细胞损伤,但肝细胞的修复功能可以抵抗其损伤作用。IDM、FBP和PTZ组小鼠肝脏眼观病变表现为体积增大,边缘变钝,被膜紧张,色泽变淡,呈土黄色,切面隆起,切缘外翻;病理学镜检发现,肝细胞颗粒变性和凋亡现象明显,结合IDM、FBP和PTZ对AST水平的影响可知,这3组小鼠肝细胞内的线粒体发生了损伤。当线粒体发生损伤时,ATP生成减少导致细胞功能障碍,一方面会影响细胞膜上钠钾泵的功能,导致钠离子不能有效排至细胞外,而在细胞内蓄积;另一方面会导致细胞内中间代谢产物增多,大量吸收水分,细胞肿大,线粒体肿胀[26-28]。非甾体类药物对肝细胞中MDA和抗氧化酶水平的影响与血清AST、ALT水分及病理变化一致,进一步证实5种NSAIDs中,IDM、FBP和PTZ能够诱导小鼠发生肝脏损伤。
细胞色素P450 2E1广泛分布于肝脏中,可介导多种内源性和外源性化合物的代谢,是肝损伤药物的重要靶点[29-30]。因此,本试验检测了5种NASIDs对小鼠肝脏CYP2E1酶活性的影响,结果显示,ASA和PRX对肝脏CYP2E1酶活性无明显诱导作用,而IDM、FBP和PTZ对肝CYP2E1活性均有诱导作用,且与正常组相比差异显著(P<0.05)。肝脏中的CYP2E1能够对外源性化合物进行代谢,导致肝细胞内大量活性氧堆积,从而发生氧化应激,造成细胞膜和细胞器发生脂质过氧化反应,引起细胞膜损伤,最终导致肝细胞受损[31-32]。IDM、FBP和PT对小鼠肝脏CYP2E1酶的诱导说明,这3种NASIDs经CYP2E1酶代谢后,所产生的大量活性中间代谢产物可能会导致肝细胞膜受损。此外,CYP2E1酶在肝细胞线粒体内含量丰富,且能够产生大量的氧化产物,导致线粒体应激和损伤[33-34]。本研究结果表明,IDM、FBP和PTZ对小鼠肝脏有明显的损伤作用,且与肝脏中的CYP2E1酶活性呈正相关。因此,IDM、FBP和PTZ诱导肝损伤的机制可能与CYP2E1酶水平升高诱导的肝细胞线粒体功能障碍相关,具体机制还有待进一步研究。由于IDM、FBP和PTZ对CYP2E1酶有诱导作用,因此在临床上应避免同时使用其他经CYP2E1酶代谢的药物,如异烟肼、氯唑沙宗和APAP等[35-37],以防产生肝损伤等不良反应。
4 结 论
5种NSAIDs药物中,IDM、FBP和PTZ可能通过诱导CYP2E1导致线粒体功能障碍而引发急性肝脏损伤,PRX和ASA几乎对小鼠肝脏无急性损伤作用。对小鼠CYP2E1酶活性的研究,可以为兽医临床中NASIDs的使用以及NASIDs与其他药物的联合应用提供参考。
