囊内刮除术与瘤段切除术治疗四肢长骨骨巨细胞瘤伴病理性骨折的 Meta 分析
2021-08-26李登科麦麦提艾力阿卜杜外力田征艾克拜尔尤努斯陈江涛张杰吾斯曼拜都拉
李登科 麦麦提艾力·阿卜杜外力 田征 艾克拜尔·尤努斯 陈江涛 张杰 吾斯曼·拜都拉
骨巨细胞瘤 (giant cell tumor of bone,GCT) 占所有原发性骨肿瘤的 5%,占良性骨肿瘤的 20%。在印度南部和中国,GCT 的患病率异常高,占所有原发性骨肿瘤的 20%~30%。GCT 的患病率在第三个 10 年达到高峰,80% 的病例发生在 20~40 岁,不到 3% 的病例发生在 14 岁之前[1]。大多数肿瘤发生在膝关节周围的骨骼 (占所有病例的 50%~65%); 最常见的部位是股骨远端 23%~30%,其次是胫骨近端 20%~25%、桡骨远端 10%~12%、骶骨 4%~9% 和肱骨近端[2]。四肢长骨 GCT 易危害到负重长骨骨端,促使溶骨破坏性病变,导致其患者经常合并发生病理性骨折等情况。合并病理性骨折则认为肿瘤侵袭性高,可能有高转移率和复发率。这种病理性骨折常常是关节内骨折,多位于骨端。国外研究表明发病率约 9%~30%。目前,瘤段切除术与囊内刮除术均为四肢长骨 GCT 伴病理性骨折患者的主要临床治疗方式,重建方式包括结构性植骨、骨水泥填充、接骨板固定、人工关节置换及异体关节置换术等。但国内外学者在广泛切除和刮除方式的选择方面存在争议。且关于四肢长骨 GCT 伴病理性骨折的患者,选择何种手术方式及效果疗效方面少有相关 Meta 分析进行对比分析[1,3-4]。
文献报道,在伴病理性骨折的 GCT 患者中,选择扩大切除病变或是病灶内刮除,关于术后复发率、并发症发生率仍有争论,在术后功能评价、再手术率上,少有文献报道。为此,笔者对囊内刮除术和瘤段切除术治疗四肢长骨 GCT 伴病理性骨折的文献进行 Meta 分析,以获取囊内刮除术与瘤段切除术 (包括广泛切除后人工关节重建、异体骨重建) 治疗四肢长骨 GCT 伴病理性骨折疗效的最佳证据,为临床提供参考。
资料与方法
一、纳入标准与排除标准
1. 纳入标准:(1) 1966~2020 年,发表的采用囊内刮除术或瘤段切除术治疗四肢长骨 GCT 伴病理性骨折相比较的研究;(2) 纳入病例均经过影像学与病理活检确诊;(3) 为公开的文献资料;(4) 纳入的研究中一般资料、数据齐全,有明确的随访截尾时的计数资料。
2. 排除标准:(1) 非疾病因素导致患肢骨折,如外伤、过度负重;(2) 由于转移癌导致的病理性骨折;(3) 无法从文献中提取出有效的结局数据; (4) 原发恶性 GCT 患者,合并其它良性肿瘤或恶性肿瘤;(5) 孤立病例报告或病例数据偏少 (少于 5 例患者)。
二、检索策略
为检索到更多相关文献,中文数据库以“骨巨细胞瘤”、“病理性骨折”、“病理骨折”为检索词,检索中国知网、万方、维普、中国生物医学文献数据库和中国临床注册中心。检索 MeSH 与 Emtree 两个主题词表,英文数据库以“Giant cell tumor of bone”、“osteoclastoma”、“Bone Neoplasms”“Pathological fracture”、“Fracture, Spontaneous”、“Spontaneous Fracture”、“Spontaneous Fractures”、“Fracture, Pathological”、“Fractures, Pathologic”、“Pathologic Fracture”、“Pathologic Fractures”、“Pathological Fractures”、“Fractures, Pathological”、“Fracture,Pathologic”、“Pathological Fracture”、“extended curettage”、“intralesional surgery”、“intralesional curettage”、“curettage”、“segmental resection”、“wide resection”“segmental excision”、“resection”、“Extra-compartmental extension”、“En Bloc Resection”,为检索词,按 CMSIG 制订的检索策略计算机检索 PubMed、Embase、Cochrane 图书馆及美国临床注册中心。手工检索查阅所附的参考文献,遇信息不详时与作者联系。
三、文献质量评价
2 名调查人员独立审查检索文献,并提取被认为有可能符合进一步审议条件的文章全文,以供进一步分析。对资料提取和质量评价的结果不一致时交给第 3 方处理或通过进一步查阅原文献协商解决。文献纳入的研究为队列研究。对纳入的研究按纽卡斯尔 - 渥太华量表 (newcastle-ottawa scale,NOS) 评价。文献质量评价采用了星级系统的半量化原则,满分为 9 颗星。
四、统计学处理
统计软件用 Cochrane 协作网提供的 RevMan 5.3。采用χ2进行研究间的异质性检验,以P< 0.05 为检验水准,根据I2判断异质性的大小。当研究间存在异质性时,尽可能找出来源,必要行亚组分析。二分类变量采用相对危险度 (RR),对度量衡单位相同的连续性变量采用加权均数差 (WMD),不同者采用标准化均数差 (SMD),两者均以 95% 可信区间用 (CI) 表示。对有失访的研究,进行最差情况演示分析,即两组失访均按无效计,并评估发表 偏倚。
结 果
一、研究描述及质量评价
按检索策略共查到相关文献 300 篇。经阅读标题、摘要、全文后,因研究目的不符、重复发表或资料不全被排除的文献 291 篇,最终纳入 9 篇文献,中文文献 (n= 2),外文文献 (n= 7) (图 1,表 1)。

表1 纳入的研究按 NOS 评价Tab.1 The newcastle-ottawa scale (NOS)
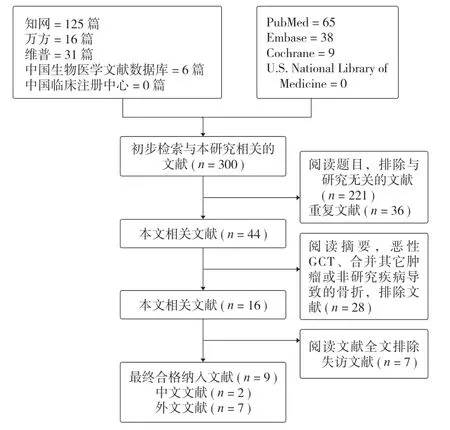
图1 文献来源与筛选Fig.1 Flow chart of study screening
二、Meta 分析结果
1. 术后复发率的评价:本研究纳入 9 篇文献,共 307 例,对术后复发率进行了统计,各研究间异质性无统计学意义 (P= 0.88 > 0.1,I2= 0% < 50%),采用固定效应模型,结果两种术式术后复发率的差异有统计学意义 (RR= 4.44,95%CI:1.87~10.57,P= 0.0008)。提示在术后复发率上,扩大切除重建组要优于刮除内固定组,差异有统计学意义 (图 2)。漏斗图示对称 (图 3),不存在发表偏倚。

图2 术后复发率的森林图Fig.2 Forest plot of postoperative recurrence rate
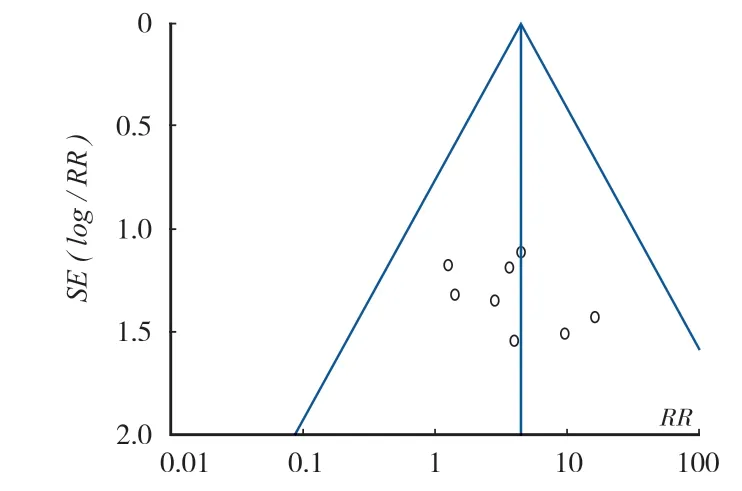
图3 术后复发率的漏斗图Fig.3 Funnel chart of postoperative recurrence rate
2. 术后并发症发生率的评价:4 篇文献对术后并发症进行了统计,各研究间异质性无统计学意义 (P= 0.41 > 0.1,I2= 0% < 50%),采用固定效应模型,结果两种术式术后并发症发生率差异有统计学意义 (RR= 0.38,95%CI:0.18~0.81,P= 0.01)。这表明在术后并发症发生率上,刮除内固定组要低于扩大切除重建组,差异有统计学意义 (图 4)。漏斗图示对称 (图 5),不存在发表偏倚。

图4 术后并发症发生率的森林图Fig.4 Forest plot of postoperative complication rate

图5 术后并发症发生率的漏斗图Fig.5 Funnel chart of postoperative complication rate
3. 术后功能评分的评价:术后功能评价均采用骨与软组织肿瘤协会 (Muscuioskeietai tumor society,MSTS) -93 进行评分。4 篇文献对术后功能评分进行了统计,各研究间异质性无统计学意义 (P= 0.22 > 0.1,I2= 32% < 50%),采用固定效应模型,结果两种术式术后功能评分差异有统计学意义 (MD= 8.31,95%CI:6.05~10.56,P= 0.000 01)。这表明在术后功能恢复上,刮除内固定组要优于扩大切除重建组,差异有统计学意义 (图 6)。漏斗图示对称 (图 7),不存在发表偏倚。

图6 术后功能评分的森林图Fig.6 Forest plot of postoperative functional score
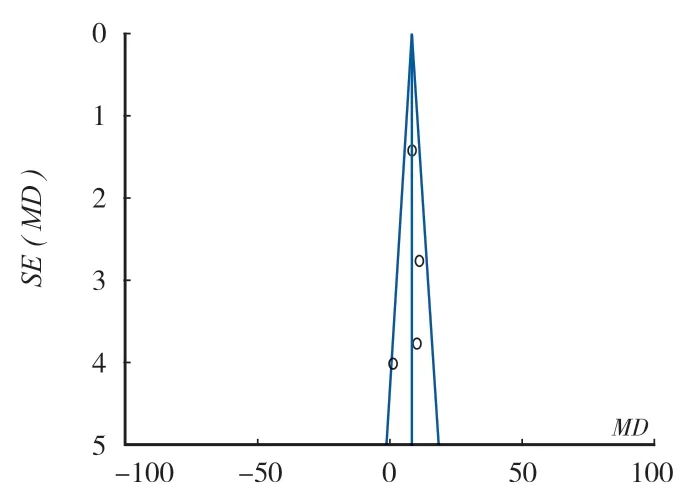
图7 术后功能评分的漏斗图Fig.7 Funnel chart of postoperative functional score
4. 术后再手术率的评价:4 篇文献对术后再手术率进行了统计,各研究间异质性无统计学意义 (P= 0.44 > 0.1,I2= 0% < 50%),采用固定效应模型,结果两种术式术后再手术率差异无统计学意义 (RR= 0.71,95%CI:0.34~1.48,P= 0.36)。提示再手术率,扩大切除重建组与刮除内固定组,两种术式差异无统计学意义 (图 8),漏斗图示对称 (图 9),不存在发表偏倚。

图8 术后再手术率的森林图Fig.8 Forest plot of postoperative re-operation rate

图9 术后再手术率漏斗图Fig.9 Funnel chart of postoperative re-operation rate
讨 论
本研究共纳入 9 篇文献[5-13]。使用 NOS 进行文献质量评价,3 篇 7 分,6 篇 8 分。所有研究均有明确的纳入、排除标准,统计数据均无遗漏,代表性尚好。但因合并的研究均为回顾性研究,且尽管严格按照公认有效的检索策略实施文献检索,删除了大量不符合纳入标准的文献,但由于语种的限制和沟通渠道的缺乏,少量已发表的文献中的信息可能缺失,可能存在选择性偏倚。四项分析评价均绘制漏斗图,显示漏斗图是对称的,不存在发表偏倚。
文献指出 GCT 的 Campanacci 分级系统与 Enneking 提出的总体良性骨肿瘤分级系统相似。Campanacci 分级系统并未给外科治疗决策提供有价值的指导。并指出分级系统与局部复发或转移的发生率之间没有相关性[7,14]。Rock、Wuismann 及包括 Campanacci 等在内的许多作者发现复发风险与肿瘤的放射学分级之间无相关性[15-16]。Balke 等[17]回顾了 214 例 GCT 病例,发现 Ⅲ 级肿瘤的复发率高于 Ⅱ 级 (31.3%、20.0%),无显著差异。尽管已经提出了基于组织学、临床和放射学表现的不同分类,但不能准确评估 GCT 的侵袭性或严重性[18]。所纳入的文献中作者也未对不同肿瘤进行分级对比处理。
GCT 是由具有破骨活性的单核基质细胞和多核巨细胞组成的良性肿瘤。典型的表现是一个边界清楚但非硬化性边缘的溶解性病变,位置偏心,可延伸至关节面附近,GCT 通常发生在长骨的骨骺部位 (75%~90%),大约 84%~99% 的病变延伸到关节下骨 1 cm 以内[2]。尽管大多是良性,1.0%~3.2% 的患者会发生肉瘤恶变或肺转移。以往病理性骨折被认为是一种潜在的更具侵袭性的 GCT 亚型,不适合病灶刮除,因局部复发率更高,功能更差。
文献报道骨折组和非骨折组的 5 年无复发生存率 (RFS)、无转移生存率无显著差异。骨折程度与局部复发风险之间也没有关联。大量的文献认为有无病理性骨折的患者的功能预后和复发率相 当[19-20]。有学者认为肿瘤位置、分级、软组织浸润和病理性骨折对复发和转移没有影响。相反,有文献报道有软组织侵犯的病理性骨折患者的无复发生存率值明显低于无软组织侵犯的病理性骨折患者。Gaston、Salerno 等认为复发与软组织浸润和病理骨折相关。Li 等[21]研究发现软组织侵犯会增加肿瘤复发率。但是完全切除肿瘤组织在技术上是困难的,而且目前手术后缺乏适用的软组织局部辅助手段,最终导致软组织受侵犯的 GCT 患者复发率高。van der Heijden 等[10]认为软组织污染、复杂骨折、局部复发以及重建后结构不能恢复等会增加伴病理性骨折的 GCT 较高的复发风险。Kamal 等[19]报道在 7 例软组织污染中 5 例复发。本 Meta 分析结果提示在术后复发率上瘤段切除组要优于囊内刮除组。瘤段切除复发率低可能因为切除范围大。病理骨折可能造成肿瘤的局部播散,软组织受累,单纯的囊内刮除难以将瘤腔壁中肿瘤组织及软组织中的肿瘤组织完整切除,并且目前缺乏术后适用于软组织的局部辅助治疗手段,遗漏复发病灶,表现出囊内刮除复发率较高。研究表明,与灶内刮除相比,广泛切除有助于降低局部复发风险,将无复发生存率提高至 84%~100%[22]。
文献报道,囊内刮除与较高的复发率相关,而切缘较宽的切除可将肿瘤复发降至最低,但与较差的功能结果相关。李晓等研究表明,与切除相比,刮除术并发症发生率低,功能好[9]。瘤段切除有助于降低局部复发风险;然而,瘤段切除与较高的手术并发症发生率相关,并伴有相当大的功能损害。包括假体无菌性松动、骨不连、同种异体移植失败和假关节。van der Heijden 等[10]报道了这些发生率,如移植物骨折 16%,骨不连 19%,无菌性松动假体 19%,假体周围感染 11%~34%,这就增加了翻修手术的需要。膝关节周围的 GCT 瘤段切除还会损伤膝关节周围稳定装置,影响膝关节的功能。伴病理性骨折的 GCT 患者,对于不同的手术方式在术后并发症上,本 Meta 分析与大多数文献报道基本一致。囊内刮除组并发症更少,它可以提供早期负重活动,并有功能支架支撑,这促进了骨折的愈合及患者的功能恢复[21]。
虽然文献报道与本 Meta 分析得出扩大切除重建术会导致更高的并发症,但是再手术率与刮除组差异无统计学意义 (P> 0.05)。刮除组再手术 (8 / 67),扩大切除组 (19 / 110)。李晓等[9]指出行二次手术主要原因包括局部复发和假体相关并发症。分析本研究的数据,刮除组再次手术主要原因为肿瘤复发,而扩大切除组再次手术原因主要为相关并发症,如感染、翻修。印证了上述观点。但本研究纳入的数据较少,须进一步扩大样本量,对观点进行验证。
大多数文献报道刮除术后 MSTS 评分高于瘤段切除术后评分。Deheshi 等报道保留自体关节的患者是否伴有病理性骨折在功能评分上没有差别,甚至对于伴或不伴有关节内骨折的病理性骨折病例,功能评分差异无统计学意义。李晓等[9]报道术后 MSTS 评分刮除组要略好于扩大切除组。本篇 Meta 分析共对 172 例数据分析,显示在术后功能恢复上,囊内刮除组要优于瘤段切除组 (P< 0.01)。分析纳入文献,不同研究纳入患者的肿瘤分期、切除的范围、手术方式及术后康复训练的情况都可能不同,都会导致患者功能恢复情况不同。对于术后功能评分的比较分析应进一步细化,将各种可能存在的影响因素进行分组,进行比较分析,进而得到更可靠的证据。
对于合并病理骨折的肢体 GCT 治疗策略,目前仍存在争议。文献报道认为最重要的治疗方式评价标准是肿瘤复发率的控制和重建方法的功能评估和持久耐用。目前文献提示 GCT 的理想治疗方法是尽可能保留关节的同时切除肿瘤。关于最佳的刮除方法,包括使用填充物和佐剂,以降低复发率,目前还没有达成共识[4]。切除的适应证应是有软组织侵犯的大肿瘤、关节侵犯或骨折类型不稳定、多次复发或消耗性骨[13]。Mavrogenis 等[2]和 Medellin 等[23]认为 Campanacci Ⅰ 级和 Ⅱ 级病变应行病灶内刮除术,Ⅲ 级病变可行整块切除重建。
一些辅助药物的使用对治疗起到了积极的作用。地诺单抗对肿瘤有抑制作用,双磷酸盐可直接抑制 GCT 基质细胞的增殖并诱导凋亡。地舒单抗对于不可切除的或转移性 GCT 的控制作用较好,NCCN 和 EMSO 指南建议长期使用地诺单抗[24-26]。体外研究表明,细胞增殖仅被地诺单抗抑制。抑制破骨细胞的生成。但一旦微环境中没有地诺单抗,肿瘤细胞就会再次增殖。地诺单抗可一定程度修复瘤壁,使伴病理性骨折的 GCT 具备刮除条件[27]。可使肿瘤缩小,在肿瘤的边缘形成类似于间室的“硬化壳”,降低外科学分期。在长期使用地诺单抗治疗的 GCT 停药后出现复发的约 40%,尤其用药后刮除的患者,中位复发时间 8 (7~15) 个月;而复发病灶可能来源于硬化壳中残余的单核基质细胞,肿瘤在用药后在硬化骨中重新分布,因单囊纯的囊内刮除术很难将硬化骨中的肿瘤细胞彻底清除,这也可能是使用地诺单抗的伴病理性骨折的 GCT 高复发率的另一个原因。
纳入的大多数研究都是回顾性研究。因此,可能存在固有的偏倚,特别是在患者选择、不同的治疗方案方面。本研究使用 NOS 对纳入的研究进行的评估表明,证据的质量尚可。还有一个可能导致偏倚的原因是,因纳入的文献未对不同肿瘤分期、不同重建方法、不同辅助治疗进行分组研究,文章也无法对各种因素进行亚组分析。另一个因素是本研究纳入的研究数据有限。对于研究伴病理性骨折的长骨 GCT 选择何种术式还需进一步扩大样本量、进行多因素的亚组分析,汇总研究结果,以获得更可靠的临床证据。
本篇 Meta 分析结果提示,四肢长骨 GCT 伴病理性骨折的手术治疗中,对于术后复发率,瘤段切除术要优于囊内刮除术。术后功能评分及主要并发症发生率,囊内刮除术要优于瘤段切除术。再手术率方面两者无统计学差异。考虑到 GCT 为良性疾病,患者年轻,切除术并发症率高,Campanacci Ⅰ 级和 Ⅱ 级病变可考虑广泛刮除术。有软组织侵犯的大肿瘤、关节侵犯、骨折类型不稳定、多次复发或消耗性骨可考虑瘤段切除术。但具体手术方式还应根据每例患者疾病的不同情况,综合考虑选择治疗方式。
