委陵菜酸对幽门螺杆菌诱导GES-1细胞损伤的保护作用
2021-08-25贺海波朱丽金贺君宇江伟杰陈烨韬宋利华张继红
贺海波,朱丽金,贺君宇,江伟杰,王 晓,彭 校,陈烨韬,宋利华,张继红,邹 坤
委陵菜酸对幽门螺杆菌诱导GES-1细胞损伤的保护作用
贺海波1,朱丽金1,贺君宇2,江伟杰1,王 晓1,彭 校1,陈烨韬1,宋利华1,张继红3*,邹 坤1
1. 三峡大学 天然产物研究与利用湖北省重点实验室,药食同源大健康产品开发利用宜昌市重点实验室,湖北 宜昌 443002 2. 三峡大学医学院,湖北 宜昌 443002 3. 三峡大学中医临床医学院脾胃病科,湖北 宜昌 443002
探索委陵菜酸对幽门螺杆菌(,Hp)诱导人胃黏膜上皮细胞GES-1损伤的影响。GES-1细胞与Hp共培养,给予委陵菜酸和NOD样受体家族3(NOD-like receptor family 3,NLRP3)抑制剂MCC950,考察各组细胞存活率、乳酸脱氢酶(lactate dehydrogenase,LDH)释放率、集落形成、凋亡率、线粒体膜电位和活性氧自由基(reactive oxygen species,ROS)变化;采用ELISA法检测各组细胞上清液中单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、角质细胞趋化因子(keratinocyte chemokines,KC)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin -1β,IL-1β)、IL-6、IL-18、IL-4和IL-10水平;采用试剂盒检测各组细胞谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量;采用qRT-PCR检测各组细胞Toll样受体4(toll-like receptor 4,)、髓样分化因子88(myeloid differentiation factor 88,)、、、和mRNA表达情况;采用Western blotting法检测各组细胞TLR4/NLRP3/核因子-κB(nuclear factor-κB,NF-κB)和线粒体凋亡信号通路相关蛋白表达情况。委陵菜酸显著抑制Hp诱导的GES-1细胞LDH释放率(<0.05、0.01),促进细胞集落形成(<0.05、0.01),抑制细胞凋亡(<0.05、0.01);升高细胞线粒体膜电位(<0.01),降低ROS水平(<0.01);降低上清液中MCP-1、KC、TNF-α、IL-1β、IL-6和IL-18水平(<0.01),升高IL-4和IL-10水平(<0.01);升高细胞GSH-Px、SOD和CAT活性(<0.01),降低MDA含量(<0.01);降低细胞、、、mRNA表达水平(<0.01),升高、mRNA表达水平和/、/(<0.01);下调细胞TLR4、MyD88、磷酸化IκB激酶β(phosphorylated inhibitor kappa B kinase β,p-IKKβ)、p-IκBα、NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)、半胱氨酸蛋白酶-1前体(pro-Caspase-1)、Caspase-1、硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)、pro-IL-1β、pro-IL-18、Bax、Bad、细胞色素C、凋亡酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)、剪切型Caspase-9(cleaved Caspase-9)、cleaved Caspase-3和胞核p65蛋白表达水平(<0.01),上调Bcl-2、Bcl-xl、pro-Caspase-9、pro-Caspase-3和胞质p65蛋白表达水平(<0.01)。委陵菜酸对Hp诱导的GES-1细胞损伤具有明显保护作用,其作用机制可能与增强内源性抗氧化系统功能、抑制氧化应激、炎性反应及TLR4/NF-κB/NLRP3炎症小体信号通路激活,从而减少线粒体介导的凋亡密切相关。
委陵菜酸;GES-1细胞;幽门螺杆菌;炎性反应;NLRP3炎症小体激活;线粒体功能
幽门螺杆菌(Hp)是一种能够持续定植在胃内并引起胃黏膜炎性反应的微需氧革兰阴性杆菌。目前,世界范围内Hp的人群感染率已超过50%[1]。Hp感染与胃溃疡、胃炎和胃腺癌等许多疾病的发生发展有关,成功根除Hp可有效缓解胃症状,并降低溃疡复发率和胃癌发生率[2]。目前临床上用于清除Hp感染常用的方法有三联疗法和四联疗法,由于其耐药性和Hp感染流行病学变化,以及腹泻和胃肠道异常反应等不良反应发生率高、依从性差,长期使用多种抗生素可导致肠道菌群紊乱等诸多不足,导致治愈率大幅降低[3]。
定植于胃黏膜上皮中的Hp释放毒素相关基因A(cytotoxin-associated gene A,CagA)、空泡毒素A(Vac lating cytotoxin A,VacA)和尿素酶等毒性因子诱导促炎因子释放及氧化损伤,而促炎因子通过激活中性粒细胞,诱导活性氧自由基(reactive oxygen species,ROS)大量产生,促进硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)与NOD样受体家族3(NOD-like receptor family 3,NLRP3)结合并激活NLRP3炎症小体,导致半胱氨酸蛋白酶-1(Caspase-1)活化,将白细胞介素-1β前体(interleukin-1β precursor,pro-IL-1β)和pro-IL-18剪切为成熟的IL-1β和IL-18形式,介导炎性反应[2]。Huang等[4]发现IL-1β分泌过多与胃癌的发生发展密切相关。因此,抑制ROS产生和pro-IL-1β、pro-IL-18活化有利于Hp感染和Hp相关性胃炎的治疗。
木瓜为贴梗海棠(Sweet) Nakai的干燥近成熟果实,性味酸、温,归肝、脾经,具有舒筋活络、和胃化湿的功效,用于治疗湿痹拘挛、腰膝关节酸重疼痛、暑湿吐泻、转筋挛痛、脚气水肿等症[5]。本课题组前期研究发现,木瓜的重要活性成分木瓜三萜对脂多糖诱导的小鼠单核巨噬细胞RAW264.7及佐剂性关节炎大鼠具有较好的抗炎活性,可有效抑制消化道炎性损伤和炎性细胞浸润[6-9]。委陵菜酸为木瓜三萜中一种重要的活性成分[8],可显著降低脂多糖诱导的RAW264.7细胞IL-6和IL-8水平,抑制甲基-苯基-吡啶离子(1-methyl-4- phenylpyr-idinium,MPP+)诱导的人神经母细胞瘤细胞SH-SY5Y内ROS大量生成和细胞凋亡,与抑制免疫炎性反应、炎性因子分泌和调控线粒体凋亡通路有关[9-11]。本研究拟在此基础上,通过Hp诱导人胃黏膜上皮细胞GES-1损伤,围绕炎性反应、NLRP3炎症小体激活和线粒体功能来研究委陵菜酸对Hp诱导的GES-1细胞损伤的影响及机制,为其临床治疗Hp相关疾病提供依据。
1 材料
1.1 细胞
GES-1细胞由南华大学顾洪峰教授惠赠;Hp NCTC11637菌株由湖南中医药大学基础医学院病原免疫学教研室伍参荣教授馈赠。
1.2 药品与试剂
委陵菜酸(图1)由本课题组从长阳土家族自治县资丘产皱皮木瓜(Sweet) Nakai中分离,并采用紫外、红外、质谱、核磁共振等波谱学方法对其结构进行鉴定,其质量分数为98.15%[9];RPMI 1640培养基、二甲基亚砜(DMSO)、胎牛血清、MTT、Hoechst 33258、JC-1线粒体膜电位检测试剂盒、DCFH-DA探针(批号分别为C22400500BT、D8371、SA190501、T8877、808365、0MYL03、S0033)购自美国Sigma公司;Annexin V-FITC/碘化丙啶(PI)试剂盒(批号CA1020)购自北京索莱宝科技有限公司;NLRP3抑制剂MCC950(批号5381200001)购自英国Tocris公司;ROS(批号1275755)购自美国Invitrogen公司;考马斯亮蓝蛋白质定量试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)试剂盒(批号分别为A045-2、A004、A007-1、A001-1、A005、A003-1、A007-1)购自南京建成生物工程研究所;单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、角质细胞趋化因子(keratinocyte chemokines,KC)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6、IL-18、IL-4、IL-10 ELISA试剂盒(批号分别为DKW12-1050-096、DKW12-22310-096、DKW12-2720-096、DKW12- 1060-096、DKW12-2050-096、DKW12-3140-096、DKW12-1080-096、DKW12-2100-096)购自深圳市达科为生物技术股份有限公司;Toll样受体4(toll-like receptor 4,TLR4)、髓样分化因子(myeloid differentiation factor 88,MyD88)、B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)、Bcl-xl、Bcl-2相关X蛋白基因(Bcl-2 associated X protein,Bax)、Bad、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物、Trizol(批号12183555)、DEPC水(批号18080044)购自生工生物工程(上海)股份有限公司;Prime Script TM RT reagent Kit、Taq DNA聚合酶(批号分别为600320、603270)购自宝生物工程(大连)有限公司;IκB激酶β(inhibitor kappa B kinase β,IKKβ)、磷酸化IKKβ(p-IKKβ)、IκBα、p-IκBα、p65、NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)、Caspase-1前体(pro-Caspase-1)、剪切型Caspase-1(cleaved Caspase-1)、TXNIP、Bcl-2、Bcl-xl、Bax、Bad、细胞色素C(cytochrome C)、凋亡酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)、pro-Caspase-9、cleaved Caspase-9、pro-Caspase-3、cleaved Caspase-3、β-actin抗体(批号分别为sc-1623、sc-0215、sc-7453、sc6721、sc478、sc0321、sc539、sc3291、sc0542、sc0570、sc492、sc356、sc194、sc365、c-sc13560、sc7846、sc7885、sc7654、sc7739、sc7541、sc-1616)购自美国Santa Cruz公司;HRP标记的IgG抗体(批号ab73400)购自英国Abcam公司;胞质蛋白提取试剂盒、胞核蛋白提取试剂盒、ECL发光试剂盒(批号分别为P0028、P0019、P0215)购自南京碧云天生物技术有限公司。
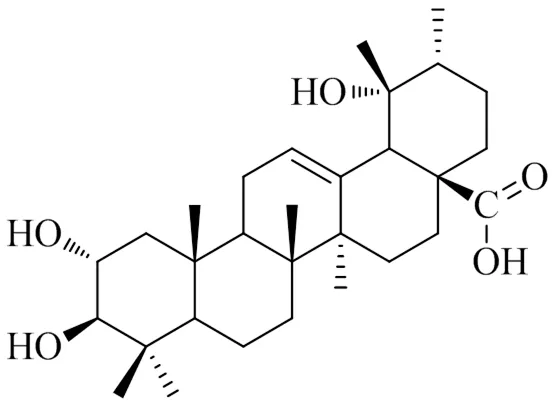
图1 委陵菜酸的化学结构
1.3 仪器
ME204E型电子天平(瑞士Mettler Toledo公司);VORTEX-6型高速旋涡混合器(美国奥然公司);5427R型高速冷冻离心机(德国Eppendorf公司);HVA-110型高压灭菌锅(日本Hirayama公司);MCO175型CO2培养箱(日本Sanyo公司);SW-CJ-1FD型超净工作台(苏州净化设备有限公司);ECLIPSE TS100TS100-F型倒置显微镜(日本Nikon公司);BX63型荧光显微镜(日本Olympus公司);FACSCanto II型流式细胞仪(美国BD公司);M200 PRO型酶联免疫检测仪(瑞士Tecan公司);NanoDrop One C型微量核酸蛋白浓度测定仪(美国Thermo Fisher Scientific公司);Eco48型qRT-PCR仪(英国Illumina公司);DYY-16D型电泳仪(北京六一生物科技有限公司)。
2 方法
2.1 细胞及细菌培养
GES-1细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养。Hp菌株用含10%卵黄和胎牛血清、可溶性淀粉、两性霉素、磺胺增效剂、万古霉素的布氏菌选择性培养基,于37 ℃、10% CO2、5% O2、85% N2培养箱中培养。
2.2 委陵菜酸对Hp诱导GES-1细胞存活率的影响
GES-1细胞以1×105/孔接种于96孔板中,待细胞贴壁生长至80%融合。委陵菜酸溶于DMSO配制成质量浓度为10 mg/mL的溶液,以培养基稀释成所需浓度,经0.22 μm滤膜滤过除菌。设置对照组、模型组和委陵菜酸(1.562 5、3.125 0、6.250 0、12.500 0、25.000 0、50.000 0 μg/mL)组,模型组和各给药组在感染复数(multiplicity of infection,MOI)为100的条件下与Hp共培养2 h,各给药组再加入相应药物,对照组和模型组加入不含药物的培养基,培养24 h。加入20 μL MTT溶液(5 mg/mL),于培养箱中孵育4 h,吸去培养基,加入150 μL DMSO,振荡10 min,采用酶标仪测定490 nm处的吸光度()值,计算细胞存活率。
细胞存活率=给药/对照
2.3 委陵菜酸对Hp诱导GES-1细胞LDH释放率的影响
按“2.2”项下方法处理细胞和分组,吸取上清液,按试剂盒说明书检测各组细胞LDH释放率。
2.4 委陵菜酸对Hp诱导GES-1细胞集落形成的影响
GES-1细胞以3×102/孔接种于6孔板中,待细胞贴壁生长至80%融合。设置对照组、模型组和委陵菜酸(3.125、6.250、12.500 μg/mL)组,模型组和各给药组在MOI=100条件下与Hp共培养2 h,各给药组再加入相应药物,对照组和模型组加入不含药物的培养基,培养14 d,每3天更换1次培养基。以PBS冲洗2次,用0.1%结晶紫染色15 min,PBS冲洗2次除去残留染料后,于显微镜下计数菌落数,计算克隆形成率[9]。
克隆形成率=克隆形成数/接种数
2.5 委陵菜酸对Hp诱导GES-1细胞凋亡的影响
GES-1细胞以1×105/孔接种于96孔板,设置对照组、模型组和委陵菜酸(3.125、6.250、12.500 μg/mL)组,按“2.2”项下方法进行处理,以PBS冲洗2次,加入Hoechst 33258染料于37 ℃染色10 min,以PBS冲洗2次去除残余染料后,于显微镜下观察细胞形态并拍照。
2.6 委陵菜酸和NLRP3抑制剂MCC950对Hp诱导GES-1细胞凋亡的影响
GES-1细胞以1×105/孔接种于96孔板,设置对照组、模型组、委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组,按“2.2”项下方法进行处理,收集细胞,用预冷的PBS冲洗,按Annexin V-FITC/PI试剂盒说明书进行染色,采用流式细胞仪检测各组细胞凋亡情况。
2.7 委陵菜酸和MCC950对Hp诱导GES-1细胞线粒体膜电位的影响
按“2.6”项下方法进行分组和处理,收集细胞,按试剂盒说明书测定各组细胞线粒体膜电位[9]。
2.8 委陵菜酸和MCC950对Hp诱导GES-1细胞ROS水平的影响
按“2.6”项下方法进行分组和处理,弃去上清,PBS洗涤1次,加入DCFH-DA探针(10 μmol/L),于培养箱中孵育30 min,PBS洗涤3次,收集细胞,采用荧光酶标仪检测各组细胞内ROS水平。
2.9 委陵菜酸和MCC950对Hp诱导GES-1细胞上清液中MCP-1、KC、TNF-α、IL-1β、IL-6、IL-18、IL-4和IL-10水平的影响
按“2.6”项下方法进行分组和处理,收集上清液,按试剂盒说明书测定各组细胞上清液中MCP-1、KC、TNF-α、IL-1β、IL-6、IL-18、IL-4和IL-10水平。
2.10 委陵菜酸和MCC950对Hp诱导GES-1细胞GSH-Px、SOD、CAT活性和MDA含量的影响
按“2.6”项下方法进行分组和处理,收集细胞,超声破碎后离心,收集上清,按试剂盒说明书测定各组细胞GSH-Px、SOD、CAT活性和MDA含量。
2.11 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4、MyD88、Bcl-2、Bcl-xl、Bax和Bad mRNA表达的影响
按“2.6”项下方法进行分组和处理,收集细胞,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.12 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4/NLRP3/核因子-κB(nuclear factor-κB,NF-κB)和线粒体凋亡信号通路相关蛋白表达的影响
按“2.6”项下方法进行分组和处理,按照总蛋白、胞质和胞核蛋白提取试剂盒说明书分别提取各组细胞总蛋白、胞质和胞核蛋白,经核酸测定仪测定蛋白含量后,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶封闭,分别加入TLR4、MyD88、IKKβ、p-IKKβ、IκBα、p-IκBα、p65、NLRP3、ASC、pro-Caspase-1、Caspase-1、TXNIP、Bcl-2、Bcl-xl、Bax、Bad、cytochrome C、Apaf-1、pro-Caspase-9、cleaved Caspase-9、pro-Caspase-3、cleaved Caspase-3和β-actin抗体,孵育过夜;加入HRP标记的IgG抗体孵育,加入ECL发光液显影[9,12]。
2.13 统计学处理
3 结果
3.1 委陵菜酸对Hp诱导GES-1细胞存活率的影响
如图2所示,与对照组比较,模型组细胞存活率显著降低(<0.01);与模型组比较,委陵菜酸(3.125 0、6.250 0、12.500 0、25.000 0、50.000 0 μg/mL)组细胞存活率显著升高(<0.05、0.01)。
3.2 委陵菜酸对Hp诱导GES-1细胞LDH释放率的影响
如图3所示,与对照组比较,模型组细胞LDH释放率显著升高(<0.01);与模型组比较,委陵菜酸(3.125 0、6.250 0、12.500 0、25.000 0、50.000 0 μg/mL)组细胞LDH释放率显著降低(<0.05、0.01),尤其以12.500 0 μg/mL委陵菜酸最为明显,因此以委陵菜酸的适宜质量浓度≤12.5 μg/mL进行后续研究。

与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下同
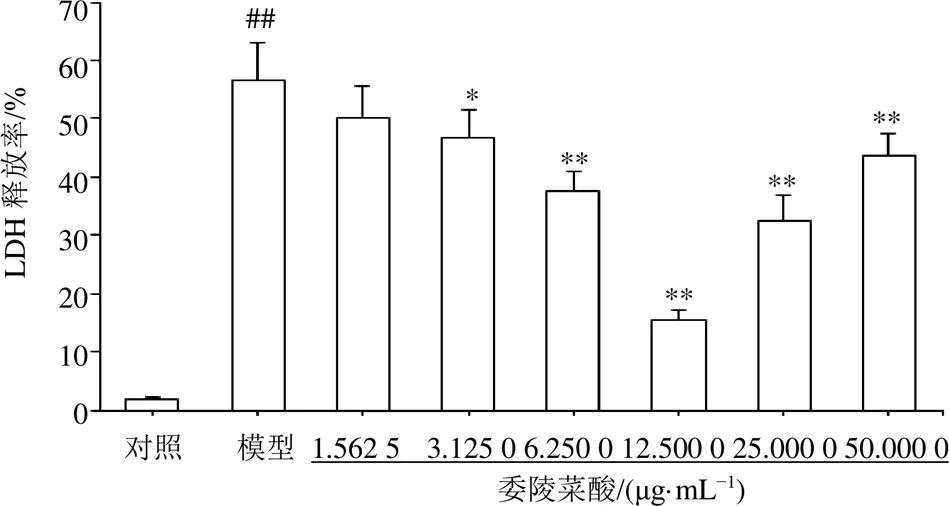
图3 委陵菜酸对Hp诱导GES-1细胞LDH释放率的影响(, n = 5)
3.3 委陵菜酸对Hp诱导GES-1细胞集落形成的影响
如图4所示,与对照组比较,模型组细胞克隆形成率明显降低(<0.01);与模型组比较,各给药组细胞克隆形成率显著升高(<0.05、0.01)。
3.4 委陵菜酸对Hp诱导GES-1细胞凋亡的影响
如图5所示,对照组细胞形态均一完整,呈现弱蓝色荧光,染色质分布均匀;模型组可见较多强蓝色荧光染色细胞,可观察到典型的凋亡小体,染色质浓缩,核碎裂成大小不等的圆形小体;各给药组细胞核的浓缩和碎裂明显减少,正常形态的细胞较多见。与对照组比较,模型组细胞凋亡率显著升高(<0.01);与模型组比较,各给药组细胞凋亡率显著降低(<0.05、0.01)。

图4 委陵菜酸对Hp诱导GES-1细胞集落形成的影响(, n = 5)

箭头表示凋亡小体
3.5 委陵菜酸和NLRP3抑制剂MCC950对Hp诱导GES-1细胞凋亡的影响
NLRP3炎性小体的活化是Hp感染引起促炎因子产生增加的重要机制之一,靶向NLRP3炎性小体可能是抗Hp感染和治疗Hp相关胃炎的策略[13]。如图6所示,与对照组比较,模型组细胞凋亡率显著升高(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞凋亡率均显著降低(<0.01)。
3.6 委陵菜酸和MCC950对Hp诱导GES-1细胞线粒体膜电位和ROS水平的影响
线粒体是细胞凋亡调控的中心,线粒体活力减弱引起线粒体膜去极化,线粒体膜电位降低,触发线粒体介导的一系列凋亡过程[7]。细胞内ROS大量生成会导致线粒体膜脂质过氧化损伤,线粒体膜电位降低[8]。因此,ROS大量生成及由此引起的线粒体膜电位下降是线粒体调控凋亡过程中最早期的特异性改变。如表2所示,与对照组比较,模型组细胞线粒体膜电位显著降低(<0.01),ROS水平显著升高(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞线粒体膜电位显著升高(<0.01),ROS水平显著降低(<0.01)。表明委陵菜酸可以有效抑制Hp诱导的GES-1细胞ROS生成及线粒体膜脂质过氧化反应,从而恢复线粒体膜正常的电位水平。

图6 委陵菜酸和NLRP3抑制剂MCC950对Hp诱导GES-1细胞凋亡的影响(, n = 5)

表2 委陵菜酸和MCC950对Hp诱导GES-1细胞线粒体膜电位和ROS水平的影响(, n = 5)
与对照组比较:##<0.01;与模型组比较:*<0.05**<0.01,下表同
##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
3.7 委陵菜酸和MCC950对Hp诱导GES-1细胞上清液中MCP-1、KC、TNF-α、IL-1β、IL-6、IL-18、IL-4和IL-10水平的影响
如表3所示,与对照组比较,模型组细胞上清液中趋化因子(MCP-1、KC)和促炎因子(TNF-α、IL-1β、IL-6、IL-18)水平显著升高(<0.01),抗炎因子(IL-4、IL-10)水平显著降低(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞上清液中趋化因子(MCP-1、KC)和促炎因子(TNF-α、IL-1β、IL-6、IL-18)水平显著降低(<0.01),抗炎因子(IL-4、IL-10)水平显著升高(<0.01)。
3.8 委陵菜酸和MCC950对Hp诱导GES-1细胞GSH-Px、SOD、CAT活性和MDA含量的影响
如表4所示,与对照组比较,模型组细胞GSH-Px、SOD和CAT活性明显降低(<0.01),MDA含量显著升高(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞GSH-Px、SOD和CAT活性明显升高(<0.01),MDA含量显著降低(<0.01)。

表3 委陵菜酸和MCC950对Hp诱导GES-1细胞上清液中MCP-1、KC、TNF-α、IL-1β、IL-6、IL-18、IL-4和IL-10水平的影响(, n = 5)

表4 委陵菜酸和MCC950对Hp诱导GES-1细胞GSH-Px、SOD、CAT活性和MDA含量的影响(, n = 5)
3.9 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4、MyD88、Bcl-2、Bcl-xl、Bax和Bad mRNA表达的影响
如表5所示,与对照组比较,模型组细胞、、、mRNA表达水平显著升高(<0.01),、mRNA表达水平显著降低(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞、、、mRNA表达水平显著降低(<0.01),、mRNA表达水平显著升高(<0.01)。

表5 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4、MyD88、Bcl-2、Bcl-xl、Bax和Bad mRNA表达的影响(, n = 5)
3.10 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4/NF-κB/NLRP3炎症小体信号通路相关蛋白表达的影响
如图7和表6~8所示,与对照组比较,模型组细胞TLR4、MyD88、p-IKKβ、p-IκBα、NLRP3、ASC、pro-Caspase-1、Caspase-1、TXNIP、pro-IL-1β、pro-IL-18和胞核p65蛋白表达水平均显著升高(<0.01),胞质p65蛋白表达水平显著降低(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞TLR4、MyD88、p-IKKβ、p-IκBα、NLRP3、ASC、pro-Caspase-1、Caspase-1、TXNIP、pro-IL-1β、pro-IL-18和胞核p65蛋白表达水平均显著降低(<0.01),胞质p65蛋白表达水平显著升高(<0.01)。
3.11 委陵菜酸和MCC950对Hp诱导GES-1细胞线粒体凋亡信号通路相关蛋白表达的影响
如图8和表9、10所示,与对照组比较,模型组细胞Bax、Bad、cytochrome C、Apaf-1、cleaved Caspase-9和cleaved Caspase-3蛋白表达水平显著升高(<0.01),Bcl-2、Bcl-xl、pro-Caspase-9、pro-Caspase-3蛋白表达水平显著降低(<0.01);与模型组比较,委陵菜酸(12.5 μg/mL)组和MCC950(8 μmol/L)组细胞Bax、Bad、cytochrome C、Apaf-1、cleaved Caspase-9和cleaved Caspase-3蛋白表达水平均显著降低(<0.01),Bcl-2、Bcl-xl、pro-Caspase-9、pro-Caspase-3蛋白表达水平显著升高(<0.01)。

图7 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4/NF-κB/NLRP3炎症小体信号通路相关蛋白表达的影响

表6 委陵菜酸和MCC950对Hp诱导GES-1细胞TLR4/MyD88通路和IKK复合物相关蛋白表达的影响(, n = 5)

表7 委陵菜酸和MCC950对Hp诱导GES-1细胞NF-κB/NLRP3炎症小体信号通路相关蛋白表达的影响(, n = 5)

表8 委陵菜酸和MCC950对Hp诱导GES-1细胞炎性因子蛋白表达的影响(, n = 5)
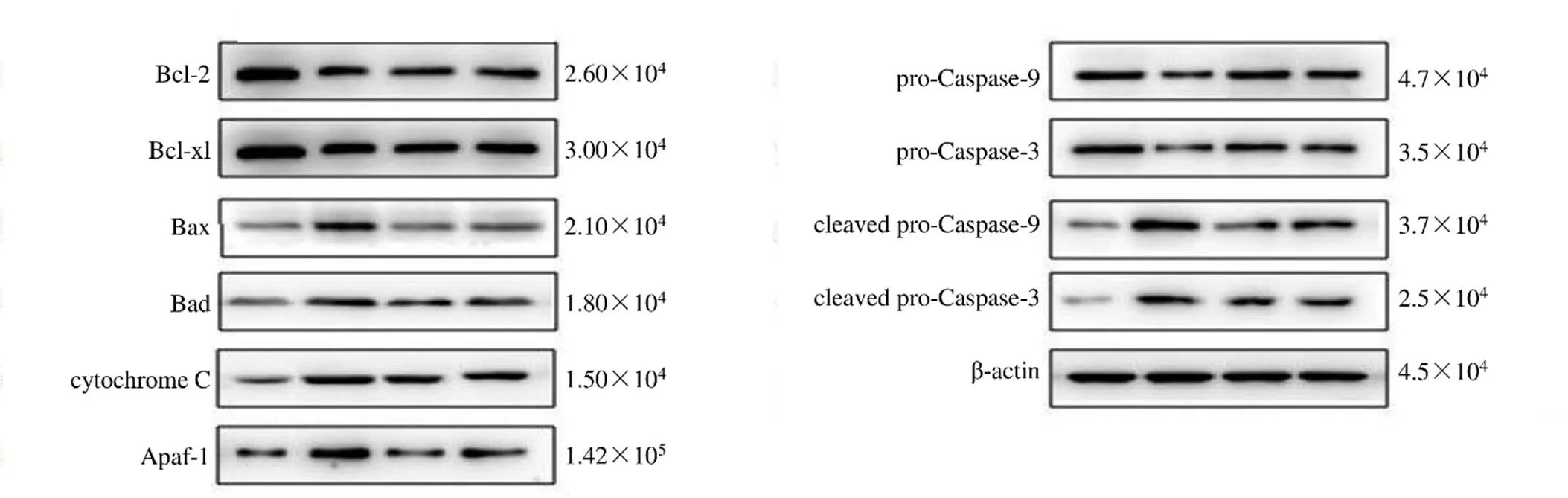
图8 委陵菜酸和MCC950对Hp诱导GES-1细胞线粒体凋亡信号通路相关蛋白表达的影响

表9 委陵菜酸和MCC950对Hp诱导GES-1细胞Bcl-2家族相关蛋白表达的影响(, n = 5)

表10 委陵菜酸和MCC950对Hp诱导GES-1细胞Caspase家族相关蛋白表达的影响(, n = 5)
4 讨论
陶弘景《名医别录》记载:“木瓜主湿痹邪气,霍乱大吐下,转筋不止”,可用于治湿浊中焦之腹痛吐泻转筋。土家族民间有食用木瓜防治胃肠炎、腰酸腿痛、风湿和类风湿关节炎传统。本课题组根据古代本草中的叙述及土家族民间用药习惯,筛选出了具有良好的胃肠道保护功效和促进受损胃肠道黏膜愈合作用的活性成分木瓜三萜[14],且证实其具有良好的抗炎、抗氧化活性[6-7],同时还兼有较好的保护胃肠黏膜、促进受损胃肠道修复作用[8-9,15-18]。委陵菜酸是从木瓜三萜中一种重要成分,具有良好的抗氧化、抗消化道炎性反应等活性[9-11]。目前委陵菜酸对Hp诱导的GES-1细胞损伤的影响尚不清楚,本研究通过建立Hp诱导的GES-1细胞损伤模型,探究委陵菜酸对Hp诱导的GES-1细胞的保护作用,在此基础上探寻其可能的作用机制。
定植于胃黏膜上皮中的Hp释放CagA、VacA和尿素酶等毒性因子,它们一方面刺激宿主上皮细胞中还原型辅酶II(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶产生内源性应激因子攻击胃黏膜上皮细胞膜,引发脂质过氧化,脂过氧化产物MDA增加,破坏细胞膜完整性,导致LDH从细胞内漏出[19-20];另一方面,这些毒性因子还可以影响宿主上皮细胞骨架重排,激活NF-κB通路,促进趋化因子(MCP-1、KC)和促炎因子(TNF-α、IL-1β、IL-6)表达和释放,进而引起胃黏膜损伤和胃上皮细胞凋亡[20-22]。本研究发现,与对照组比较,模型组细胞ROS、MDA水平和LDH释放率明显升高,上清液中MCP-1、KC、TNF-α、IL-1β、IL-6和IL-18水平显著升高,SOD、CAT、GSH-Px活性和上清液中IL-4、IL-10水平显著降低,表明Hp诱导的GES-1细胞损伤导致了氧化应激和炎性反应的发生,委陵菜酸能够抑制Hp诱导的GES-1细胞氧化应激和炎性反应。
Hp触发的炎性反应在Hp相关胃炎病理进程中起着重要作用[22-23]。当Hp感染胃上皮细胞后,释放的CagA、VacA、尿素酶和ROS等毒性因子被上皮细胞膜上的模式识别受体TLR4识别,促进MyD88募集和TLR4/MyD88复合体形成,通过信号级联,促进p65的活化,进而启动趋化因子、炎性因子的基因转录,促进MCP-1、KC、IL-6、TNF-α等分泌及pro-IL-18、pro-IL-1β和NLRP3产生,导致炎性反应信号传递和级联放大,参与Hp感染、胃溃疡、Hp相关胃炎等病理过程[22,24]。此外,CagA、VacA、尿素酶和ROS等毒性因子进入胃黏膜上皮细胞后,一方面可促进硫氧还蛋白/TXNIP复合物解离,通过促进ASC和pro-Caspase-1募集,完成NLRP3炎症小体的组装;另一方面可直接引起溶酶体破裂和/或线粒体损伤,导致组织蛋白酶B和/或线粒体内容物(ROS、DNA)释放,激活NLRP3炎症小体,诱导pro-Caspase-1自我剪切和Caspase-1释放,完成pro-IL-1β、pro-IL-18剪切,使IL-1β、IL-18释放,继而刺激上皮细胞,通过自分泌/旁分泌产生更多的趋化因子和炎性因子,加重Hp感染[24-25]。由此可见,TLR4/NF-κB/NLRP3炎症小体通路的激活是导致Hp感染胃黏膜上皮细胞后产生炎性反应的关键所在,靶向此通路可有效遏制Hp感染后胃黏膜损伤的病理进程。本研究结果显示,与对照组比较,模型组细胞p-IKKβ、p-IκBα、NLRP3、ASC、pro-Caspase-1、Caspase-1、TXNIP、pro-IL-1β、pro-IL-18、胞核p65蛋白表达水平显著升高,委陵菜酸干预后可有效逆转上述异常改变,表明委陵菜酸可通过抑制TLR4/NF-κB/NLRP3炎症小体信号通路炎性激活,进而抑制趋化因子、炎症因子的生成,从而发挥对Hp损伤的GES-1细胞的保护作用。由于Hp感染能够诱导多种细胞因子的产生,促使中性粒细胞、淋巴细胞、单核巨噬细胞等免疫细胞浸润于胃黏膜,最终导致Hp相关胃十二指肠疾病的发生[26]。在众多细胞因子中,IL-1β是目前已知的关键因子之一,IL-1β作为强有力的促炎因子,在Hp感染、胃溃疡、胃黏膜炎性反应以及胃癌的发生中发挥重要的作用,并且在Hp感染患者中IL-1β的水平与胃癌发生的风险密切相关。IL-1β的产生主要依赖于NLRP3炎性小体的形成及活化,活化后的pro-Caspase-1自身裂解形成有活性的Caspase-1,最终导致IL-1β等炎性因子的产生[27]。因此,NLRP3炎性小体的活化可能是Hp感染引起IL-1β水平增加、胃黏膜损伤、慢性萎缩性胃炎等病理过程以及系列疾病的机制之一。结合本研究中NLRP3抑制剂MCC950结果,发现委陵菜酸的细胞保护作用可能与抑制NLRP3炎症小体组装和活化有关。通过检测细胞中活化的Caspase-1和IL-1β、IL-18的水平,证实了委陵菜酸抑制NLRP3炎症小体活化的假说。
临床试验和动物实验表明,在Hp致胃黏膜病变中,细胞凋亡引起的胃黏膜上皮细胞丢失明显,是Hp感染相关性胃炎的必然原因[28-29]。在这个过程中,Bcl-2和Caspase家族起着重要作用,促凋亡蛋白(Bax、Bad)通过破坏线粒体膜的完整性进而诱导细胞凋亡,引起线粒体膜电位降低和线粒体膜内外生化变化,使cytochrome C从线粒体释放到细胞质中,促进Apaf-1与cytochrome C、Apaf-1和pro-caspase-9组装成凋亡小体,进而激活Caspase-3,触发细胞凋亡;抗凋亡蛋白(Bcl-2、Bcl-xl)能够抑制这一过程[30]。本研究结果显示,Hp损伤的GES-1细胞线粒体膜电位降低,细胞、mRNA和蛋白表达水平降低,、mRNA和蛋白表达水平升高,cytochrome C蛋白表达水平升高;委陵菜酸能够升高GES-1细胞线粒体膜电位,上调细胞、mRNA和蛋白表达水平,降低、mRNA和蛋白表达水平,表明委陵菜酸对Hp致GES-1细胞受损的线粒体功能具有较好的恢复作用。
Caspase在细胞凋亡信号通路的调控中起着重要作用。正常状态下,由cytochrome C、Apaf-1和pro-Caspase-9组成的中间复合物凋亡小体相对较少;当细胞受到凋亡刺激(如ROS、趋化因子、促炎因子等)时,可导致线粒体功能紊乱,cytochrome C大量生成,并从线粒体进入胞质,促进凋亡小体形成,然后依次将pro-Caspase-9、pro-Caspase-3切割成cleaved Caspase-9和cleaved Caspase-3,进而诱导细胞凋亡[31]。因此,Caspase-9和Caspase-3被认为是凋亡过程的另一个主要细胞病理学标志。本研究结果显示,Hp损伤的GES-1细胞pro-Caspase-9、pro-Caspase-3蛋白表达水平显著降低,Apaf-1、cleaved Caspase-9、cleaved Caspase-3蛋白表达水平明显升高;委陵菜酸明显改善Apaf-1和Caspase家族蛋白表达水平,提示委陵菜酸对Hp诱导的GES-1细胞损伤的保护作用与调控线粒体介导的凋亡通路有关。
综上所述,委陵菜酸对Hp诱导的GES-1细胞损伤有显著的保护作用,其作用机制可能与增强内源性抗氧化系统功能、抑制氧化应激、炎性反应及TLR4/NF-κB/NLRP3炎症小体信号通路激活,从而减少线粒体途径介导的凋亡密切相关。
利益冲突 所有作者均声明不存在利益冲突
[1] Marshall B J, Warren J R. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration [J]., 1984, 1(8390): 1311-1315.
[2] O'Connor A, Lamarque D, Gisbert J P,. Treatment ofinfection 2017 [J]., 2017, 22: e12410.
[3] Lian D W, Xu Y F, Ren W K,. Unraveling the novel protective effect of patchouli alcohol against-induced gastritis: Insights into the molecular mechanismand[J]., 2018, 9: 1347.
[4] Huang F Y, Chan A O, Lo R C,. Characterization of interleukin-1β in-induced gastric inflammation and DNA methylation in interleukin-1 receptor type 1 knockout (IL-1R1−/−) mice [J]., 2013, 49(12): 2760-2770.
[5] 中国药典[S]. 一部. 2020: 62-63.
[6] 王海燕, 覃慧林, 张永峰, 等. 木瓜三萜对佐剂性关节炎大鼠关节滑膜组织中Akt, NF-κB和促炎因子的表达影响 [J]. 中国实验方剂学杂志, 2017, 23(5): 141-146.
[7] 石孟琼, 覃慧林, 张永峰, 等. 木瓜三萜对脂多糖诱导下RAW264.7细胞炎症模型细胞因子的影响 [J]. 中药药理与临床, 2016, 32(3): 76-80.
[8] Zhang Y Y, Xu H Y, He H B,. Total triterpenes from the fruits of(Sweet) Nakai protects against indomethacin-induced gastric mucosal injury: Involvement of TFF1-mediated EGF/EGFR and apoptotic pathways [J]., 2020, 72(3): 409-423.
[9] He H B, Feng M L, Xu H Y,. Total triterpenoids from the fruits ofexerted gastroprotective activities on indomethacin-induced gastric damage via modulating microRNA-423-5p- mediated TFF/NAG-1 and apoptotic pathways [J]., 2020, 11(1): 662-679.
[10] An H J, Kim I T, Park H J,. Tormentic acid, a triterpenoid saponin, isolated from, inhibited LPS-induced iNOS, COX-2, and TNF-α expression through inactivation of the nuclear factor-κB pathway in RAW264.7 macrophages [J]., 2011, 11(4): 504-510.
[11] Lin X, Zhang S, Huang R,. Protective effect of tormentic acid fromagainst lipopolysaccharide/-galactosamine induced fulminant hepatic failure in mice [J]., 2014, 19(2): 365-372.
[12] 卢超, 石孟琼, 张媛媛, 等. 芪苈参萸益心方通过减轻炎症反应、溶酶体功能和抑制NLRP3炎症小体激活来发挥对心肌梗死大鼠的保护作用 [J]. 天然产物研究与开发, 2020, 32(11): 1833-1843.
[13] Pachathundikandi S K, Blaser N, Bruns H,.avoids the critical activation of NLRP3 inflammasome-mediated production of oncogenic mature IL-1β in human immune cells [J]., 2020, 12(4): E803.
[14] 汪鋆植, 闫喜明, 田华咏, 等. 以土家医三元论为指导的反选法在新药研究中的应用 [J]. 中草药, 2015, 46(15): 2189-2192.
[15] 贺海波, 李小琴, 李小妹, 等. 木瓜总三萜和奥美拉唑联用对吲哚美辛诱导大鼠胃溃疡的治疗作用研究 [J]. 中国中药杂志, 2019, 44(11): 2338-2347.
[16] 熊兴军, 李小妹, 何毓敏, 等. 木瓜总三萜对DSS诱导溃疡性结肠炎小鼠PPARγ/SIRT1/NF-κBp65信号通路及黏膜屏障的影响 [J]. 中国中药杂志, 2018, 43(21): 4295-4304.
[17] 李小妹, 贺君宇, 李爽, 等. 木瓜总三萜对非甾体抗炎药诱导大鼠小肠损伤的保护作用及机制研究 [J]. 中药药理与临床, 2018, 34(5): 55-60.
[18] Wang Y L, Sun G Y, Zhang Y,. Tormentic acid inhibits H2O2-induced oxidative stress and inflammation in rat vascular smooth muscle cells via inhibition of the NF-κB signaling pathway [J]., 2016, 14(4): 3559-3564.
[19] Paniagua G L, Monroy E, Rodríguez R,. Frequency of VacA, cagA and babA2 virulence markers instrains isolated from Mexican patients with chronic gastritis [J]., 2009, 8: 14.
[20] Lian D W, Xu Y F, Ren W K,. Unraveling the novel protective effect of patchouli alcohol against-induced gastritis: Insights into the molecular mechanismand[J]., 2018, 9: 1347.
[21] Weidner N, Mutsaers A J, Woods J P,. Plasma 25-hydroxyvitamin D and the inflammatory response in canine cancer [J]., 2021, 19(2): 232-241.
[22] Yang T, Wang R L, Liu H H,. Berberine regulates macrophage polarization through IL-4-STAT6 signaling pathway in-induced chronic atrophic gastritis [J]., 2021, 266: 118903.
[23] 吴娜, 万治平, 韩玲, 等. 黄芩汤对溃疡性结肠炎小鼠NLRP3/caspase-1细胞焦亡通路的影响 [J]. 中国中药杂志, 2021, 46(5): 1191-1196.
[24] Higashimori A, Watanabe T, Nadatani Y,. Role of nucleotide binding oligomerization domain-like receptor protein 3 inflammasome in stress-induced gastric injury [J]., 2021, 36(3): 740-750.
[25] Pachathundikandi S K, Blaser N, Backert S. Mechanisms of inflammasome signaling, microRNA induction and resolution of inflammation by[J]., 2019, 421: 267-302.
[26] Blaser N, Backert S, Pachathundikandi S K. Immune cell signaling by: Impact on gastric pathology [J]., 2019, 1149: 77-106.
[27] Kameoka S, Kameyama T, Hayashi T,.induces IL-1β protein through the inflammasome activation in differentiated macrophagic cells [J]., 2016, 37(1): 21-27.
[28] Siriviriyakul P, Werawatganon D, Phetnoo N,. Genistein attenuated gastric inflammation and apoptosis in-induced gastropathy in rats [J]., 2020, 20(1): 410.
[29] Pachathundikandi S K, Blaser N, Backert S. Mechanisms of inflammasome signaling, microRNA induction and resolution of inflammation by[J]., 2019, 421: 267-302.
[30] Mimuro H, Suzuki T, Nagai S,.dampens gut epithelial self-renewal by inhibiting apoptosis, a bacterial strategy to enhance colonization of the stomach [J]., 2007, 2(4): 250-263.
[31] Posselt G, Wiesauer M, Chichirau B E,.-controlled c-Abl localization promotes cell migration and limits apoptosis [J]., 2019, 17(1): 10.
Protective effect of tormentic acid oninduced GES-1 cells injury
HE Hai-bo1, ZHU Li-jin1, HEJun-yu2, JIANG Wei-jie1, WANG Xiao1, PENG Xiao1, CHEN Ye-tao1, SONG Li-hua1, ZHANG Ji-hong3, ZOU Kun1
1. Hubei Key Laboratory of Natural Products Research and Development, Yichang Key Laboratory of Development and Utilization of Health Products with Drug and Food Homology, China Three Gorges University, Yichang 443002, China 2. Medical College of China Three Gorges University, Yichang 443002, China 3. Department of Spleen and Stomach, Chinese Medicine Clinical Medical College, China Three Gorges University, Yichang 443002, China
To explore the effect of tormentic acid on(Hp)-induced human gastric mucosal epithelial cells GES-1 injury.GES-1 cells were co-cultured with Hp, and then given tormentic acid and NOD-like receptor family 3 (NLRP3) inhibitor MCC950. Cell survival rate, lactate dehydrogenase (LDH) release rate, colony formation, apoptosis rate, mitochondrial membrane potential and reactive oxygen species (ROS) were investigated; Levels of monocyte chemotactic protein-1 (MCP-1), keratinocyte chemokines (KC), tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), IL-6, IL-18, IL-4 and IL-10 in supernatant of GES-1 cells were detected by ELISA; Glutathione peroxidase (GSH-Px), superoxide dismutase (SOD), catalase (CAT) activities and malondialdehyde (MDA) levels were detected by kits; mRNA expressions of toll-like receptor 4 (), myeloid differentiation factor 88 (),,,andwere detected by qRT-PCR; The related protein expressions of TLR4/NLRP3/nuclear factor-κB (NF-κB) and mitochondrial apoptosis signal pathways were detected by Western blotting.Tormentic acid significantly inhibited the release rate of LDH induced by Hp (< 0.05, 0.01), promoted cells colony formation (< 0.05, 0.01), inhibited cell apoptosis (< 0.05, 0.01), increased mitochondrial membrane potential (< 0.01), decreased ROS level (< 0.01), reduced levels of MCP-1, KC, TNF-α, IL-1β, IL-6 and IL-18 in supernatant (< 0.01), increased levels of IL-4 and IL-10 in supernatant (< 0.01). Tormentic acid significantly increased activities of GSH-Px, SOD and CAT (< 0.01), reduced MDA level (< 0.01). Tormentic acid significantly reduced,,andmRNA expressions (< 0.01), increased,mRNA expressions and/,/(< 0.01). Tormentic acid significantly down-regulated TLR4, MyD88, phosphorylated IκB kinase β (p-IKKβ), p-IκBα, NLRP3, apoptosis-associated speck-like protein (ASC), pro-Caspase-1, Caspase-1, thioredoxin-interacting protein (TXNIP), pro-IL-1β, pro-IL-18, Bax, Bad, cytochrome C, apoptotic protein activating factor-1 (Apaf-1), cleaved Caspase-9, cleaved Caspase-3 and nuclear p65 protein expressions (< 0.01), and up-regulated Bcl-2, Bcl-xl, pro-Caspase-9, pro-Caspase-3 and cytoplasmic p65 protein expressions (< 0.01).Tormentic acid has a notable protective effect on Hp-injured GES-1 cells, and its mechanism might be closely related to enhancing the function of endogenous antioxidant system, inhibiting the oxidative stress, inflammatory response, and inflammatory activation of TLR4/NF-κB/NLRP3 inflammasome signaling pathway, thereby reducing mitochondrial mediated apoptosis.
tormentic acid; GES-1 cells;; inflammatory response; NLRP3 inflammasome activation; mitochondrial function
R285.5
A
0253 - 2670(2021)16 - 4892 - 12
10.7501/j.issn.0253-2670.2021.16.014
2021-02-18
湖北省生物酵素工程研究技术研究中心项目(JS2018-06);宜昌市科学技术局资助项目(A18-302-a2,A21-2-044);三峡大学硕士学位论文培优基金资助项目(2020SSPY114,2019SSPY159,2018SSPY140,2017YPY086)
贺海波(1972—),男,博士,副教授,从事中药药理学研究。E-mail: hjy219@126.com
张继红(1967—),主任医师,从事消化系统基础与临床研究。E-mail: 13872605766@163.com
[责任编辑 李亚楠]
