圆锥南芥适应高山干旱环境机制
2021-08-24陶发清李唯奇
唐 婷,陶发清,李唯奇
(1. 湖南科技大学 生命科学学院 经济作物遗传改良与综合利用湖南省重点实验室 重金属污染土壤生态修复与安全利用湖南省高校重点实验室, 湘潭 411201; 2. 中国科学院 昆明植物研究所 西南野生生物种质资源库, 昆明 650201)
种子萌发过程非常复杂,不仅受内部生理生化活动调控,还受外界环境因素如水分、温度、氧气和光照等影响[1]。在种子成熟过程中,母体植株营养组织合成大量ABA(Abscisic acid, ABA)运输至种子,对种子后续发育发挥重要的调控作用[2-3]。在拟南芥种子发育后期,合子组织中产生ABA诱导种子休眠[4]。木豆植物的种子遭遇高温胁迫时,通过合成多种HSPs(Heat shock proteins, HSPs)促进种子萌发过程胚轴伸长,增强耐热能力[5]。在烟草中,过表达HSP70能够提高植物对干旱的耐受能力[6]。另外,过表达sHSP17.7的水稻植株能增强对水分胁迫的耐受性[7]。植物在面临不利生长环境条件下,通过启动相关生理生化和分子活动,增强种子抗逆能力或调控种子以休眠的形式度过,这是适应环境的保护性策略。
高山环境综合有多种非生物胁迫,包括温度胁迫、干旱胁迫和土壤贫瘠等[8]。圆锥南芥(Arabispaniculata)生长在高山环境中,是拟南芥(Arabidopsisthaliana)的近缘物种[9]。圆锥南芥通过调整营养生长和繁殖发育循环以适应高山气候条件[10]。前期发现圆锥南芥对短期高温胁迫具有光合修复能力和系统性耐热能力[11-12],还能通过调整细胞膜膜脂分子的含量和组成方式适应长期中高温胁迫[13]。在秋季,圆锥南芥种子开始成熟;当冬季来临,高山土壤上覆盖冰雪,水分非常短缺;到第二年春季,冰雪融化,圆锥南芥种子萌发,逐渐生长成幼苗。根据圆锥南芥的生长周期,缺水环境是否作为其种子休眠的诱导因素,以避免种子萌发后被低温冰雪冻伤,值得探索。
本文用不同浓度(150、300和600 mmol/L)甘露醇模拟高山环境中的干旱胁迫,通过将圆锥南芥与其近缘物种拟南芥进行比较,旨在明确干旱胁迫是否导致圆锥南芥种子休眠;通过检测萌发过程植物内源激素ABA含量和热激蛋白合成量,以挖掘其在干旱胁迫下对种子萌发是否发挥生理功能。
1 材料和方法
1.1 材料和处理
圆锥南芥和拟南芥种子经75%体积分数的乙醇和5%体积分数的NaClO进行表面消毒,种植于含有不同甘露醇浓度MS培养基上,置于光照培养箱中(22 ℃),光照120 μmol/(m2·s),光周期为(12 h/12 h),培养22 d。从第1天开始一直到第22天,每天统计两物种的萌发率,萌发统计以胚轴伸出种皮为标准。
1.2 植物激素ABA含量的检测
利用酶联免疫吸附测定法(ELISA)测定植物组织的内源激素。称取0.5~1.0 g植物材料,加 2 mL样品提取液,在冰浴下研磨成匀浆,转入10 mL 试管,再用2 mL提取液分2次将研钵冲洗干净,冲洗液一并转入试管,摇匀后放置在4 ℃下提取4 h,1 000 r/min 离心15 min,取上清液。沉淀再加入1 mL 提取液,摇匀,置4 ℃下再提取1 h,离心,合并上清液记录最终体积。上清液过C-18 固相萃取柱后转入离心管,用氮气吹干,用样品稀释液定容。在酶标板中加入包被抗原,37 ℃水浴锅中3 h后,室温下洗涤包被液。加入ABA标准品(100 g/mL),待测样品和一抗,37 ℃ 水浴锅中孵育0.5 h,经洗涤后再加二抗,37 ℃ 水浴锅中孵育0.5 h,再次洗涤后,加底物邻苯二胺(OPD)显色,用酶标仪测定490 nm处OD值。
1.3 热激蛋白的检测
将300 mmol/L甘露醇处理前后的种子用液氮研磨成粉,然后添加0.5 mL蛋白提取液,2 μL β-巯基乙醇和2.5 μL PMSF,震荡混匀。4 ℃,7 000 r/min离心10 min,取上清液检测蛋白质浓度。按照相应的比例配好分离胶和浓缩胶,待凝固后,添加蛋白样品,进行电泳和转膜。将已转的PVDF膜用甲醇润洗后,用5% 脱脂牛奶封闭,然后进行一抗(HSP101和HSP70)杂交,再次洗涤后,进行二抗杂交,最后用NBT显色。
1.4 数据分析和处理
用SPSS(19.0)单因素分析(ANOVA),进行多重比较数据是否存在显著性差异(P<0.05),最后用Origin软件作图。
2 结果和分析
2.1 干旱胁迫对圆锥南芥和拟南芥种子萌发率的影响

(a)甘露醇处理后圆锥南芥和拟南芥的种子萌发的表型分析; (b)甘露醇处理后圆锥南芥和拟南芥的种子萌发(三角形为圆锥南芥,圆形为拟南芥)。图1 甘露醇对圆锥南芥和拟南芥种子萌发的影响分析Figure 1 Effects of mannitol on seed germination rates of A. paniculata and A. thaliana
在培养基中添加不同浓度的甘露醇模拟干旱胁迫,比较圆锥南芥与拟南芥的种子萌发率(图1)。在正常培养基上,拟南芥从第1天开始萌发,萌发率为11.6%;圆锥南芥从第3天开始萌发,萌发率为57.8%,而此时拟南芥萌发率达97.3%。在含150 mmol/L甘露醇的培养基上,拟南芥萌发趋势稍慢于正常生长条件,第5天萌发率达到95.2%;圆锥南芥在第5天才出现萌发,萌发率为43.2%,第10天逐渐上升至79.7%,后续萌发率保持不变。随着甘露醇浓度升高至300 mmol/L,拟南芥萌发率在第8天仍能达到94.5%;圆锥南芥的种子在第22天才出现13.9%的萌发率。当甘露醇浓度升高到600 mmol/L,拟南芥在第8天开始萌发,萌发率为23.0%,在第22天,达到36.2%;圆锥南芥种子整个培养周期都没有萌发。然而,将受甘露醇处理的圆锥南芥种子转移到正常培养基上,又能正常萌发了。综上表明干旱胁迫会推迟植物的萌发时间,而圆锥南芥种子萌发对干旱胁迫更加敏感,出现种子暂时休眠的现象。
2.2 干旱胁迫对圆锥南芥和拟南芥种子中ABA含量的影响
为了从生理水平上探索影响干旱胁迫下圆锥南芥种子出现休眠的原因,利用ELISA检测了两物种干种子,在正常培养基上即将萌发的种子和在300 mmol/L甘露醇处理下种子内源激素ABA含量(图2)。在已成熟的干种子中,拟南芥ABA含量为1.1 ng/g,圆锥南芥ABA含量达到9.2 ng/g,显著高于拟南芥,说明圆锥南芥干种子受ABA调控而具有休眠性状;拟南芥干种子内源ABA含量比较低,不具有休眠性状。在正常培养基上已吸胀即将萌发的种子,两物种ABA的含量都比干种子显著降低,拟南芥ABA含量下降更显著,也与拟南芥种子萌发更快的特点相吻合。受甘露醇的影响,两物种的ABA含量都比其正常萌发时更高,圆锥南芥的ABA含量又回升到干种子的水平,这可能与二者种子萌发都有所延迟相关。
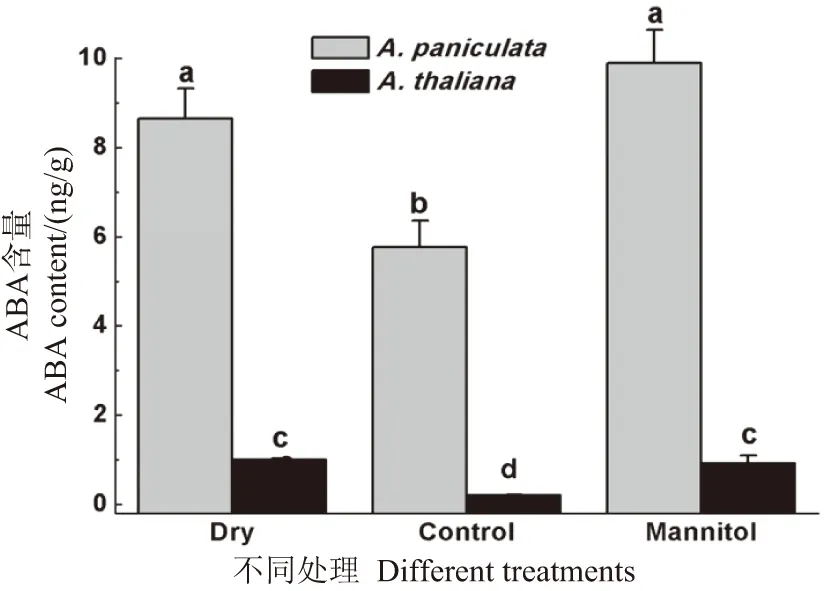
不同字母表示具有显著性差异(P<0.05)。图2 圆锥南芥和拟南芥种子ABA含量测定Figure 2 The ABA contents in A. paniculata and A. thaliana
2.3 干旱胁迫对圆锥南芥和拟南芥种子中HSPs蛋白表达的影响
为了进一步从蛋白质水平上探索影响干旱胁迫诱导圆锥南芥种子出现暂时休眠的原因,利用Western Blot检测两物种干种子,在正常培养基上将萌发的种子和在300 mmol/L甘露醇处理下种子的HSP101和HSP70蛋白表达含量。在正常培养基中,圆锥南芥和拟南芥的HSP101蛋白表达量都比较低,其中拟南芥的含量略高。在甘露醇处理下,拟南芥的HSP101表达量显著升高,圆锥南芥的HSP101表达量较对照变化不大,其表达量远远低于拟南芥。另外,在正常条件下,两物种的HSP70含量都非常低,几乎检测不到。然而,受甘露醇诱导,拟南芥HSP70表达量急剧增加,圆锥南芥HSP70表达量仍保持很低的水平。结果说明:干旱胁迫诱导拟南芥HSP101和 HSP70蛋白合成,以参与和维持种子萌发过程,圆锥南芥由于其HSP101和 HSP70不受干旱胁迫诱导,因此可能不参与萌发,导致出现短暂性种子休眠。
3 讨论与结论
高山环境是一个综合有干旱、高温和低温等各种气候胁迫的天然实验室。高山植物最本质的特点是:种子不会在当前季节(冬季前)萌发,只有在冬季缺水环境下经历了足够长时间的休眠期,在雪融化后,萌发才迅速开始,随后的萌发活动具有明显的时间延续性[14]。另外,据文献报道[15],加利福尼亚州每年生杂草在春季提前完善根系发育和缩小植株形态,通过以夏季休眠的形式度过炎热缺水的环境,最终保持其存活率。圆锥南芥生长在高山环境中,经过长期进化,各个发育阶段已适应高山环境的各种特殊气候条件。圆锥南芥在干旱环境下保持种子休眠的状态(图1),这可能是其自身对冬季寒冷气候的一种保护策略,也是对高山极端环境的适应策略。
在干旱胁迫下,ABA通过控制叶片中气孔关闭减少水分丧失,启动植物中一系列响应ABA相关基因表达的信号途径,提高植物的抗旱能力[16]。ABA含量已成为衡量植物对干旱耐受能力高低的一种重要指标。在种子吸胀过程中,ABA从头合成代谢受抑制,且分解代谢激活,其含量降低启动萌发过程[17]。然而,在种子成熟过程中,ABA合成代谢增强,其含量升高启动休眠。因此,ABA含量对调控种子萌发和休眠的动态平衡发挥重要的作用。在成熟的种子中,圆锥南芥的ABA含量显著高于拟南芥(图2),从另外一个角度说明其种子处于休眠状态。在正常萌发过程中,圆锥南芥ABA含量明显下降,说明其分解代谢加强,和其他植物一样,圆锥南芥种子的休眠状态已转变成萌发状态。通过甘露醇处理,圆锥南芥种子的ABA含量又回升到干种子的水平,说明其种子再次处于休眠状态。综合以上可以得知,圆锥南芥在干旱环境下,启动种子ABA含量的合成代谢,使ABA含量升高,这是圆锥南芥种子适应高山冬季气候的保护性策略。
热激蛋白在大多数植物应对高温胁迫和干旱胁迫过程中发挥保护性作用[18]。据报道印度芥末HSP101 受热胁迫诱导表达量增加数倍[19],小分子HSP17.4的转录水平受到干旱胁迫诱导而升高[20]。异源超表达紫花苜蓿MsHSP70的拟南芥转基因植株对干旱胁迫具有更强的耐受性[21]。广寄生[Taxillusichinensis(DC.) Danser]HSP可能参与种子对干旱胁迫的初期响应[22]。研究发现匍匐翦股颖(Agrostisstolonifera)小分子HSP17.4在种子萌发过程中具有调控ABA相关信号途径功能[23]。本研究发现圆锥南芥种子HSP101和HSP70不受干旱胁迫而诱导表达,推测可能其种子内部ABA含量已经储备较高,其合成代谢已非常活跃,不需要耗费大量物质和能量合成HSP101和HSP70以激活ABA合成代谢通路。拟南芥HSP101和HSP70在干旱条件下,表达量明显增强(图3),推测其可能依靠HSP诱导ABA的生物合成来应对干旱胁迫。

图3 甘露醇处理圆锥南芥和拟南芥种子萌发过程HSP101和HSP70蛋白表达分析Figure 3 Protein expression analysis of HSP101 and HSP70 in germinated seeds of A. paniculata and A. thaliana on the normal growth medium and growth medium supplied with mannitol
