一株氢氧化细菌的生长条件及其对不同氮源利用的研究
2021-08-24陶虎春谢勇张丽娟丁凌云陈艺贞
陶虎春 谢勇 张丽娟 丁凌云 陈艺贞
深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055;† E-mail: taohc@pkusz.edu.cn
据统计, 2050 年世界人口将达到 80~100 亿[1],人类对食物蛋白的需求比 2006 年高 70%[2]。目前,农业生产中主要依靠哈伯-博施技术提供氮肥[3]。但是, 在传统施用化肥过程中, 有近 50%的活性氮被浪费, 进入自然水体; 另一部分氮被纳入城市污水处理厂进行处理[4-5]。哈伯-博施法固氮每年消耗全球 1%~2%的能源[6], 污水处理厂运行又消耗全球3%的能源[6]。因此, 需要探寻新的技术途径, 在满足农业氮肥供应的同时, 减少环境影响和能源消耗。
城市污水处理系统中蕴含水、氮磷营养元素和能量等资源[7-8]。2018 年中国累计处理污水 519×108m3, NH4+-N 削减量为 1.19×106t[9]。目前, 对含 NH4+-N 污水的处理方法主要分为两大类: 低浓度时, 以硝化-反硝化生物化学处理法为主, NH4+-N 最终转化为气态氮形式; 高浓度时, 以吹脱、气提、鸟粪石吸附和电化学等物理化学方法为主[10-12]。传统的 NH4+-N 处理方法无法实现氮资源的回收利用。
近年来, 有学者利用氢氧化型细菌(Hydrogenoxidizing bacteria, HOB), 分别以 H2和 O2作为电子供体和受体, 通过卡尔文、逆三羧酸循环固定 CO2,进行细胞合成[13]。HOB 可以消耗污水中的 CO2、氮[14]和磷等低价值无机物, 生产生物塑料、动物饲料添加剂和液体燃料等[15]高附加值产品。理论上,HOB (如Cupriavidus necator)对氮元素的利用反应式[16-17]为

目前, 国内外针对 HOB 的研究多集中于植物根际促生机制[18-19]和单细胞蛋白营养价值[20]领域,在环境保护和资源回收领域的研究较少。
本研究从污水处理厂的活性污泥中筛选分离出一株 HOB, 针对该菌株高效利用 NH4+-N 的特性开展研究, 为含 NH4+-N 废水的氮素资源化利用研究奠定基础。
1 材料与方法
1.1 菌株培养与筛选
1.1.1HOB培养基制备
矿物质培养基溶液(1.0 L)包含0.47 g (NH4)2SO4、0.5 g KH2PO4、0.2 g MgSO4·7H2O、0.003 g CaCl2、0.02 g 硫酸亚铁铵和 0.5 mL 微量元素溶液。其中, 微量元素溶液(1 L)为 0.119 g CoCl2·6H2O、0.118 g NiCl2·6H2O、0.153 g CrCl3·6H2O、0.156 g CuSO4·5H2O, 调节 pH 至 7.0。培养基在 121℃灭菌 20 分钟,冷却至室温。其中, 硫酸亚铁铵[21]单独灭菌(0.22 μm 膜滤), 室温加入培养基[22]。分离筛选阶段, 在上述液体培养基中添加 1.5%琼脂, 形成选择性固体培养基, 其他成分保持不变。所有选择性培养基均在高温灭菌(121℃, 20 分钟)后使用。
1.1.2HOB培养气体供应
在不同的培养阶段, 菌株培养采用的混合气体不同。菌株筛选分离时, 采用 H2:O2:CO2=85:5:10(体积比)。后续的液体培养菌株过程中, O2消耗量与微生物生物量增长正相关, 故将混合气体比例进行调整为 H2:O2:CO2=70:20:10 (体积比)。
1.1.3 菌株分离与鉴定
活性污泥取自深圳市某污水处理厂曝气池。首先, 将采集的活性污泥放置在 0.9% NaCl 溶液中振荡 1 小时(暗室, 30℃和 200 rpm)混匀, 得到充分活化的细菌接种液。然后, 在选择性固体培养基上进行涂布平板接种, 接种液采用 10-2, 10-3和 10-4共 3种浓度。接种后, 将固体培养基全部转移至密闭的特氟龙气袋中, 抽真空后通入混合气体(H2:O2:CO2=85:5:10, 体积比), 每隔 24 小时更换一次气体; 培养基连同气袋一起放置在 30℃恒温培养箱中, 密闭培养。72 小时后, 培养基上出现菌落。平板划线法分离纯化, 直到得到菌落生长大小和颜色均一致的目标菌落。整个过程无菌操作, 每次操作过程中均设置 3 个平行样, 一个空白样。
将固体培养基中的目标菌落接种在装有 10 mL液体培养基的 250 mL 血清瓶中, 通入混合气体(H2:O2:CO2=70:20:10, 体积比), 气体流量为 130 mL/min,通气时间为 5 分钟。血清瓶放置在摇床中密闭培养(30℃, 160 rpm), 分别在 24 小时和 48 小时取样测量细胞浓度(OD600)和 NH4+-N 含量。在筛选出的菌落中选取 NH4+-N 去除效果最佳、生长最好的菌株。均采用 3 个平行样进行实验。
1.2 气体消耗与生成
H2消耗量可以用来验证和比较菌株的氢利用能力, 进而筛选出耗氢能力强的目标菌株。血清瓶中的气体成分使用气相色谱仪(Agilent 7890B, 美国)分析, 得到目标菌株生长所需的各种气体消耗量以及产生量。测量参数[23-24]如下: 1) CO2, O2和N2检测采用 TCD 检测器, H2作为载气, 柱箱温度为100 ℃, 进样口温度为 120 ℃, 前检测器温度为250℃, 后检测器温度为 250℃, 进样速率为 45 mL/min, 总用时 8.5 分钟, CO2, O2和 N2的保留时间分别为 3.2, 4.0 和 4.8 分钟; 2)H2检测使用 FID 检测器,He 作为载气, 保留时间为 1.0 分钟, 气体体积的检测限为 5 mL。此外, 对血清瓶中含氮气体(N2O 和N2)的含量进行检测。
1.3 最适菌株培养条件
在 250 mL 血清瓶中放置 70 mL 的液体培养基,密闭条件下研究影响菌株生长的最适条件。考察温度(20, 25, 30, 35 和 40℃)、转速(120, 160 和 200 rpm)、pH 值(5.0, 6.0, 7.0, 8.0 和 9.0)以及初始NH4+-N 浓度(50, 100, 200 和 600 mg/L) 4 种因素对菌株生长和脱氮的影响, 探究最适宜的培养条件。
1.4 对不同氮源的利用
在 250 mL 的血清瓶中加入 70 mL 工作液体, 密闭条件下观察氮的迁移转化。该序批实验中除更换氮源外, 其余条件不变。当唯一氮源分别为NH4+-N (硫酸铵)、NO3--N (硝酸钾)和 NO2--N (亚硝酸钠)时, 氮含量均控制在 100 mg/L。分别在 0, 6, 12, 24,36, 48 和 72 小时 各取样 3.5 mL, 用于检测细胞浓度(OD600)、总氮(TN)、溶解态总氮(DTN)、氨氮(NH4+-N)、硝氮(NO3--N)和亚硝氮(NO2--N)。除用于TN 分析外, 其余样品均需经过 0.22 μm 膜滤后分析, 每个实验组有 3 个平行样品。
1.5 分析与计算方法
采用紫外分光光度计(DR6000, 哈希公司)测量OD600。使用紫外分光光度法测量 NO3--N 和 NO2--N, 使用纳氏试剂分光光度法(HJ535-2009)测量NH4+-N。使用碱性过硫酸钾消解紫外分光光度法(HJ636―2012)测量 DTN 和 TN。细胞内有机氮[25]由 TN-DTN 得出。
2 结果与讨论
2.1 Rhodoblastus sp. TH20 的分离与鉴定
如图 1 所示, 分离菌株为环杆菌, 长度为 0.79~1.13 μm, 宽度为 0.41~0.49 μm, 革兰氏染色为阴性菌(G-)。16S rRNA 基因鉴定结果(图 2)表明, 该菌株与Rhodoblastus acidophilus相似度高达 97%以上,两者亲缘关系较近, 故命名为Rhodoblastussp.TH20菌株(简称 TH20), NCBI 登录号为 MK968713。在气体消耗实验中,Rhodoblastussp.TH20 菌株消耗 H2,CO2和 O2, 并伴随有少量氮气产生, 属于氢自养型好养细菌。
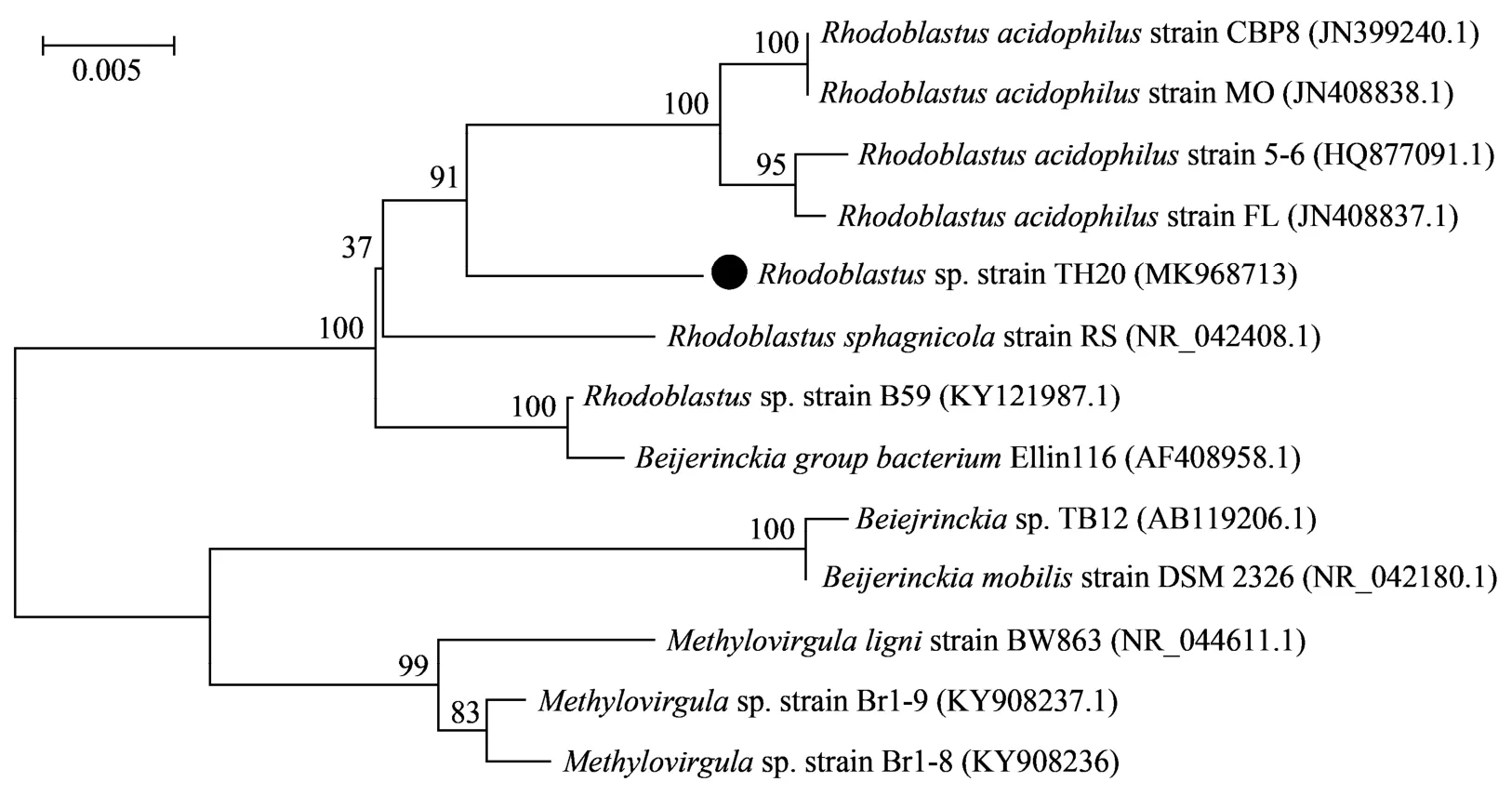
图2 Rhodoblastus sp. TH20 菌株系统进化树Fig. 2 Phylogenetic trees based on 16S rRNA gene sequence of Rhodoblastus sp. TH20
2.2 HOB 最适生长条件
2.2.1 生长温度
TH20 菌株的实验初始条件为接种比 5% (体积比)、转速 160 rpm, pH=7.0, NH4+-N 含量 100 mg/L。保持初始条件不变, 在 5 种不同温度(20, 25, 30,35 和 40℃)下, 连续 72 小时观察菌株生长情况(OD600)和NH4+-N 去除率。
温度变化通过影响微生物新陈代谢中酶的活性, 进而影响细菌的生长和 NH4+-N 的去除效率(图3)。20℃时, 菌株生长正常。随着温度升高酶的活性会增加[26]。25℃时, 菌株生长最旺盛, 酶的活性最好, OD600为 1.36±0.03。48 小时后菌株生长进入稳定期。温度继续升高, 生物量比 25℃时有所下降, 超过酶的最适温度。随着生长环境温度升高,超过酶促反应的最适温度, 细胞内酶活性下降, 直观表现为 OD600下降。30℃时, 菌株的生物量下降不很明显, OD600为 1.08±0.01。温度上升到 35℃以上(如 40℃)时, 与接种时 OD600数值相比基本上没有变化, 菌株的生长受到抑制。可见, TH20 是一株嗜温性菌株, 最适温度范围为 20~35℃。
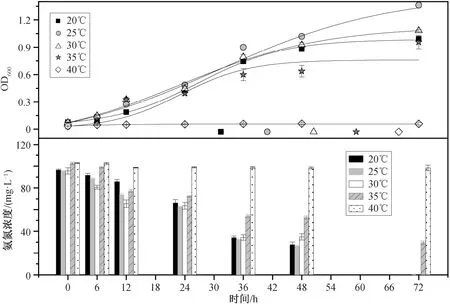
图3 温度对Rhodoblastus sp. TH20 菌株生长和NH4+-N 去除的影响Fig. 3 Effects of temperature on cell growth and ammonium removal by Rhodoblastus sp. TH20
TH20 的 NH4+-N 去除能力与其细胞生长状况密切相关。20~30℃时, 菌株可以在 72 小时内将NH4+-N 完全转化利用, 培养体系中不含 NH4+-N。在 35℃以上的时, 菌株生长受到抑制, 不能利用NH4+-N。究其原因, 嗜温型细菌氮的去除效果受温度影响[27]。综合菌株的生长情况和 NH4+-N 的去除效率, 该菌株最适宜的温度为25℃。
2.2.2 初始pH值
在接种比 5% (体积比)、转速 160 rpm、25℃和NH4+-N 浓度 100 mg/L 条件下, 改变初始 pH 值(5.0,6.0, 7.0, 8.0 和 9.0), 连续 72 小时观察菌株生长情况和NH4+-N 去除能力。
在 pH 为 5.0~9.0 的范围内, 菌株均可以生长,且在碱性条件下生长情况更优(图 4)。在前 12 小时,菌株的适应期是一致的。在对数生长阶段, pH=5.0实验组生物量明显低于其他实验组。36 小时后, 所有实验组都进入稳定期。当 pH 为 6.0 时, OD600为0.68±0.09, NH4+-N 的去除速率只有 0.46 mg/(L·h)。当 pH 为 7.0 时, OD600达到 1.16±0.09, NH4+-N 去除效率达到 99%以上, 去除速率为 1.36 mg/(L·h), 明显高于 pH 为 6.0 时的 NH4+-N 去除能力。在 pH 为8.0 和 9.0 的实验组中, 菌株的生长量与 pH 为 7.0 时相差不大, 并且 NH4+-N 的去除速率均在 1.34 mg/(L·h)以上。综合考虑 OD600和 NH4+-N 的去除效率两个因素, 该菌株的最适初始 pH 为 7.0。
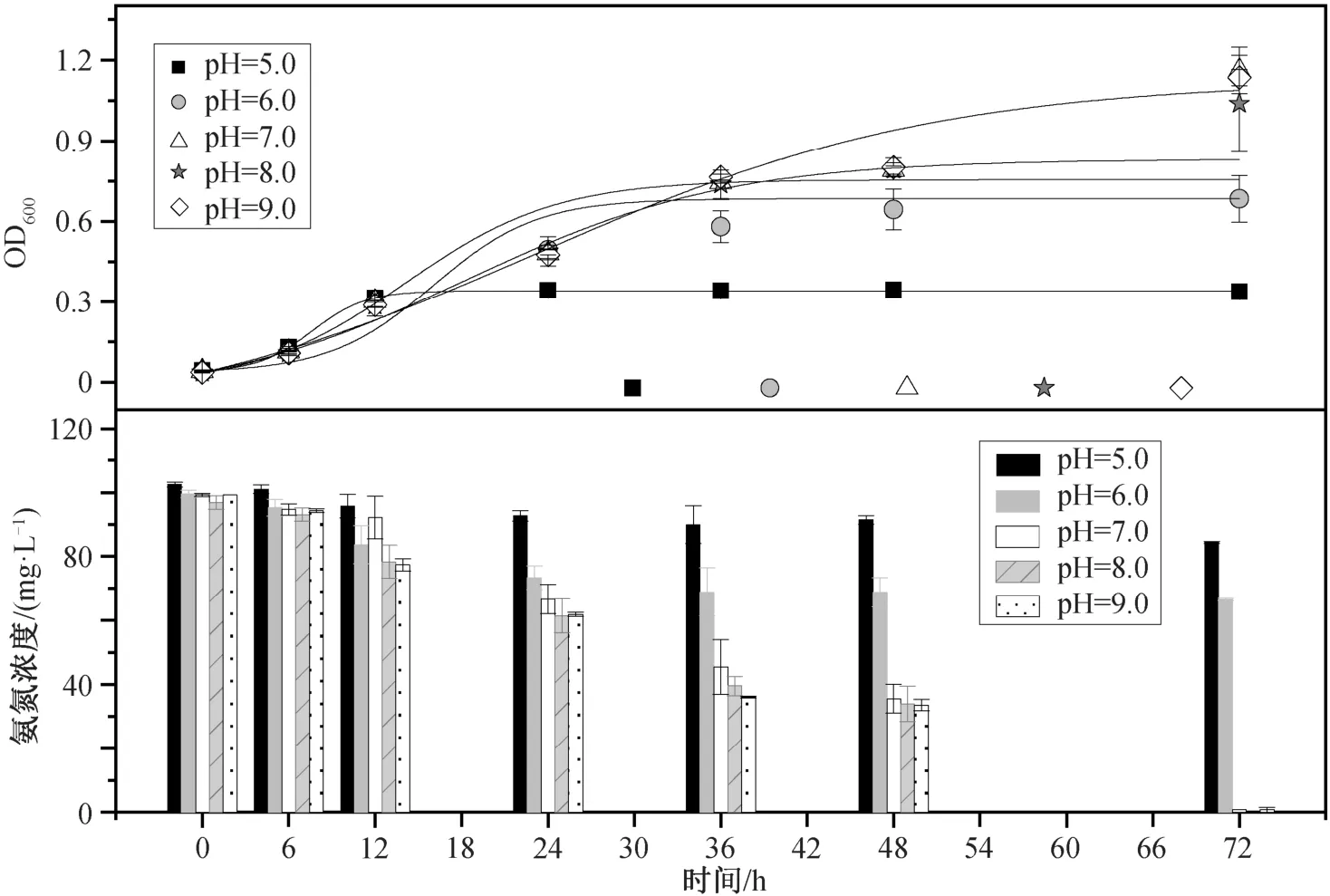
图4 初始 pH 值对 Rhodoblastus sp. TH20 菌株生长和NH4+-N 去除的影响Fig. 4 Effects of initial pH on cell growth and ammonium removal by Rhodoblastus sp. TH20
2.2.3 转速
在接种比 5% (体积比)、pH=7.0、25℃和 NH4+-N 浓度为 100 mg/L 的条件下, 改变转速(120, 160 和200 rpm), 连续 72 小时观察菌株生长情况和 NH4+-N 去除能力。
血清瓶中的气体与培养液不停地交换, 在不同的转速条件下, 菌株的生长与 NH4+-N 去除量也相应地变化(图 5)。TH20 属于化能无机自养型微生物,需要利用培养基中的 H2, O2和 CO2气体。转速的高低会直接影响气体在气液两种介质界面的交换, 转速越高, 气体交换量越大。考虑到经济成本, 需要选取去除效果好且转速较低的条件。在 120 rpm 时,菌株的生长 OD600为 1.05±0.03, NH4+-N 的去除效率只有 84.2%。转速为 160 rpm 时, 菌株的生物量大幅度增加, OD600为 1.25±0.02, 并且 NH4+-N 的去除率可以达到接近 99%, 去除速率为 1.32 mg/L/h。转速为 200 rpm 时, NH4+-N 去除率可以达到 99%以上,生物量的增长不明显, OD600为 1.32±0.10, NH4+-N去除速率为 1.38 mg/(L·h)(略高于 1.32)。这一结果与 Liu 等[28]转速超过一定数值(如 200 rpm)时, NH4+-N 去除菌株生长速度没有明显增加的结论一致。综合生物量和 NH4+-N 去除速率, 选择 160 rpm 为最适转速。
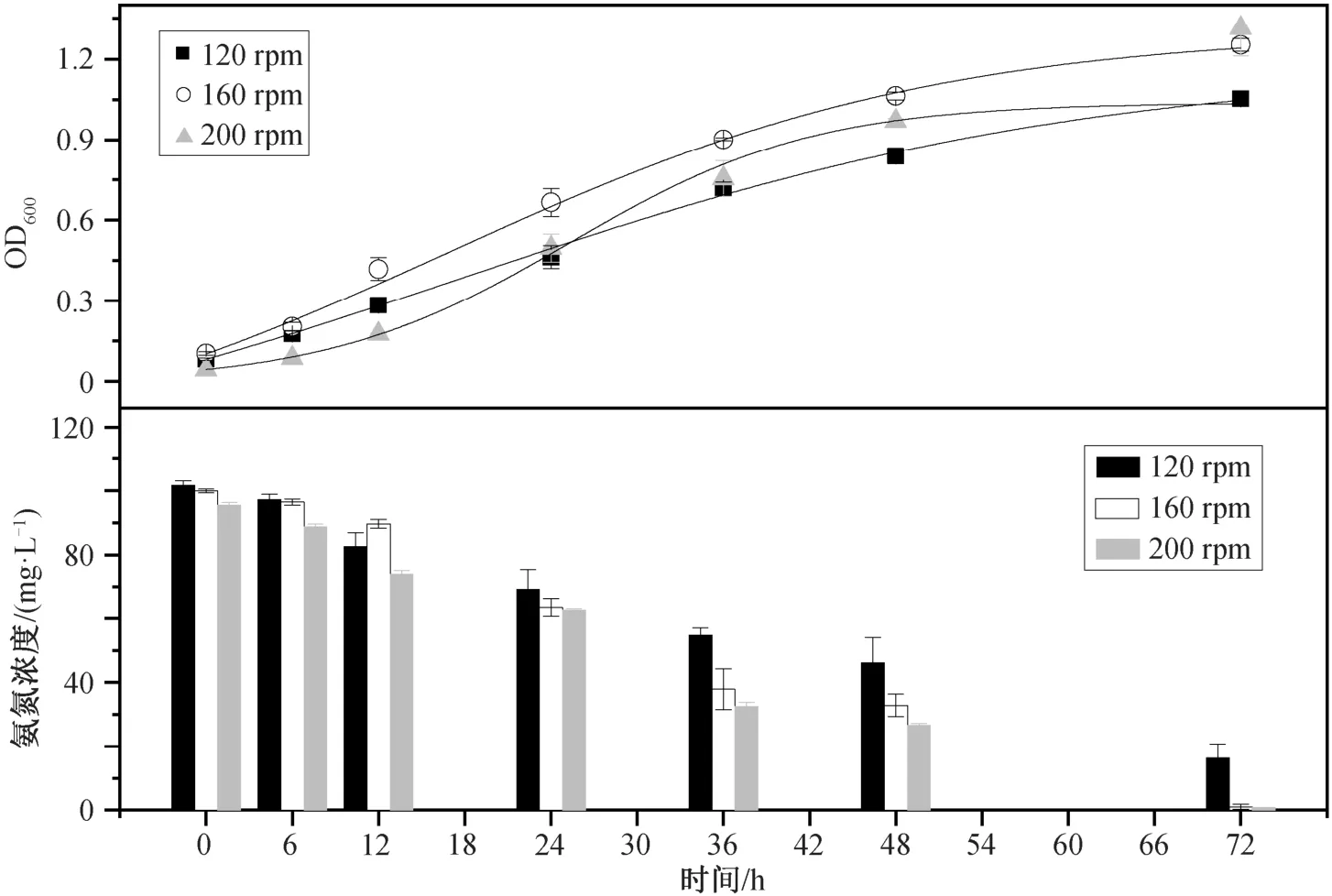
图5 转速对 Rhodoblastus sp. TH20 菌株生长和 NH4+-N 去除的影响Fig. 5 Effects of shaking speed on cell growth and ammonium removal by Rhodoblastus sp. TH20
2.2.4 初始NH4+-N浓度
在接种比 5% (体积比)、转速 160 rpm、pH=7.0 和 25℃条件下, 改变初始 NH4+-N 浓度(50, 100,200 和600 mg/L), 连续 72 小时观察菌株生长情况和 NH4+-N 去除能力, 如图 6 所示。
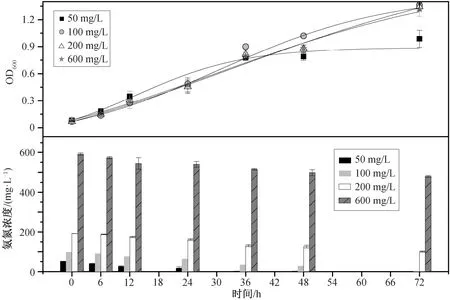
图6 初始NH4+-N 浓度对Rhodoblastus sp. TH20 菌株生长和NH4+-N 去除的影响Fig. 6 Effects of initial NH4+-N concentration on cell growth and ammonium removal by Rhodoblastus sp. TH20
TH20 菌株在以 NH4+-N 为唯一氮源条件下, 利用 NH4+-N 合成细胞物质。在 50 mg/L NH4+-N 浓度条件下, TH20 菌株生长最先到达稳定期, 在 36 小时内 NH4+-N 被利用完, 生长进入稳定期, OD600为0.99±0.09, NH4+-N 的去除速率为 1.34 mg/(L·h)。在100 mg/L NH4+-N 浓度条件下, 菌株生长 48 小时才进入稳定期, OD600达到 1.36±0.03, 去除效率为99.2%。随着 NH4+-N 浓度的提升, 在 200 mg/L 实验组中, 菌株生长与 100 mg/L 实验组基本上一致(OD600为 1.34±0.04), 600 mg/L 时 OD600为 1.32±0.08, 略小于 100 mg/L 时的数值, NH4+-N 的去除率分别为 47.9%和 18.95%。总体上, 恒定体积(70 mL)中菌株的 OD600稳定在 1.30 左右, NH4+-N 消耗量基本上都维持在 100 mg/L 左右。该现象间接地说明,菌株主要通过同化的方式利用氨氮, 即菌株生长量一定时, 单个菌株的氨氮同化能力也是不变的, 即消耗的表观氨氮含量稳定在一个数值。
2.3 对不同氮源的利用
2.3.1单一氮源
为了研究氮的去除特性, 在好氧条件下, TH20分别将 NH4+-N, NO3--N 和 NO2--N 作为唯一氮源进行培养。在接种比 5% (体积比)、转速 160 rpm、pH=7.0、25℃和氮浓度为 100 mg/L 条件下改变氮源,连续 72 小时观察菌株生长情况和 NH4+-N 去除能力,结果如图 7 所示。
图 7(a)中, TH20 菌株的生长稳定后, NH4+-N 为氮源的实验组的 OD600从 0.07±0.0 增加到 1.36±0.03。在菌株生长过程中, 伴随着无机氮的去除,氮的浓度在接种后 72 小时发生明显的变化。在前 6小时, 菌株处在适应期, 对外界的营养物质利用较少, NH4+-N 变化量仅为 6.8 mg/L; 在 6~48 小时期间,菌株进入对生长数期, 开始大量繁殖, NH4+-N 急剧减少, 去除率达到 99.3%, 去除速率为 1.32 mg/(L·h), 同时有机氮含量逐渐增加, 直到无机氮消耗殆尽。在菌株整个生长阶段, 未检测到任何硝化与反硝化的中间态物质(如无机态的 NO3--N 和 NO2--N)。除小部分的氮转化为气态氮逸出外, 70%以上的 NH4+-N 转移至细胞体内, 以有机氮的形式储存起来[29]。
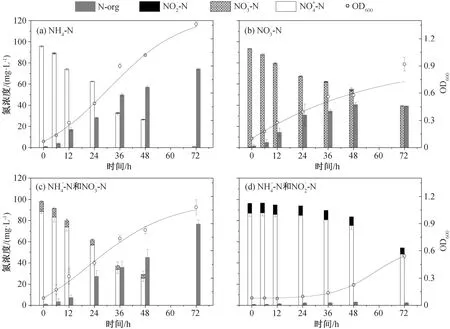
图7 Rhodoblastus sp. TH20 菌株生长和相应的氮分布Fig. 7 Cell growth of Rhodoblastus sp. TH20 and species distribution of nitrogen accordingly
图 7(b)中, TH20 细菌以 NO3--N 为唯一的氮源,在适应期(0~6 小时)内, NO3--N 的含量基本上没有变化。进入对数生长期(6~48 小时)后, 菌株开始生长, OD600从 0.10±0.0 增加到 0.92±0.08, NO3--N 明显下降。72 小时 内 NO3--N 的去除率为 58%, 去除速率为 0.75 mg/(L·h)。在消耗的 NO3--N 中, 40%以有机氮的形式储存在细胞体内, 其余以气态氮的形式脱除, 完成氮的循环。氮的消耗均在对数生长期,与NH4+-N 的消耗情形一致。此外, 当以 NO2--N 为菌株的唯一氮源时, 菌株并不生长。
2.3.2 混合氮源
如图 7(c)所示, 在 90 mg/L NH4+-N 的培养基体系中添加 10 mg/L NO3--N, 菌株的生长与以NH4+-N为唯一氮源的趋势一致。在适应期(0~6 小时),OD600和氮浓度基本保持不变。进入对数生长期,OD600从 0.17±0.06 增至 1.08±0.08, NH4+-N 的含量急剧减少, 有机氮含量大幅增加。添加的 10 mg/L NO3--N, 在适应期没有明显的变化, 在对数生长期全部的 NO3--N 被消耗。TH20 对 NH4+-N 的去除率近 100%, NO3--N 的去除率近 100%, 氮的去除速率为 1.37 mg/(L·h), 在生长过程中未检测到 NO2--N,78.4%的无机氮转化为有机氮。
在图 7(d)中, 向 NH4+-N 培养基体系中添加 10 mg/L NO2--N, 菌株的生长及氮的分布发生明显变化。TH20 的适应期从正常的 6 小时增至 36 小时,OD600从 0.08±0.0 增至 0.54±0.03(仅为 NH4+-N 体系中的 40%), 在生长过程中只有不到 45%的 NH4+-N 被利用。在适应期, NO2--N 含量保持不变, 进入对数生长期后, 仅有约 3.6 mg/L 的 NO2--N 被利用,整个生长阶段没有检测到 NO3--N 的生成, NO2--N 积累抑制 TH20 的生长。
2.4 微生物蛋白的特性
HOB 细菌蛋白的含量基本上在 70%以上[17,30-31](以干细胞净重计算), 明显高于鱼蛋白的 66%[31],大豆蛋白的 45%[31], 酵母的 50%[17]以及谷物的15%[17]。与传统的硝化与反硝化菌株相比, HOB 具有在自养条件下利用无机气体产生菌体蛋白进行回收再利用的优势。在最优的生长条件下, 菌株在100 mg/L 的 NH4+-N 培养体系中可以稳定地获得单一的菌体蛋白。
如图 8 所示, 本研究对 H20 菌体蛋白中的氨基酸(包括精氨酸和组氨酸这两种半必需氨基酸)成分与细菌[32]、鱼蛋白和大豆蛋白进行比较。TH20 菌体中各种氨基酸(除苯丙氨酸和酪氨酸外)含量均超过大豆蛋白中的含量; 苏氨酸、缬氨酸、亮氨酸和组氨酸的含量, TH20 与鱼蛋白含量相当; 精氨酸的含量, TH20 与鱼蛋白基本上一致, 略低于细菌含量,高于大豆的含量。此外, TH20 菌体中还检测出 4 种大豆蛋白中未含有的氨基酸, 分别为天冬氨酸、丝氨酸、谷氨酸和脯氨酸[20]。整体而言, TH20 包含的必需氨基酸含量明显高于植物蛋白, 接近动物蛋白, 与 Volova 等[30]的研究结果一致。
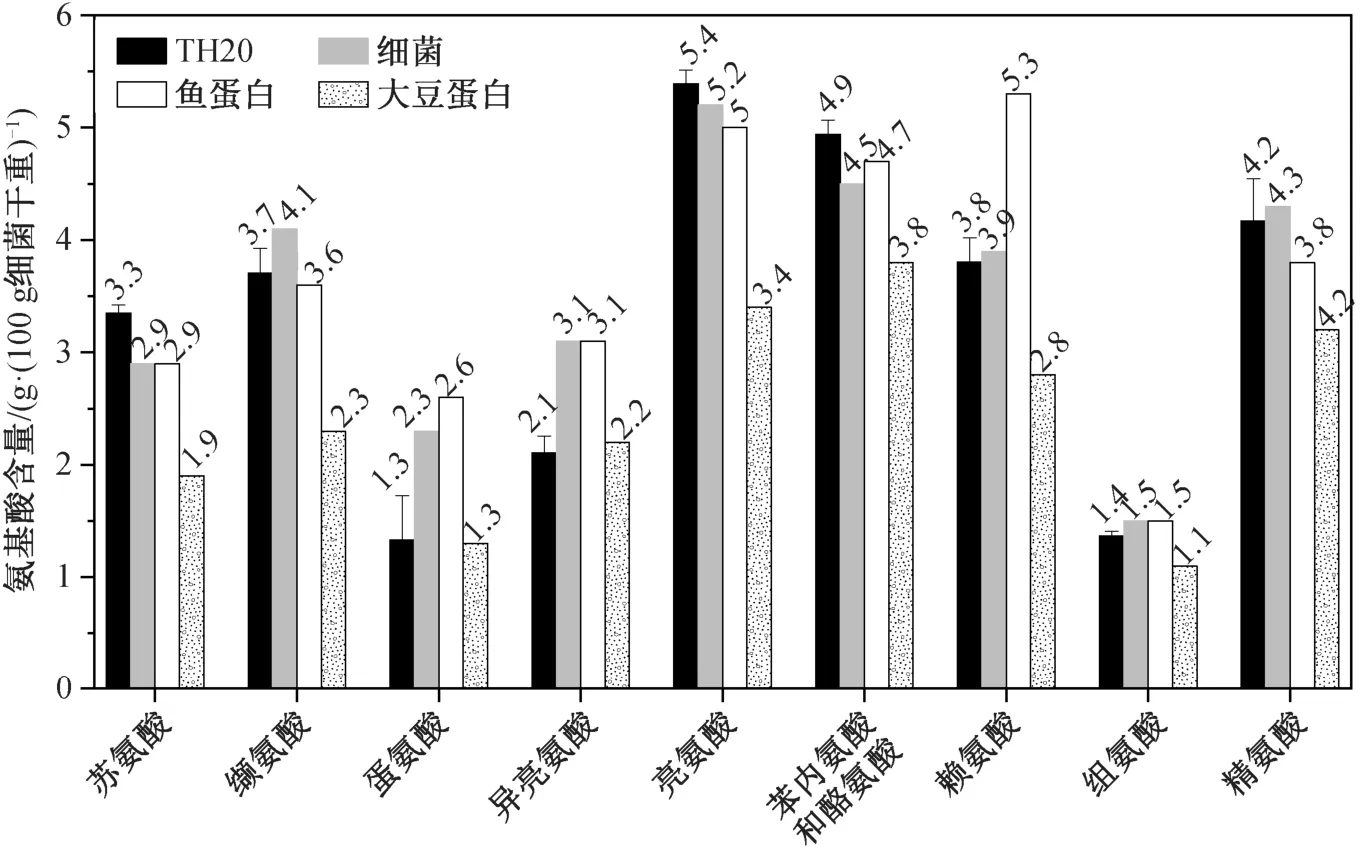
图8 Rhodoblastus sp. TH20 与细菌、鱼蛋白和大豆主要氨基酸的对比[31]Fig. 8 Essential amino acids profile of the microbial biomass produced under ammonium by Rhodoblastus sp. TH20 compared with bacterial meal, fishmeal and soybean meal[31]
3 结论
本文从污水处理厂活性污泥中筛选出一株自养型氢氧化细菌 HOB, 研究其优化生长条件以及对不同氮源的利用情况, 得到如下主要结论。
1) TH20 的最适生长条件为 25℃, 160 rpm 和 pH=7.0。
2) 当初始 NH4+-N 浓度为 100 mg/L 时, 72 小时内TH20 的 NH4+-N 去除率可达到 99%。
3) TH20 能够将 77.8%以上的 NH4+-N 转化为微生物蛋白储存在菌体内。
