COPB2表达对胃癌细胞增殖、迁移和侵袭的影响
2021-08-22卢军董麒锋沈壮虹
卢军,董麒锋,沈壮虹
卢军,浙江中医药大学附属江南医院杭州市萧山区中医院药剂科 浙江省杭州市 311200
董麒锋,浙江中医药大学附属江南医院杭州市萧山区中医院普外科 浙江省杭州市 311200
沈壮虹,浙江中医药大学附属江南医院杭州市萧山区中医院肿瘤内科浙江省杭州市 311200
0 引言
在我国,由于胃癌的临床前筛查率低,使其已成为导致癌症死亡的主要原因[1].目前,随着治疗技术和方法的改进,GC患者的长期生存率尽管有所提高,但中晚期患者的复发率和死亡率仍然居高不下[2].而,深入探索影响胃癌进展的分子靶点有可能为开发新的胃癌疗法和提高患者生存率提供新的策略.
外被体蛋白复合物β2亚基(coatomer protein complex subunit beta 2,COPB2)是构成高尔基体的外被体包被蛋白复合体I,主要负责细胞内高尔基体和内质网间的囊泡转运[3,4].而,内质网和高尔基体的完整性对维持细胞稳态具有重要意义.近来研究发现,COPB2除参与囊泡运输外,还参与细胞周期调控[5]和细胞凋亡[6,7].特别是最近的研究显示,COPB2可参与调节肺癌、结肠癌和前列腺癌等多种肿瘤的发生和进展[5,8,9].然而,COPB2在胃癌中表达和临床意义仍不完全明确.因此,本实验探索COPB2在胃癌组织和胃癌细胞系中的表达情况,随后探讨COPB2对胃癌细胞增殖、迁移和侵袭的影响及其初步机制.
1 材料和方法
1.1 材料
1.1.1 胃癌组织与癌旁组织样本的收集:本研究经过伦理委员会批准,所有患者均提供书面同意.收集10例接受胃癌切除术的患者的胃癌组织和配对的癌旁组织.
1.2 方法
1.2.1 细胞系、裸鼠和实验试剂:人正常胃上皮细胞(GES-1)和胃癌细胞(SGC-7901、MKN45、AGS)购自中国科学院上海细胞生物学研究所.10只6-7周龄SPF级雄性BALB/c裸鼠购于浙江维通利华实验动物技术有限公司.胎牛血清(FBS)、Dulbecco改良版Eagle培养基(DMEM)购于美国Life Technologies公司;LipofectamineTM2000和Trizol试剂购于美国Invitrogen公司;RIPA、CCK-8细胞计数试剂盒、BCA试剂盒和GAPDH抗体购于上海碧云天生物科技有限公司;COPB2和Ki67抗体购自英国Abcam公司;p-Akt和Akt抗体购自美国CST公司;COPB2-shRNA的慢病毒载体和对照shRNA慢病毒载体(ConshRNA)购自上海吉玛基因公司;pcDNA-COPB2和对照pcDNA载体(pcDNA-Con)购自上海吉凯基因公司.
1.2.2 细胞培养与转染:将GES-1、SGC-7901、MKN45和AGS细胞接种在含10%FBS的DMEM培养基中,置于细胞孵箱中培养.
将SGC-7901细胞按2×105个/孔接种至24孔板中,次日,将培养基更换为含6 μg/mL聚凝胺培养基并分别加入30 MOI的COPB2-shRNA和Con-shRNA,48 h后加入嘌呤霉素筛选1 wk,用Western blot检测COPB2的相对表达,以评估稳转细胞的转染效果.
将SGC-7901细胞按5×105个/孔接种至6孔板中,待细胞约80%融合时,用LipofectamineTM2000分别转染pcDNA-Con和pcDNA-COPB2,48 h后,用Western blot检测COPB2的相对表达,以评估瞬时转染细胞的转染效果.
1.2.3 蛋白质免疫印迹(Western blot):在冰上用RIPA裂解细胞,并在4 ℃下以1.2×104g离心10 min收集蛋白溶液.用BCA试剂盒对蛋白溶液定量后,每样本取40 μg蛋白样品,通过SDS-PAGE电泳分离并转移至PVDF膜.封闭膜后,在4 ℃下将膜与一抗[p-Akt (1:1000)、COPB2和Akt (均1:2000)、GAPDH (1:5000)]一起孵育过夜.洗膜后,在室温下将膜与与二抗一起孵育1 h.再次洗膜后,通过增强的化学发光试剂盒对条带显影.用Image J软件对COPB2的表达进行定量.
1.2.4 细胞增殖测定:将已转染的SGC-7901细胞按5×103个/孔接种至96孔板中,培养24、48和72 h,加入CCK-8试剂并孵育2.5 h,用酶标仪检测490 nm波长的吸光度OD值.
1.2.5 细胞集落形成测定:将已转染的SGC-7901细胞按1000个/mL的细胞密度接种于6孔板中,每3 d换液一次,两周后,用甲醇固定细胞后,用姬姆萨染色,对细胞集落(肉眼可见或显微镜下大于50个细胞簇)进行计数.
1.2.6 细胞迁移和侵袭测定:将已转染的SGC-7901细胞用无血清培养基制备成2×104个/mL的细胞悬液.细胞迁移测定:取200 μL细胞悬液加入transwell板的上室中,600 μL含10% FBS的培养基加入下室.细胞侵袭测定:取200 μL细胞悬液加入基质胶涂覆膜的transwell板的上室中,600 μL含10% FBS的培养基加入下室.培养24 h后,分别取出上室,擦除膜的上表层的细胞,然后甲醇固定膜的下表层的细胞并用结晶紫染色.在显微镜下对染色的细胞进行拍照并计数.
1.2.7 肿瘤异体移植模型:本研究经过动物伦理委员会批准.将稳转COPB2-shRNA或Con-shRNA的SGC-7901细胞分别接种于BALB/c裸鼠的颈部皮下,每只小鼠接种5×106个细胞.接种后,每5天测量一次瘤体体积(V(mm3)=长径×宽径2× 0.5).第15天,麻醉并处死小鼠,分离瘤体组织.
1.2.8 免疫组织化学(IHC):取临床样本组织和肿瘤异体移植模型瘤体组织,分别用4%多聚甲醛固定后,用常规石蜡包埋法包埋组织.石蜡组织切为4 μm后的切片,然后用二甲苯脱蜡和梯度分级的乙醇再水化后,用3%的过氧化氢处理以阻断内源性过氧化物酶活性.将切片放入0.01 mol/L柠檬酸钠缓冲液(pH 6.0)中在微波炉中煮沸5 min以修复抗原.切片用10%的正常山羊血清封闭后,在4 ℃下与一抗(COPB2和Ki67,1:200;p-Akt,1:100)孵育过夜.用PBS清洗组织切片后,在室温下与生物素标记二抗(1:200)孵育30 min.用PBS清洗组织切片后,在室温下与链霉亲和素-辣根过氧化物酶复合物(1:200)孵育45 min.用PBS清洗组织切片后,用DAB显色和苏木素复染后,常规脱水、封片和显微镜下观察.
统计学处理采用GraphPad Prism 6软件将实验中所得的数据进行统计分析.数据用均数±标准差(mean±SD)表示,两组之间比较采用t检验,多组之间比较采用单因素方差分析;以P<0.05为界限判断有无统计学意义.
2 结果
2.1 COPB2在胃癌组织和癌细胞系中表达情况 免疫组化染色(图1A)显示,COPB2在癌旁组织阴性表达,而在胃癌组织中呈现弥漫强阳性表达.Western blot结果(图1B)显示,相对于正常胃上皮细胞系GES-1,COPB2在3种胃癌细胞系蛋白表达水平均升高(P<0.01).

图1 COPB2在胃癌组织和胃癌细胞系中表达情况. A:免疫组化检测癌旁组织及胃癌组织中COPB2表达的代表性图.B:Western blot检测正常胃上皮细胞系及胃癌细胞系中COPB2蛋白水平,与GES-1细胞比较:bP<0.01;n=3.
2.2 敲低和过表达COPB2效果的验证 通过Western blot分析COPB2-shRNA及pcDNA-COPB2的转染效率,结果(图2)表明,相对于Con-shRNA组,COPB2-shRNA组的SGC-7901细胞中COPB2蛋白表达降低(图2A,P<0.01);相对于pcDNA-Con组,pcDNA-COPB2组的SGC-7901细胞中COPB2蛋白表达增加(图2B,P<0.01).

图2 COPB2-shRNA与pcDNA-COPB2的转染效率检测.A:转染COPB2-shRNA或Con-shRNA后,Western blot检测COPB2蛋白表达水平;与Con-shRNA组比较:bP<0.01;n=3.B:转染pcDNA-COPB2或pcDNA-Con后,Western blot检测COPB2蛋白表达水平;与pcDNA-Con组比较:dP<0.01;n=3.
2.3 敲低和过表达COPB2对胃癌细胞生长的影响 用CCK-8法检测了敲低及过表达COPB2后SGC-7901细胞的细胞活性,结果显示,相对于Con-shRNA组,COPB2-shRNA组的SGC-7901细胞的细胞活性显著降低(图3A,P<0.01);相对于pcDNA-Con组,pcDNA-COPB2组的SGC-7901细胞的细胞活性显著升高(图3B,P<0.01).集落形成实验检测了敲低及过表达COPB2后SGC-7901细胞的集落形成,结果显示,相对于Con-shRNA组,COPB2-shRNA组的SGC-7901细胞的集落形成能力显著降低(图3C,P<0.01);相对于pcDNA-Con组,pcDNA-COPB2组的SGC-7901细胞的集落形成能力显著升高(图3D,P<0.01).

图3 敲低或过表达COPB2对胃癌细胞系集落形成的影响.A:CCK-8法检测敲低COPB2对细胞活性的影响;与Con-shRNA组比较:aP<0.05,bP<0.01;n=3.B:CCK-8法检测过表达COPB2对细胞活性的影响;与pcDNA-Con组比较:cP<0.05,dP<0.01;n=3.C:集落形成实验检测敲低COPB2对细胞集落数的影响;与Con-shRNA组比较:fP<0.01;n=3.C:集落形成实验检测过表达COPB2对细胞集落数的影响;与pcDNACon组比较:hP<0.001;n=3.
2.4 敲低和过表达COPB2对胃癌细胞系迁移和侵袭能力的影响 Transwell法评估细胞迁移和侵袭的结果显示,相对于Con-shRNA组,COPB2-shRNA组的SGC-7901胃癌细胞的迁移和侵袭能力均显著降低(图4A,P<0.01);相对于pcDNA-Con组,pcDNA-COPB2组的SGC-7901细胞的迁移和侵袭能力均显著升高(图4B,P<0.01).
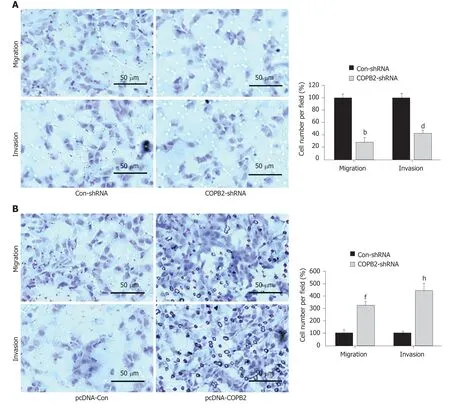
图4 敲低或过表达COPB2对胃癌细胞系迁移和侵袭能力的影响.A:集落形成实验检测敲低COPB2对SGC-7901细胞的迁移和侵袭的影响;与Con-shRNA组比较:bP<0.01,dP<0.01;n=3.B:集落形成实验检测过表达COPB2对SGC-7901细胞的迁移和侵袭的影响;与pcDNA-Con组比较,fP<0.01,hP<0.01;n=3.
2.5 敲低和过表达COPB2对p-Akt蛋白表达的影响Western blot法检测p-Akt蛋白表达的结果显示,相对于Con-shRNA组,COPB2-shRNA组的SGC-7901细胞中p-Akt蛋白表达降低(图5A,P<0.01);相对于pcDNA-Con组,pcDNA-COPB2组的SGC-7901细胞中p-Akt蛋白表达增加(图5B,P<0.01).

图5 敲低或过表达COPB2对胃癌细胞中p-Akt蛋白表达的影响. A:Western blot检测敲低COPB2对SGC-7901细胞中p-Akt蛋白表达的影响;与Con-shRNA组比较:bP<0.01;n=3.B:Western blot检测过表达COPB2对SGC-7901细胞中p-Akt蛋白表达的影响;与pcDNA-Con组比较:dP<0.01;n=3.
2.6 敲低COPB2对胃癌细胞系在体内生长的影响 与Con-shRNA组比较,COPB2-shRNA组瘤体生长明显减缓(图6A,P<0.001),瘤体普遍缩小(图6B).免疫组化结果(图6C)显示,发现COPB2-shRNA组COPB2、Ki-67及p-Akt染色强度低于Con-shRNA组.上述结果表明,敲低COPB2可以降低SGC-7901细胞在体内的生长.
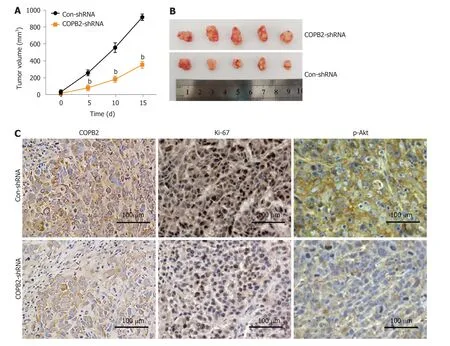
图6 敲低COPB2对胃癌细胞系在体内生长的的影响.A:各组瘤体体积的统计结果;与Con-shRNA组比较:bP<0.01;n=5.B:各组瘤体的大体形态.C:免疫组化检测各组瘤体组织中COPB2、Ki67和p-Akt表达的代表性图.
3 讨论
胃癌是全球范围内最常见的恶性肿瘤之一,据最新研究数据显示,其病死率位居所有癌症相关死亡的第3位[10].尽管,化疗仍是中晚期胃癌患者主要的治疗手段,其可在一定程度上延长患者生存期,但化疗的不良反应突出,且易导致耐药.近年来,随着对胃癌发生和发展的分子机制的深入研究,致使胃癌的分子靶向治疗越来越受到研究者们的关注,且个体化靶向治疗已为许多癌症患者带来了明显的益处[11].提示,继续深入研究影响胃癌进展的关键靶点,可能会为靶向疗法提供更多的参考策略.
近年来,研究发现COPB2参与调控许多肿瘤的进展与预后.如,Bhandari等[12]研究发现COPB2在乳腺癌组织中呈高表达水平,且其表达水平与乳腺癌淋巴结转移、肿瘤分期以及肿瘤大小成相关;Zhou等[13]研究结果显示COPB2在神经胶质瘤组织中表达上调,且其高表达水平与神经胶质瘤的不良预后呈正相关.以上这些数据表明COPB2可能与肿瘤进展、转移和不良预后有关,但其在胃癌中的表达以及作用尚不清楚.本研究显示,COPB2在胃癌组织中呈现高表达.肿瘤细胞的恶性增殖与转移是导致肿瘤进展甚至患者死亡的最主要因素.为探索COPB2对胃癌的作用,本研究采用敲低或过表达的方式研究了COPB2对胃癌细胞增殖、迁移与侵袭的作用,结果显示,过表达COPB2能促进胃癌细胞的增殖、迁移和侵袭,而敲低COPB2则能抑制胃癌细胞的增殖、迁移和侵袭.同时,这一结果在体内得证实.
本研究进一步对COPB2影响胃癌细胞增殖、迁移和侵袭的机制进行了初步探索.众多研究[14-16]显示,Akt信号的激活在肿瘤的发生与发展起着关键的促进作用,而抑制Akt信号活性能抑制肿瘤细胞的增殖、迁移和侵袭.本研究结果显示,过表达COPB2能促进p-Akt的表达,相反敲低COPB2则能抑制p-Akt的表达;说明COPB2能影响胃癌细胞中Akt信号活性,但COPB2是如何影响Akt信号活性以及COPB2是否影响其他影响胃癌细胞增殖、迁移和侵袭的信号途径仍有待更多的研究.
4 结论
总之,就目前结果而言,COPB2在胃癌中表达上调,而敲低COPB2表达可抑制胃癌细胞增殖、迁移和侵袭能力;另外,本研究提示,靶向COPB2可能会是胃癌的一个潜在的治疗策略.
文章亮点
实验背景
目前,人们对胃癌的发生和进展机制并不完全清楚,探索胃癌的发生和进展机制有助于今后对其诊断和治疗开发新方法.
实验动机
外被体蛋白复合物β2亚基(coatomer protein complex subunit beta 2,COPB2)在乳腺癌、肺癌、胶质瘤和结肠癌等多种肿瘤中高表达,且其可促进肿瘤进展.而其在胃癌中表达和作用并不清楚.
实验目标
检测COPB2在胃癌组织以及胃癌细胞系中的表达情况,并分析其表达对胃癌细胞增殖、侵袭和迁移能力的影响.
实验方法
检测COPB2在人胃癌组织样本以及胃癌细胞系中的表达情况.敲低或过表达胃癌细胞中COPB2表达后,检测胃癌细胞增殖、集落形成、迁移、侵袭以及Akt信号的改变情况.用肿瘤异体移植模型评估敲低COPB2对体内胃癌细胞生长能力的影响.
实验结果
COPB2在人胃癌组织样本和胃癌细胞系中高表达.敲低COPB2后,SGC-7901细胞的增殖、集落形成、迁移与侵袭以及Akt信号活性均降低;过表达COPB2后,SGC-7901细胞的上述指标均呈增加.另外,敲低COPB2后,SGC-7901细胞在体内生长减缓.
实验结论
COPB2在胃癌中发挥促癌进展作用,而敲低COPB2能抑制胃癌细胞增殖、迁移和侵袭.
展望前景
开发COPB2靶向抑制剂可能会成为研究胃癌治疗药物的一个潜在方向.
5 参考文献
1 Zong L,Abe M,Seto Y,Ji J.The challenge of screening for early gastric cancer in China.Lancet2016;388:2606 [PMID:27894662 DOI:10.1016/S0140-6736(16)32226-7]
2 Tan Z.Recent Advances in the Surgical Treatment of Advanced Gastric Cancer:A Review.Med Sci Monit2019;25:3537-3541[PMID:31080234 DOI:10.12659/MSM.916475]
3 Tarsounas M,Heng HH,Ye CJ,Pearlman RE,Moens PB.Identification of the mouse beta’-COP Golgi component as a spermatocyte autoantigen in scleroderma and mapping of its gene Copb2 to mouse chromosome 9.Cytogenet Cell Genet1999;87:201-204 [PMID:10702668 DOI:10.1159/000015467]
4 Beyer AR,Rodino KG,VieBrock L,Green RS,Tegels BK,Oliver LD Jr,Marconi RT,Carlyon JA.Orientia tsutsugamushi Ank9 is a multifunctional effector that utilizes a novel GRIP-like Golgi localization domain for Golgi-to-endoplasmic reticulum trafficking and interacts with host COPB2.Cell Microbiol2017;19 [PMID:28103630 DOI:10.1111/cmi.12727]
5 Wang Y,Chai Z,Wang M,Jin Y,Yang A,Li M.COPB2 suppresses cell proliferation and induces cell cycle arrest in human colon cancer by regulating cell cycle-related proteins.Exp Ther Med2018;15:777-784 [PMID:29399086 DOI:10.3892/etm.2017.5506]
6 Wang Y,Xie G,Li M,Du J,Wang M.COPB2 gene silencing inhibits colorectal cancer cell proliferation and induces apoptosis via the JNK/c-Jun signaling pathway.PLoS One2020;15:e0240106 [PMID:33211699 DOI:10.1371/journal.pone.0240106]
7 Wang X,Shi J,Niu Z,Wang J,Zhang W.MiR-216a-3p regulates the proliferation,apoptosis,migration,and invasion of lung cancer cells via targeting COPB2.Biosci Biotechnol Biochem2020;84:2014-2027 [PMID:32619135 DOI:10.1080/09168451.2020.1783197]
8 Pu X,Wang J,Li W,Fan W,Wang L,Mao Y,Yang S,Liu S,Xu J,Lv Z,Xu L,Shu Y.COPB2 promotes cell proliferation and tumorigenesis through up-regulating YAP1 expression in lung adenocarcinoma cells.Biomed Pharmacother2018;103:373-380[PMID:29674272 DOI:10.1016/j.biopha.2018.04.006.]
9 Mi Y,Yu M,Zhang L,Sun C,Wei B,Ding W,Zhu Y,Tang J,Xia G,Zhu L.COPB2 Is Upregulated in Prostate Cancer and Regulates PC-3 Cell Proliferation,Cell Cycle,and Apoptosis.Arch Med Res2016;47:411-418 [PMID:27986120 DOI:10.1016/j.arcmed.2016.09.005]
10 Ferlay J,Colombet M,Soerjomataram I,Mathers C,Parkin DM,Piñeros M,Znaor A,Bray F.Estimating the global cancer incidence and mortality in 2018:GLOBOCAN sources and methods.Int J Cancer2019;144:1941-1953 [PMID:30350310 DOI:10.1002/ijc.31937]
11 Bedard PL,Hyman DM,Davids MS,Siu LL.Small molecules,big impact:20 years of targeted therapy in oncology.Lancet2020;395:1078-1088 [PMID:32222192 DOI:10.1016/S0140-6736(20)30164-1]
12 Bhandari A,Zheng C,Sindan N,Sindan N,Quan R,Xia E,Thapa Y,Tamang D,Wang O,Ye X,Huang D.COPB2 is up-regulated in breast cancer and plays a vital role in the metastasis via N-cadherin and Vimentin.J Cell Mol Med2019;23:5235-5245 [PMID:31119859 DOI:10.1111/jcmm.14398]
13 Zhou Y,Wang X,Huang X,Li XD,Cheng K,Yu H,Zhou YJ,Lv P,Jiang XB.High expression of COPB2 predicts adverse outcomes:A potential therapeutic target for glioma.CNS Neurosci Ther2020;26:309-318 [PMID:31710183 DOI:10.1111/cns.13254]
14 Song M,Bode AM,Dong Z,Lee MH.AKT as a Therapeutic Target for Cancer.Cancer Res2019;79:1019-1031 [PMID:30808672 DOI:10.1158/0008-5472.CAN-18-2738]
15 Shariati M,Meric-Bernstam F.Targeting AKT for cancer therapy.Expert Opin Investig Drugs2019;28:977-988 [PMID:31594388 DOI:10.1080/13543784.2019.1676726]
16 Ao R,Guan L,Wang Y,Wang JN.Silencing of COL1A2,COL6A3,and THBS2 inhibits gastric cancer cell proliferation,migration,and invasion while promoting apoptosis through the PI3k-Akt signaling pathway.J Cell Biochem2018;119:4420-4434 [PMID:29143985 DOI:10.1002/jcb.26524]
