白皮杉醇通过MAPK/ERK信号通路对急性重症一氧化碳中毒大鼠脑损伤的保护作用
2021-08-21王士杰毕见龙
曹 娟,王士杰,毕见龙
(北京大学国际医院急诊科,北京 102206)
一氧化碳(carbon monoxide,CO)中毒是临床上常见的吸入性中毒事件之一[1]。CO中毒的致病机理是CO与血红蛋白结合,形成结构稳定的碳氧血红蛋白(carboxyhemoglobin,HbCO),使血红蛋白无法结合氧分子,造成组织缺氧[2]。机体在短时间内吸入过量CO可致急性重症CO中毒(acute carbon monoxide poisoning,ACOP),引起组织细胞损伤,其中对脑组织细胞的损害最严重[3]。它能引起多种严重并发症,尤其是急性脑损伤和迟发性脑病[4]。
丝裂素活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路是一个复杂的细胞内信号转导网络,参与调控细胞生长、分裂、分化、死亡等各个阶段的生理活动,对调节机体生理病理反应过程中起着重要作用[5]。其中细胞外调节蛋白激酶(extracellular siganl-regulated kinase,ERK)信号通路涉及生长和分化中不同受体的激活,参与细胞的增殖、分化、形态维持、骨架构建、细胞凋亡和癌变等多种生化反应[6-7]。然而,在已经不需要增殖和分化的成熟神经元细胞中仍有大量的ERK上游调控子和下游靶蛋白的存在,经研究发现,ERK与哺乳动物的学习和记忆过程有着紧密关系[8]。
白皮杉醇(piceatannol,PIC)也称比杉特醇,是一种多酚类化合物,化学名为3,3’,4,5’-四羟基反式二丙乙烯,分子式为C14H12O4。PIC主要存在于葡萄、甘蔗、大黄、蓝莓及百香果等植物中[9]。PIC具有抗炎、抗氧化活性,清除自由基的作用[10]。根据已有研究报道[11],PIC可抑制脑细胞凋亡发挥对缺血缺氧性脑组织损伤大鼠大脑具有保护作用。本研究旨在通过MAPK信号通路揭示PIC对一氧化碳中毒大鼠脑损伤的保护作用。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠100只,购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],45周龄,体重为(220±20)g,饲养于本院动物实验中心[SYXK(京)2016-0044],饲养室保持良好通风,饲养环境温度为(25±2)℃,湿度(50±10)%,12 h昼夜周期。正常饲养1周以适应环境,第2周开始进行实验,使用大鼠时严格按照3R原则给予人道关怀。动物实验按照本院动物管理委员会(IACUC2018001)的规定执行,并已通过北京大学国际医院实验动物伦理与管理委员会审批(20190508001)。
1.2 主要试剂与仪器
PIC购自梯希爱(上海)化成工业发展有限公司(批号:10083-24-6);ERK1/2通路抑制剂(500μmol/L)购自美国Sigma公司;HE染色试剂盒和TUNEL染色试剂盒购自南京凯基生物有限公司;ROS检测试剂盒购自北京鼎国昌盛生物技术有限公司;Western blot试剂盒购自美国BD公司。
处理箱(订制90 L容积的亚克力材质密封箱体,箱侧壁存在可密封的进气口和出气口,箱内装有CO检测仪);99.99%CO气体购自西南化工研究所;血气分析仪购自德国拜耳公司;Morris水迷宫及分析跟踪系统由首都医科大学宣武医院实验动物室提供;线粒体提取试剂盒及膜电位检测试剂盒购自北京Solatbio Sciences&Technology有限公司;光学显微镜;透射电子显微镜(日产JEM-1230)。
1.3 实验方法
1.3.1 分组及急性CO中毒动物模型制备
饲养的第8天,将100只大鼠随机分为四组:空白对照组(NC组)、ACOP模型组(CO组)、ACOP模型采用PIC处理组(PIC组)和ACOP模型采用PIC和ERK抑制剂同时处理组(PIC+ERK组),每组各25只。除NC组外,其余各组大鼠根据文献[3]描述制备ACOP大鼠模型。将大鼠置于90 L的处理箱中,持续吸入浓度为1000 ppm的CO气体20 min,CO浓度升高至2000 ppm,持续吸入20 min,随后CO气体浓度升高至3000 ppm,大鼠在箱中持续吸入气体20 min后,转移至箱外呼吸空气。NC组大鼠在处理箱中持续吸入空气60 min。制模过程中观察大鼠的行为状态,出箱后立即从大鼠左侧股动脉抽取0.3 mL的全血,使用血气分析仪采用微量定量法检测血液中碳氧血红蛋白浓度(COHb%)。
1.3.2 给药方法
制备模型后,NC组与CO组大鼠正常饲养;PIC组大鼠给予200 mg/kg PIC灌胃,灌胃剂量2 mL,每天1次,共33 d;PIC+ERK组大鼠给予200 mg/kg PIC和0.2 mg/kg ERK抑制剂灌胃,灌胃剂量2 mL,每天1次,共33 d;NC组与CO组灌胃等量生理盐水。
1.3.3 Morris水迷宫实验
四组大鼠处理后于第2天进行Morris水迷宫实验,6 d为一个实验周期,水迷宫实验包括定位航行和空间探索两个阶段[12-14]。定位航行实验共进行5次,每次5 d,每天训练4次;每次更换入水点,大鼠找到平台后或120 s内找不到平台,拿上平台,休息15 s后进行下一次训练,记录四组大鼠逃避潜伏期,计算每组大鼠每次实验得到逃避潜伏期的平均值。空间探索实验在定位航行实验结束后1 d进行,撤去原平台,所有大鼠从同一入水点放入水中,记录大鼠在120 s内穿越平台次数。逃避潜伏期和穿越平台次数取一个实验周期内得到的平均值。
1.3.4 脑组织标本制备
制备模型后33 d,四组大鼠进行完空间探索实验后,每组大鼠随机取10只,其中每组5只用4%苯巴比妥钠深度麻醉后,从左心室灌注200 mL的生理盐水和4%多聚甲醛,取脑,放入4%多聚甲醛4℃固定48 h,脱水,石蜡包埋,冠状位连续切片,厚度6μm,用于HE染色和TUNEL染色。剩余大鼠取脑,冰面上分离海马区,-80℃保存,用于线粒体的提取、神经元超微结构观察、ROS含量检测、Western blot实验。
1.3.5 HE染色检测大鼠脑组织形态
将四组大鼠脑组织石蜡切片依次脱蜡,水化,经苏木素-伊红染色,脱水,二甲苯透明,干燥,中性树胶封片,光学显微镜下观察大鼠脑组织海马区细胞形态并拍摄照片。
1.3.6 TUNEL染色检测大脑细胞凋亡
将四组大鼠脑组织石蜡切片脱腊至水,加入蛋白酶K工作液,37℃孵育20 min,加入Tunel反应液湿盒37℃避光孵育1 h,PBS洗涤,DAB显色10 min,苏木素复染,脱水,透明,中性树脂封片。每张切片随机选取互不重叠的3个视野,于400倍镜下通过Lasersharp 2000软件进行图像采集,颗粒状绿色深染的细胞为TUNEL阳性细胞,观察并记录图片中阳性细胞数。
1.3.7 离体神经元超微结构观察
取四组大鼠海马区齿状回平面切组织块样本,放入4%的戊二醛溶液中固定,环氧乙烷处理,环氧树脂包埋,包埋的组织样本进行超薄切片,枸橼酸铅染液染色,水洗,通过透射电子显微镜(transmission electron microscope,TEM)观察切片并拍摄照片。
1.3.8 流式细胞仪检测线粒体膜电位
用线粒体提取液分离并纯化线粒体,然后添加5倍稀释的JC-1染料工作液,阴性对照切片以PBS代替荧光染料。线粒体膜电位(mitochondrial membrane potential,MMP)的变化采用流式细胞仪的cflowfplus软件分析系统。每个实验重复10次,取每组所有样本MMP相对值的平均值,用平均荧光强度(mean fluorescence intensity,MFI)表示。
1.3.9 活性氧试剂盒检测四组大鼠ROS水平
取500 g脑组织的细胞匀浆液,12000 r/min离心30 min,弃上清液,加入10μmol/L的DCFH-DA,移液枪吹打混匀,使细胞悬浮于DCFH-DA中,在37℃的细胞培养箱内孵育20 min,每3 min颠倒混匀,使试剂与细胞完全接触,无血清培养基洗涤3次后悬浮于PBS溶液中,使用流式细胞仪在488 nm激发波长,525 nm处检测样品的荧光强度。
1.3.10 Western blot分析Nrf-2及Bcl-2蛋白表达
将海马区称重后加入7 mL/g脑组织的裂解液制备脑组织匀浆液,在4℃下1200 r/min离心30 min,置于冰上裂解30 min,取上清液,采用二喹啉甲酸(bicinchonininc acid,BCA)法进行蛋白定量检测,加入样品得到1X蛋白上样缓冲液,混匀,95℃下变性10 min。按Western blot法[9]检测Nrf-2、Bcl-2蛋白表达水平,加入待测样品进行电泳,转膜,封闭1 h,按照抗体说明书进行一抗孵育过夜,加入二抗显色,成像。采用Image J软件进行灰度值分析,每一条蛋白条带以自身β-actin作为内参进行灰度校正。
1.4 统计学方法
用Graphpad 5.0软件分析实验数据,定量数据用平均数±标准差(±s)表示,实验数据进行正态性和方差性检验,逃避潜伏期和穿越平台次数比较采用重复测量资料的方差分析,海马区Nrf-2、Bcl-2的表达采用单因素方差分析进行组间比较,两两比较采用LSD法,P<0.05表示差异显著,结果具有统计学意义。
2 结果
2.1 各组大鼠急性CO中毒模型制备后行为表现及血液COHb%检测结果
处理箱内CO浓度为2000 ppm条件下,CO组、PIC组和PIC+ERK组大鼠在5~15 min内表现为兴奋躁动,15 min后表现为呼吸急促。CO浓度升高至3000 ppm后,大鼠出现四肢抽搐,大小便失禁,口、鼻、耳、四肢及尾部皮肤呈现樱桃红色,随后四肢无力甚至昏迷。昏迷大鼠出箱后吸入空气,逐渐恢复活动,制模过程无大鼠退出实验。处理后,CO组、PIC组和PIC+ERK组大鼠血液中COHb%均大于40%,NC组大鼠无上述表现,血液中COHb%小于5%,表明ACOP大鼠模型制备成功,四组大鼠COHb%的比较见图1。

图1 四组大鼠血液中COHb%比较(n=25)Figure 1 Comparison of COHb% in blood among four groups of rats
2.2 各组大鼠Morris水迷宫实验观察比较
处理后1~6 d Morris水迷宫实验结果无显著性差异;处理后14~33 d,随着病程延长,CO组和PIC+ERK组平均逃避潜伏期逐渐延长,穿越平台次数逐渐减少,与NC组比较有显著差异(P<0.001)。处理后14~33 d,PIC组与同期CO组和PIC+ERK组比较,平均逃避潜伏期缩短,跨越平台次数明显增多(P<0.001),与NC组比较,21~28 d定位航行实验差异显著(P<0.05),空间探索实验无显著差异(P>0.05)。结果见表1、表2。
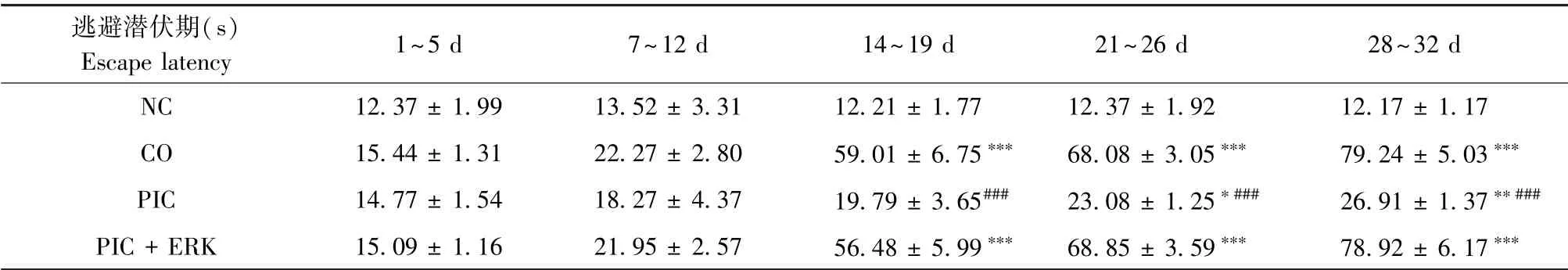
表1 四组大鼠定位航行实验结果统计(n=25)Table 1 Statistics results of the place navigation experiments among four groups of rats

表2 四组大鼠空间探索实验结果统计(n=25)Table 2 Statistics results of the spatial probe experiments among four groups of rats
2.3 PIC对大鼠脑组织形态的影响
四组大鼠海马区脑组织HE染色观察结果如下:NC组细胞形态结构正常;CO组细胞结构疏松;PIC组结构较紧密;PIC+ERK组细胞形态与CO组相近。PIC处理后,PIC组大鼠的脑组织细胞的形态结构没有明显的病理性变化(见图2)。
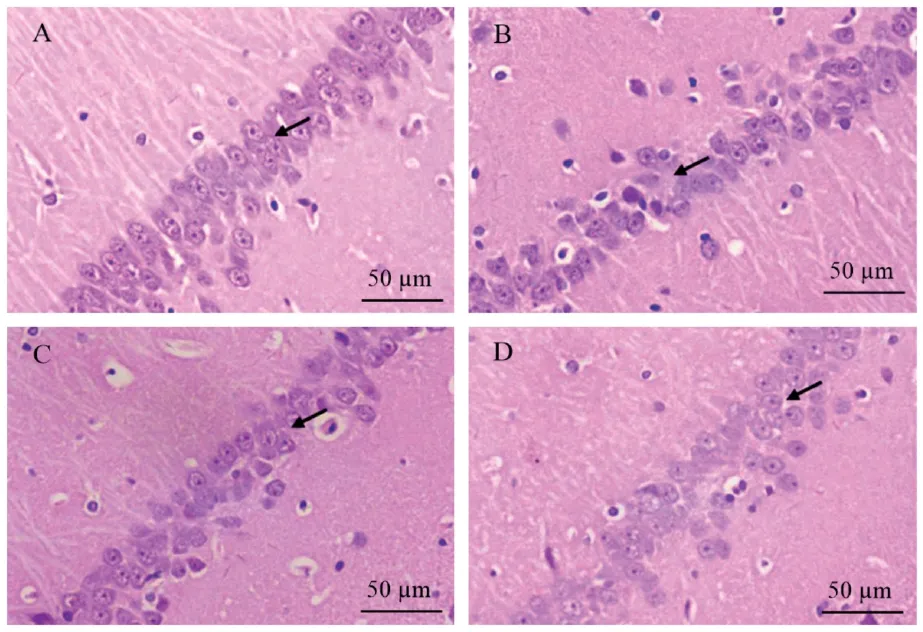
图2 四组大鼠脑组织HE染色形态观察结果(n=25)Note.A,NC group.B,CO group.C,PIC group.D,PIC+ERK group.The same as below.Figure 2 Results of HE staining in brain tissues among four groups of rats
2.4 大鼠脑组织神经细胞超微结构观察比较
四组大鼠脑组织神经细胞超微结构观察结果(见图3):NC组,大鼠脑组织的海马区神经细胞轮廓清晰,染色质均匀分布,胞质清晰,双层细胞核膜清晰完整,胞浆内线粒体结构完整,数量较多,未出现空泡。CO组和PIC+ERK组细胞核出现固缩,线粒体肿胀,嵴断裂或者变少,甚至细胞水肿出现空泡化。PIC组细胞轮廓较为清晰,染色质均一,线粒体形态规则。

图3 四组大鼠神经元细胞超微结构观察Figure 3 Observation of ultra-structure of neuron among four groups of rats
2.5 四组大鼠脑组织细胞凋亡情况比较
TUNEL染色结果见图4,NC组TUNEL阳性细胞数量少,而CO组和PIC+ERK组有大量绿染TUNEL阳性细胞,PIC组有少量TUNEL阳性细胞。四组阳性细胞计数结果见表,CO组和PIC+ERK组显著高于NC组和PIC组(P<0.001)。

图4 TUNEL染色检测细胞凋亡情况(n=25)Note.A,Representative images from four groups of rats.B,Comparison of apoptotic cell among four groups of rats.Compared with NC group,**P<0.01,***P<0.001.Compared with CO group and PIC+ERK group,###P<0.001.Figure 4 TUNEL staining in brain of rats
2.6 四组大鼠脑组织海马区神经细胞线粒体膜电位改变
NC组大鼠脑组织海马区中MFI值维持较高水平,表明其神经细胞线粒体功能完整。CO组和PIC+ERK组大鼠MFI值显著低于NC组,差异具有统计学意义(P<0.001),说明CO组和PIC+ERK组大鼠对的神经细胞中线粒体损伤严重。PIC组大鼠MFI值较CO组和PIC+ERK组高,且差异显著(P<0.001),低于NC组,表明经过PIC对CO中毒后大鼠的神经细胞有一定程度的保护作用。见图5。

图5 四组大鼠脑组织神经细胞MFI值比较(n=25)Note.Compared with NC group,***P<0.001.Compared with CO group and PIC+ERK group,###P<0.001.Figure 5 Comparison of MFI value in neuron among four groups of rats
2.7 四组大鼠海马区氧化应激损伤指标检测
与NC组比较,CO组和PIC+ERK组海马区ROS含量明显升高,差异显著(P<0.01)。PIC+ERK组的ROS含量与CO组接近,差异不显著(P>0.05)。PIC组与CO组和PIC+ERK组比较,ROS含量下降,差异具有统计学意义(P<0.01)。见图6。

图6 四组大鼠海马区氧化应激损伤(n=25)Note.A,Fluorescence detecting results of ROS.B,Comparison of DCF-positive cells to show ROS level in hippocampus among four groups of rats.Compared with NC group,**P<0.01.Compared with CO group and PIC+ERK group,##P<0.01.Figure 6 Oxidative stress level detection in hippocampus among four groups of rats
2.8 Nrf-2及Bcl-2蛋白在大鼠脑组织海马区中的表达变化
Western blot结果显示,Nrf-2、Bcl-2蛋白的表达在四组大鼠间无显著差异(P>0.05),PIC组相对于NC组、CO组、PIC+ERK组,大鼠脑组织海马区中Nrf-2、Bcl-2蛋白的表达水平上升。见图7。
3 讨论
ACOP主要是由组织持续缺氧引发的[15]。在哺乳动物的各器官系统中,以脑神经元细胞对缺氧最为敏感,缺血缺氧都易造成脑损伤甚至细胞死亡,从而引起机体出现学习、记忆机能减退等表现[16]。ACOP造成脑损伤,致死率高,治疗难度大[17]。目前常用的的治疗手段是高压氧治疗,能有效改善急性期中毒患者组织缺氧的情况,减轻中毒症状。但是该疗法对重症患者和迟发性脑病患者的治疗效果有限[3]。寻找新的治疗手段是目前相关学者研究的重点。已有研究认为急性CO中毒引起脑损伤的机制有:(1)血液和组织的缺氧性损伤及随之产生的氧化应激反应[4,17-18];(2)神经炎症反应[15];(3)线粒体介导神经细胞凋亡[4]。而脑组织中海马区参与机体的学习和记忆过程,对空间定位起到了重要作用,并且对于组织缺氧造成的损伤十分敏感。已有研究表明,PIC对于治疗神经细胞损伤有一定疗效[11]。Morris水迷宫实验是国内外常用的检测大鼠空间学习记忆能力的实验[14]。
本研究对CO组、PIC组和PIC+ERK组大鼠制备ACOP模型,结果显示三组大鼠血液中COHb%均>40%,明显高于NC组大鼠,说明大鼠ACOP模型制备成功。随后进行5次Morris水迷宫实验检测CO的毒性对于大鼠学习记忆能力的影响,结果显示经过PIC治疗14~33 d,PIC组大鼠定位航行实验的平均逃避潜伏期明显低于CO组大鼠(P<0.05),与NC组间比较差异无统计学意义(P>0.05);空间探索实验中PIC组大鼠跨越平台次数明显高于CO组大鼠(P<0.05),与NC组无显著差异(P>0.05),表明经过PIC处理的大鼠空间学习和记忆能力较未用药物处理的模型大鼠有明显恢复。王鲲宇等[17]研究结果显示进行Morris水迷宫实验CO中毒的模型组大鼠的逃避潜伏期较干预组和对照组明显延长,本研究结果与之相符。在行为实验观察结束后,对四组大鼠的脑组织细胞形态、凋亡情况等进行观察,比较不同处理的大鼠脑组织细胞的生理结构变化,结果显示PIC处理的大鼠,脑细胞形态与对照组相近,无明显的病理结构变化,凋亡细胞数目明显少于CO组大鼠(P<0.05),说明PIC对急性CO中毒大鼠的脑损伤情况起到了保护作用。本研究将进一步探讨PIC对于由CO中毒引起的脑损伤的保护机制。
线粒体膜在细胞凋亡的起始过程中起到重要作用[3,19]。线粒体膜电位的降低导致膜孔道的开放,使内膜及外模的离子对流,造成呼吸链异常,进而使得线粒体功能受损[16]。线粒体功能障碍使得细胞中氧自由基增多,ROS含量增加,形成氧自由基连锁反应,破坏生物膜及其功能,造成细胞损伤及凋亡[19]。线粒体介导的细胞凋亡在氧化应激的生理过程中发挥着重要作用。本研究对四组大鼠神经元细胞超微结构的观察与线粒体膜电位的检测,可以看出未经药物处理的模型大鼠神经细胞中线粒体结构受到严重破坏,CO组大鼠与NC组比较,线粒体膜电位明显下降,细胞中ROS含量显著增加(P<0.05),该结果与已有研究一致[3]。而采用PIC灌胃处理的大鼠,线粒体结构较为完整,与CO组比较,MMP下降程度低,对线粒体功能影响较小,细胞中ROS含量较低(P<0.05),说明PIC可能对于CO造成的线粒体结构损伤起到了保护作用。
Bcl-2蛋白是目前最受关注的凋亡相关蛋白,分布于线粒体膜、内质网和核膜孔周围[16,20]。已有研究报道,细胞受损情况与细胞中ERK通路的激活情况相关,通过激活ERK信号通路,能诱发下游细胞信号分子Bcl-2的表达,从而抑制细胞凋亡[5]。PIC抑制细胞凋亡,减轻脑损伤与MAPK/ERK信号通路有关[10]。通过实验证明,激活ERK信号通路可以上调Nrf-2蛋白的表达[20-22]。根据研究报道,CO中毒后,人为诱导Nrf-2过表达能发挥其抗氧化机制[3]。Nrf-2能被多种外源物质诱导,是常用抗氧化应激治疗的靶向位点。PIC已被证明通过上调Nrf-2蛋白的表达水平有助于缓解细胞的炎症反应和氧化应激反应,对组织损伤起到保护作用[9,23]。在本研究中,与CO组大鼠相比,PIC处理的大鼠Nrf-2和Bcl-2的表达量增加(P<0.05),同时采用PIC和ERK抑制剂处理模型大鼠相较于NC组大鼠,其学习记忆能力下降明显,脑组织细胞形态异常,神经细胞凋亡数目较多,超微结构受到损害,MMP值显著下降,ROS含量上升,Nrf-2和Bcl-2蛋白的表达下降(P<0.05),说明PIC可能通过激活ERK信号通路,使Nrf-2、Bcl-2蛋白过表达,来保护线粒体结构的完整,抑制氧化应激反应。图7 Western blot检测Nrf-2和Bcl-2蛋白表达水平(n=25)

图7 Western blot检测Nrf-2和Bcl-2蛋白表达水平(n=25)Figure 7 Relative expression of Nrf-2 and Bcl-2 protein detected by Western blot in brain tissue among four groups of rats
基于以上结果推测,PIC可能通过调控MAPK/ERK信号通路,上调Nrf-2和Bcl-2蛋白的表达,有效保护了大鼠脑组织,防止急性重症CO中毒引起的损害。
