石斛人参蝙蝠蛾姜胶囊的功效成分测定与其对CI/F1小鼠免疫功能的调节作用研究
2021-08-21洁张成香孙杰李世芬王玉邦环
程 洁张成香孙 杰李世芬王玉邦环 飞*
(1.江苏省医药农药兽药安全性评价与研究中心,南京 211166;2.南京医科大学公共卫生学院,南京 211166)
铁皮石斛主要成分有大量多糖、生物碱、氨基酸、微量元素等,其主要药理作用有提高免疫力,降血糖、降血脂、降血压、抗肿瘤、抗氧化、延缓衰老、抗疲劳[1]。蝙蝠蛾拟青霉菌从冬虫夏草中分离纯化后所得麦角菌科蝙蝠蛾拟青霉菌株,研究表明其具有提高免疫活性和抗疲劳作用[2-3]。人参提取物中的主要功效成分为人参皂甙、多糖,还含有少量黄酮、多肽、甾醇、氨基酸、蛋白质、生物碱、有机酸以及木质素等多种化学成分。人参具有增强免疫力、改善记忆力、改善心血管功能、抗肿瘤和延缓衰老等药理作用[4-5]。干姜作为传统常用药食同源的中药材,其性热味辛,功效为温中散寒,回阳通脉,温肺化饮[6],干姜理化作用为解热、镇痛、抗炎、抑菌、改善心血管功能、还具有保护胃黏膜、抗溃疡以及保肝利胆等作用[7]。
干姜和铁皮石斛作为“药食同源”的中药材,本身食用安全,研究表明铁皮石斛、人参、蝙蝠蛾拟青霉菌及其制剂均未发现毒性、食用安全,可进一步开发利用复配成具保健功能的食品[8-12]。不同植物多糖对免疫调节功效不同[13],同时根据健康需求和药性配伍不同的中药材,达到协同作用,提高保健食品的功效,将铁皮石斛和人参提取物,并辅以蝙蝠蛾拟青霉菌粉、干姜提取物为原料配伍制成石斛人参蝙蝠蛾姜胶囊。本实验对石斛人参蝙蝠蛾姜胶囊的功效成分测定及其对小鼠免疫系统影响的研究,旨在为进一步开发利用铁皮石斛、人参提取物、蝙蝠蛾拟青霉菌粉、干姜提取物复方的保健功能提供科学依据。
1 材料和方法
1.1 实验动物
选择8~10周龄(体重为19.0~21.7 g)的SPF级雌性小鼠200只,品系为CI/F1(BALB/c与ICR杂交一代),由上海西普尔-必凯实验动物有限公司[SCXK(沪)2018-0006]提供。动物饲养于南京医科大学卫生分析检测中心屏障系统[SYXK(苏)2020-0006],并按实验动物使用的3R原则给予人道的关怀,伦理审批经南京医科大学卫生分析检测中心实验动物伦理委员会审核通过(GZ01020160063-3)。
1.2 主要试剂与仪器
石斛人参蝙蝠蛾姜胶囊由某公司提供,主要成分包括铁皮石斛133 g、人参提取物45 g、蝙蝠蛾拟青霉菌粉111 g、干姜提取物24 g、微晶纤维素32 g和二氧化硅5 g按比例混后制成胶囊,人体推荐剂量为每人每天3.15 g。
培养基(RPMI1640,Gibco公司,美国);刀豆蛋白A(ConA,Sigma公司,美国);胎牛血清(浙江天杭生物科技股份有限公司);吩嗪二甲酯硫酸盐(NP40,Fluka公司,美国);2,4-二硝基氟苯(DNFB,医药集团(上海)化学试剂公司);四甲基偶氮哇(MTT,Amresco公司,美国);印度墨汁(北京笃信精细制剂厂);无菌脱纤维羊血(SRBC,江苏博达生物工程有限公司);鸡红细胞悬液为实验室自制。
1.3 实验方法
1.3.1 功能成分含量测定
(1)人参皂甙
供试品采用水超声30 min,定容后摇匀,放置后吸取上清液备用进行柱层析[14]。采用3 cm的Amberlite-XAD-2大孔树脂和1 cm中性氧化铝作为层析柱,先后用70%乙醇与水洗柱,弃去洗脱液,加入1 mL已处理好的实验溶液,先用25 mL水洗柱,弃去洗脱液,再用25 mL 70%乙醇洗脱人参皂甙,收集洗脱液,60℃挥干;加入0.2 mL 5%香草醛冰乙酸溶解,再加0.8 mL高氯酸,混匀后60℃水浴10 min,冷却后加入冰乙酸5 mL摇匀,采用分光光度计于560 nm波长处与标准管一起进行比色测定,以人参皂甙Re为对照品。
(2)多糖测定
供试品采用水加热回流2 h[15],定容,混匀,滤过;取滤液2 mL,加入无水乙醇定容至10 mL,摇匀,冷藏1 h后离心(4000 r/min,20 min),弃去上清液,沉淀加80%乙醇洗涤2次,离心,弃去上清液,沉淀加热水溶解,冷却,定容后待测备用;取1 mL待测溶液后加入5%苯酚溶液1 mL,摇匀、加硫酸5 mL后摇匀、置沸水浴中加热20 min,冷却后采用分光光度计于488 nm波长处与标准管一起进行比色测定,以无水葡萄糖为对照品。
(3)腺苷测定
供试品采用水超声提取10 min后[14],定容混匀后离心(3000 r/min,3 min),经0.45μm滤膜过滤后采用液相色谱测定,色谱柱为C18柱,以1 mol/L磷酸二氢钾∶甲醇=90∶10为流动相,流量1.0 mL/min,检测波长为254 nm。
1.3.2 小鼠调节免疫功能实验
设定小鼠剂量分别为260 mg/kg、530 mg/kg和1580 mg/kg 3个剂量组[13],根据体表面积将小鼠剂量换算为人体等效剂量分别为21.1 mg/kg、43.1 mg/kg、128.4 mg/kg;阴性对照组(0 mg/kg,无菌水)。200只小鼠根据初始体重随机分组,先分成5个大组,再按受试物给予剂量分成4个组,总计20组,每组10只小鼠。各免疫功能实验分组情况见表1。

表1 分组表Table 1 Grouping table
每天同一时间段给予受试物,连续30 d,各组小鼠按10 mL/kg灌胃给予受试物,30 d后测定调节免疫的各项指标。
(1)体重和免疫器官相对重量
连续给予受试物30 d后,取用于小鼠碳廓清实验(第4大组)的40只小鼠,称量终未体重,颈椎脱臼法处死小鼠,无菌条件下摘取脾和胸腺,并称量脏器重量,按公式:相对重量=脏器绝对重量(mg)/小鼠体重(g),计算各自免疫器官相对重量。
(2)小鼠淋巴细胞增殖实验(ConA诱导的脾淋巴细胞转化实验)及NK细胞活性测定
连续给予受试物30 d后,取第1大组的40只小鼠,称量终末体重,颈椎脱臼法处死小鼠,无菌条件下摘取脾,研磨脾,无菌细胞筛网过滤,用Hank’s液洗2次,每次离心10 min(1000 r/min),制成单个细胞悬液,取部分细胞用RPMI1640培养液将调整浓度,24孔培养板加入1 mL浓度为每毫升3×106个细胞悬液,平行两孔,一孔加浓度为100μg/mL的ConA溶液75μL,另一孔细胞作为对照,置于37℃、5%CO2培养箱中培养72 h。培养结束前4 h,吸去上清液0.7 mL,加入0.7 mL不含胎牛血清的培养液,每孔加入50μL浓度为5 mg/mL的MTT,继续培养4 h后每孔加入1 mL酸性异丙醇,混匀,使紫色结晶溶解,将溶解液转移至96孔培养板测定各孔光密度值,酶标仪测定波长为570 nm,按公式:淋巴细胞增殖能力=含有ConA的组光密度值-无ConA的组光密度值。
取小鼠淋巴细胞增殖实验中制成的单个细胞悬液,离心10 min(1000 r/min)弃上清后加入灭菌水裂解红细胞20 s,加入Hank’s液混匀后离心,弃上清用含10%胎牛血清完全培养液调整细胞浓度。取浓度为每毫升2×107个的脾细胞悬液100μL和浓度为每毫升4×105个的YAC-1细胞悬液100μL加入96孔培养板(U型),混匀后置于5%CO2、37℃的条件下培养4 h,离心,取上清液100μL转移至96孔培养板(平底)中,与100μL的LDH基质液反应10 min,加终止液30μL(1 mol/L的HCl)后测定各孔光密度值,酶标仪测定波长为490 nm,按公式:NK细胞活性(%)=(反应孔OD值-自然释放孔OD值)/(最大释放孔OD值-自然释放孔OD值)×100,计算NK细胞活性。
(3)DNFB诱导小鼠迟发型变态反应(DTH)
连续给予受试物30 d后,取第2大组的40只小鼠腹部去毛,范围约3 cm×3 cm,用浓度10 mg/mL DNFB溶液50μL均匀涂抹诱导致敏,5 d后于小鼠右耳双面涂均匀抹10μL激发,激发后24 h颈椎脱臼法处死小鼠,左右耳各剪下直径为8 mm的圆形耳片,称重。按公式:耳重差(mg)=右耳重(mg)-左耳重(mg),计算右耳肿胀程度,以反映受试物对DNFB诱导小鼠迟发型变态反应影响程度。
(4)抗体生成细胞检测和血清溶血素测定
连续给予受试物30 d后,取第3大组的40只小鼠腹腔注射0.2 mL的2%压积SRBC悬液,4 d后所有小鼠从眼内眦静脉丛采集血液并离心血清备用(用于溶血素测定)。颈椎脱臼法处死小鼠,摘取脾,研磨脾,无菌细胞筛网过滤,用Hank’s液洗2次,每次离心10 min(1000 r/min),制成单个细胞悬液备用。将表层培养基加热溶解后与等量2倍浓度的Hank’s液混匀,按每管0.5 mL分装,再向管内加50μL的10%压积SRBC,25μL的脾细胞悬液,混匀后倒在已刷琼脂糖薄层的玻片上,5%CO2、37℃条件下培养1.5 h,然后加入补体,继续培养1.5 h后,计数溶血形成的空斑数。用缓冲液1∶200稀释已离心好的血清,常规方法测定SRBC半数溶血时的光密度值,酶标仪测定波长为540 nm。按公式:半数溶血值HC50=样品光密度值/SRBC半数溶血时的光密度值×稀释倍数,计算半数溶血值。
(5)小鼠碳廓清实验
连续给予受试物30 d后,取第4大组的40只小鼠尾静脉注入印度墨汁,2 min和10 min后取血,用0.1%Na2CO3溶液稀释100倍,于600 nm波长处测光密度值,取肝、脾、胸腺并称重,通过光密度值、肝、脾重量计算吞噬指数a。公式如下:

(6)小鼠腹腔巨噬细胞吞噬鸡红细胞实验
连续给予受试物30 d后,取第5大组的40只小鼠。处死动物前4 d给每只小鼠腹腔注射0.2 mL的2%压积SRBC,激活小鼠巨噬细胞。颈椎脱臼法处死小鼠,每只小鼠腹腔注射加4 mL含胎牛血清的Hank’s液,按揉腹部20次洗出腹腔巨噬细胞,吸取腹腔洗液0.5 mL与0.5 mL 1%鸡血红细胞悬液混匀。取0.5 mL混合液,加有玻片的琼脂圈内。放置孵箱内37℃孵育20 min。孵育结束用生理盐清洗,常规固定与Giemsa染色,镜检。按公式:吞噬百分率(%)=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞数×100,吞噬指数=被吞噬的鸡红细胞总数/计数的巨噬细胞数,计算数吞噬率和吞噬指数。
1.4 统计学方法
所有实验结果采用SPSS 22.0软件计算与分析,小鼠各周体重、免疫器官相对重量、淋巴细胞增殖能力、耳壳增重、溶血空斑数、血清半数溶血值等指标采用SPSS软件对各实验组原始数据进行方差齐性检验,符合方差齐的要求的数据资料用单因素方差分析方法中多个实验组与一个对照组间均数的两两比较方法进行统计处理;对方差不齐的数据采用秩和检验进行统计处理;对并将吞噬百分率和NK细胞活性需经sin-1P1/2(P表示为吞噬百分率或NK细胞活性,将百分率转化成小数表示)转化,符合方差齐的要求后进行统计处理。检验水准α=0.05,P<0.05具有统计学意义。
2 结果
2.1 功能成分含量测定
石斛人参蝙蝠蛾姜胶囊的功效成分人参皂甙、多糖和腺苷的含量测定结果见表2。

表2 石斛人参蝙蝠蛾姜胶囊功效成分测定结果Table 2 Determination results of effective components in Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule
2.2 小鼠调节免疫功能实验
2.2.1 石斛人参蝙蝠蛾姜胶囊对小鼠各周及终末体重和免疫器官相对重量的影响
石斛人参蝙蝠蛾姜胶囊各剂量组的小鼠各周及终末体重与阴性对照组比无显著差异;免疫器官相对重量与阴性对照组比无显著性差异(表3)。
表3 石斛人参蝙蝠蛾姜胶囊对小鼠胸腺和脾相对重量的影响(±s,n=10)Table 3 Effects of Dendrobium-ginseng-paecilomyces batmothginger Capsule on relative weight of thymus and spleen in mice
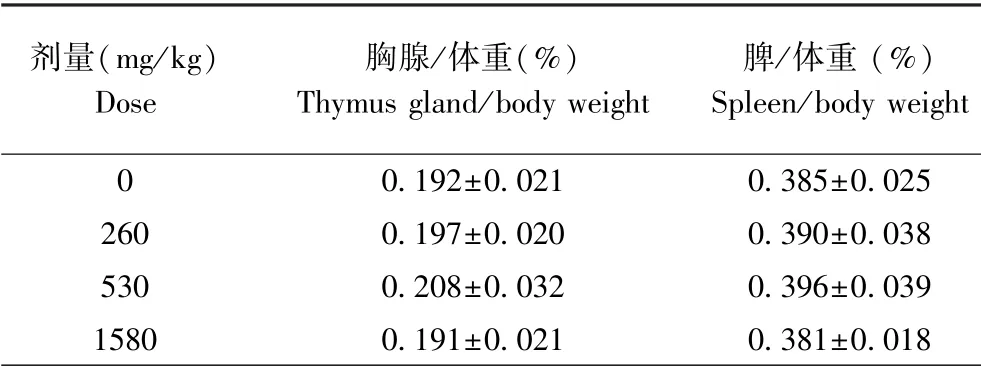
表3 石斛人参蝙蝠蛾姜胶囊对小鼠胸腺和脾相对重量的影响(±s,n=10)Table 3 Effects of Dendrobium-ginseng-paecilomyces batmothginger Capsule on relative weight of thymus and spleen in mice
剂量(mg/kg)Dose胸腺/体重(%)Thymus gland/body weight脾/体重(%)Spleen/body weight 00.192±0.0210.385±0.0252600.197±0.0200.390±0.0385300.208±0.0320.396±0.03915800.191±0.0210.381±0.018
2.2.2 石斛人参蝙蝠蛾姜胶囊对小鼠脾淋巴细胞增殖能力、右耳肿胀程度的影响
由表4结果可见,1580 mg/(kg·d)组中含有ConA小鼠脾淋巴细胞孔光密度值与无ConA孔的差值高于0 mg/(kg·d)组,比较有显著差异(P<0.05),显示石斛人参蝙蝠蛾姜胶囊对ConA诱导的脾淋巴细胞转化有增加作用,提高脾淋巴细胞增殖能力;1580 mg/(kg·d)组耳重差增重高于0 mg/(kg·d)组,比较有显著差异(P<0.05),显示石斛人参蝙蝠蛾姜胶囊对DNFB诱导小鼠耳肿胀程度明显增强,反映小鼠迟发型变态反应增强。脾淋巴细胞增殖能力增加和迟发型变态反应增强均反映石斛人参蝙蝠蛾姜胶囊对小鼠细胞免疫功能、特异性免疫功能有增强作用。
表4 石斛人参蝙蝠蛾姜胶囊对脾淋巴细胞增殖能力、右耳肿胀程度的影响(±s,n=10)Table 4 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on spleen lymphocyte proliferation and right ear swelling

表4 石斛人参蝙蝠蛾姜胶囊对脾淋巴细胞增殖能力、右耳肿胀程度的影响(±s,n=10)Table 4 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on spleen lymphocyte proliferation and right ear swelling
注:与对照组比较,*P<0.05。下同。Note.Compared with the control group,*P<0.05.The same as below.
剂量(mg/kg)Dose加ConA孔与不加ConA孔吸光度的差值Difference of absorbance between hole with and without ConA耳重差(mg)Ear weight difference 00.095±0.03910.9±1.72600.109±0.03111.6±3.25300.117±0.04113.0±2.215800.148±0.066* 13.7±1.3*
2.2.3 石斛人参蝙蝠蛾姜胶囊对小鼠抗体生成细胞水平和半数溶血值的影响
由表5结果可见,1580 mg/(kg·d)组小鼠溶血形成的空斑数高于0 mg/(kg·d)组,比较有显著差异(P<0.05),显示石斛人参蝙蝠蛾姜胶囊对促进小鼠抗体生成细胞水平升高。260 mg/(kg·d)、530 mg/(kg·d)、1580 mg/(kg·d)组小鼠HC50与0 mg/(kg·d)组比较无显著性差异(P<0.05)。虽然石斛人参蝙蝠蛾姜胶囊对HC50升高影响没有显著性差异,结合溶血空斑数的升高,表明石斛人参蝙蝠蛾姜胶囊可在一定程度上增强小鼠的体液免疫功能。
表5 石斛人参蝙蝠蛾姜胶囊对小鼠抗体生成细胞水平和半数溶血值的影响(±s,n=10)Table 5 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on antibody producing cells and half hemolytic value of mice

表5 石斛人参蝙蝠蛾姜胶囊对小鼠抗体生成细胞水平和半数溶血值的影响(±s,n=10)Table 5 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on antibody producing cells and half hemolytic value of mice
剂量(mg/kg)Dose溶血空斑数(103个/全脾细胞)Number of hemolytic plaque(103/whole spleen cells)HC50 011.8±1.678±1926012.9±1.578±2753013.7±2.777±15158014.8±2.2* 91±20
2.2.4 石斛人参蝙蝠蛾姜胶囊对小鼠单核/巨噬细胞吞噬能力的影响
由表6结果可见,1580 mg/(kg·d)组的吞噬指数a高于0 mg/(kg·d)组,比较有显著差异(P<0.05);1580 mg/(kg·d)组的吞噬百分率及吞噬指数均高于0 mg/(kg·d)组,比较有显著差异(P<0.05);吞噬指数a升高表明石斛人参蝙蝠蛾姜胶囊对小鼠单核细胞吞噬能力(即碳廓清的能力)有增强作用,吞噬百分率及吞噬指数的升高表明石斛人参蝙蝠蛾姜胶囊对增强小鼠巨噬细胞吞噬能力有增强作用,单核/巨噬细胞吞噬能力增强反映石斛人参蝙蝠蛾姜胶囊具有增强小鼠非特异性免疫功能。
表6 石斛人参蝙蝠蛾姜胶囊对小鼠单核-巨噬功能的影响(±s,n=10)Table 6 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on mononuclear andmegaphagocytic function in mice
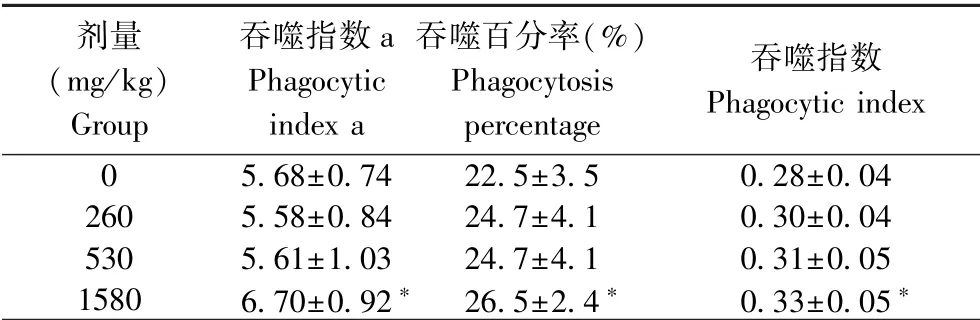
表6 石斛人参蝙蝠蛾姜胶囊对小鼠单核-巨噬功能的影响(±s,n=10)Table 6 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on mononuclear andmegaphagocytic function in mice
剂量(mg/kg)Group吞噬指数a Phagocytic index a吞噬百分率(%)Phagocytosis percentage吞噬指数Phagocytic index 05.68±0.7422.5±3.50.28±0.042605.58±0.8424.7±4.10.30±0.045305.61±1.0324.7±4.10.31±0.0515806.70±0.92* 26.5±2.4* 0.33±0.05*
2.2.5 石斛人参蝙蝠蛾姜胶囊对小鼠NK细胞活性的影响
由表7结果可见,260 mg/(kg·d)、530 mg/(kg·d)、1580 mg/(kg·d)组小鼠NK细胞活性与0 mg/(kg·d)组比较无显著性差异(P>0.05)。表明石斛人参蝙蝠蛾姜胶囊对NK细胞活性没有调节作用。
表7 石斛人参蝙蝠蛾姜胶囊对小鼠NK细胞活性的影响(±s,n=10)Table 7 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on NK cell activity in mice
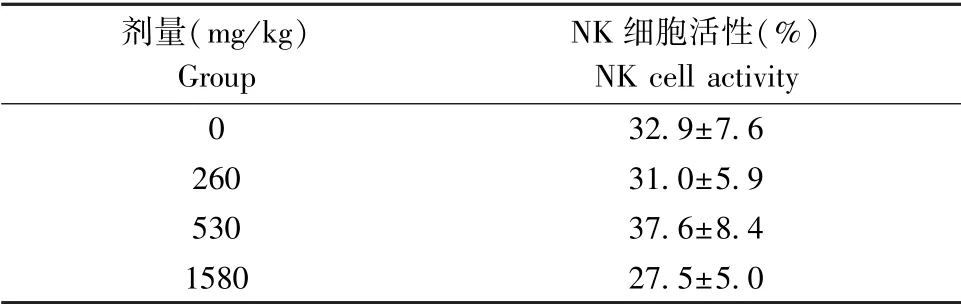
表7 石斛人参蝙蝠蛾姜胶囊对小鼠NK细胞活性的影响(±s,n=10)Table 7 Effects of Dendrobium-ginseng-paecilomyces batmoth-ginger Capsule on NK cell activity in mice
剂量(mg/kg)Group NK细胞活性(%)NK cell activity 032.9±7.626031.0±5.953037.6±8.4158027.5±5.0
3 讨论
雄性小鼠好动,群养时的好斗习性容易影响实验结果,本研究仅选用雌性小鼠,符合保健食品检验与评价技术规范(2003年版)单一性别的要求,同时也满足了3R原则。本实验观察石斛人参蝙蝠蛾姜胶囊对小鼠细胞免疫、体液免疫、单核-巨噬细胞功能三个方面均有明显作用。细胞免疫方面:石斛人参蝙蝠蛾姜胶囊1580 mg/kg组可增强脾淋巴细胞增殖能力和增强DNFB诱导小鼠迟发型变态反应,均提示其具有明显的细胞免疫的功能;单核-巨噬细胞功能方面:石斛人参蝙蝠蛾姜胶囊1580 mg/kg组小鼠碳廓清吞噬指数a、小鼠腔巨噬细胞吞噬鸡红细胞的吞噬百分率及吞噬指数均有显著性增加,提示其具有增强单核巨噬细胞的吞噬能力;而且细胞免疫、单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的重要标准,石斛人参蝙蝠蛾姜胶囊具有明显的增加机体非特异性免疫功能;体液免疫方面:石斛人参蝙蝠蛾姜胶囊1580 mg/kg组的小鼠组抗体生成细胞水平有明显提高,该胶囊可在一定程度上调节小鼠体液免疫功能,属于特异性免疫功能增强。
石斛人参蝙蝠蛾姜胶囊是铁皮石斛、人参提取物、蝙蝠蛾拟青霉菌粉、干姜提取物为主要原料所制成,调节免疫功能作用的功效成分主要为人参皂甙、多糖和腺苷,以上实验结果与文献报道一致,陈星星等[16]研究表明铁皮石斛能有效协同脂多糖(LPS)和刀豆蛋白(ConA)水平促进免疫制型小鼠脾T淋巴细胞、B淋巴细胞增殖;Liu等[17]对BALB/c小鼠口服不同剂量的铁皮石斛及其多糖对巨噬细胞的吞噬能力有显著增强;滕伟卓[3]研究表明蝙蝠蛾拟青霉菌粉可增强小鼠机体非特异性免疫功能和使迟发型超敏反应加剧,使淋巴细胞转化率增加;人参皂苷Rg1及其代谢产物可在体内直接激活T细胞增殖、抑制活化状态的T细胞,并提高巨噬细胞吞噬及释放NO的能力[18];王华庆等[19]研究发现人参皂苷Rg3不仅能明显促进淋巴细胞的增殖,还可以提高自然杀伤细胞活性和T细胞亚群的活性水平[16];人参多糖能够促进T、B淋巴细胞增殖,激活脾细胞[20];有研究表明人参多糖除了能促进淋巴细胞增殖速度还能增强巨噬细胞的吞噬能力[21];铁皮石斛、人参等复合配方产品的研究表明,其可提高机体的特异性和非特异性免疫功能[22-23]。
综上所述,石斛人参蝙蝠蛾姜胶囊具有免疫调节功能,主要功效与人参和铁皮石斛中的各种植物多糖、人参中皂甙、蝙蝠蛾拟青霉菌粉中腺苷有关。本次实验结果可为以后人参、铁皮石斛等中药材的开发和配方优化提供部分数据。
