miR-378a对高糖介导胰岛β细胞损伤的影响*
2021-08-20陈朝琴薛治乾李文霞
陈朝琴,薛治乾,李文霞△
(儋州市人民医院 1.内分泌科2.病理科,儋州 571700)
2 型糖尿病(type 2 diabetes,T2D)是一种常见的慢性代谢性疾病,随着人们生活方式的改变以及我国人口老龄化,T2D 的发病率逐年升高[1]。根据国际糖尿病联合会的统计,2011年全球糖尿病患者数量达到3.7 亿,到2030 年这一数字将接近5.5亿[2]。高血糖、胰岛素抵抗和β细胞功能受损构成了T2D 的病理基础。高血糖会导致β 细胞功能异常,引起胰岛素分泌受损和胰岛β 细胞凋亡增加等[3]。因此,糖毒性在T2DM 的发病机理中具有重要作用。微小RNA(MicroRNA,miRNA)是一种短的非编码调控RNA 分子,已成为基因调控的重要参与者,并且对糖尿病的治疗过程具有重大影响[4]。研究表明,miRNA 是脂质和葡萄糖代谢的关键调节剂,并且通过影响肝脏、脂肪组织和胰腺的状态和功能,在代谢疾病的发病机理中发挥关键作用[5-6]。此外,据报道,许多miRNA参与胰腺发育,并在胰岛素抵抗个体的胰岛素分泌和β细胞分化转录中起转录后调控作用[7-8]。因此,miRNA有望成为糖尿病的治疗新靶点。最近的研究认为,miR-378a是体内能量和葡萄糖稳态的重要调节剂,是改善代谢失调的潜在靶标[9]。但是,miR-378a 是否参与糖毒性诱导的胰岛β细胞损伤仍不清楚。本实验探讨miR-378a对高糖介导胰岛β 细胞损伤的影响,为T2D 临床防治和治疗提供新的实验依据。
1 材料与方法
1.1 细胞和主要试剂
大鼠胰岛β 细胞INS-1(美国ATCC);RPMI 1640 培养基、胎牛血清(美国Gibco);miR-378a inhibitors 及inhibitors control(上海吉玛生物);Lipofectamine 2000 脂质体转染试剂(美国Invitrogen);RNA 提取试剂盒、ECL 超敏化学发光试剂(赛默飞世尔);逆转录试剂盒、SYBR Green 实时荧光定量PCR 检测试剂盒(日本TOYOBO);MTT 试剂、DCFH-DA荧光探针、BCA蛋白浓度检测试剂盒(美国Sigma);LDH 和MDA 检测试剂盒(南京建成生物);AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒(日本TaKaRa);胰岛素检测试剂盒(上海纪宁生物);Cleaved Caspase 3 单抗(美国Abcam);HRP 标记的IgG(美国CST)。
1.2 细胞培养和分组
INS-1 细胞培养在含10%胎牛血清和1%双抗的RPMI 1640 培养基中,于37 ℃、5%CO2培养箱进行常规培养,每隔1 d 更换1 次新的培养液,取对数生长期的INS-1 细胞以不同的处理方式进行分组:Con组(采用完全培养基培养的INS-1细胞)、HG组(采用25 mmol/L 高糖培养基培养的INS-1 细胞)、HG+anti-miR-NC组(采用25 mmol/L高糖培养基培养的INS-1细胞+转染inhibitors control)和HG+antimiR-378a 组(采用25 mmol/L 高糖培养基培养的INS-1 细胞+转染miR-378a inhibitors)。采用Lipofectamine 2000脂质体转染试剂进行转染,具体步骤参照转染试剂使用说明操作,其中inhibitors control和miR-378a inhibitors 的转染浓度均为100 nmol/L。以上各组INS-1细胞处理后于37 ℃培养箱继续孵育,48 h 后分别收集各组INS-1 细胞及上清培养液进行相关指标的检测。
1.3 实时荧光定量PCR(qPCR)技术测定细胞中miR-378a的相对表达量
各组INS-1 细胞处理48 h 后,分别收集各组INS-1细胞,加入适量TRIzol试剂分别提取总RNA,取2 μL RNA 样品检测RNA 的纯度和浓度,合格的RNA 进行逆转录合成cDNA,获得的cDNA 为模板链,U6为内参,采用SYBR Green实时荧光定量PCR检测试剂盒进行扩增,检测miR-378a 的相对表达量。miR-378a 引物(上游5’-GGGCACTGGACTTGGAGTC-3’,下游5’-GTGCGTGTCGTGGAGTCG-3’);U6(上游5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游5’-CGCTTCACGAATTTGCGTGTCAT-3’)。扩增程序设为:94 ℃5 min,随后设40 个循环,每个循环94 ℃30 s、58 ℃30 s、72 ℃30 s。待反应结束后根据样本的Ct值,采用2-△△Ct法分析各组INS-1细胞中miR-378a的相对表达量。
1.4 MTT实验检测细胞活力
生长良好的INS-1 细胞以1×105个/mL 的密度接种于96孔板内,按照“1.2”项进行分组处理,同时设置调零孔,48 h后分别向每孔细胞中加入MTT溶液100 μL,37 ℃培养箱继续孵育4 h,取出细胞,去细胞培养液,再向细胞中加入150 μL 二甲基亚砜,于震荡仪上振荡10 min,待结晶沉淀全部溶解后,调整多功能酶标仪波长至450 nm,测定各组INS-1 细胞的吸光度值(A 值),将对照组INS-1 细胞活力记为100%,分别计算其余各组INS-1细胞的活力。
1.5 DCFH-DA荧光探针法检测ROS水平
INS-1 细胞接种到6 孔板中,按照“1.2”项的方法分组处理48 h 后,除去上清培养液,向细胞中加入含DCFH-DA 荧光探针的无血清培养液,于37 ℃培养箱避光培养30 min,期间轻柔晃动2次,取出细胞培养板,以PBS洗涤细胞,除去探针和培养液,加入适量PBS重悬细胞,使用流式细胞仪在激发波长488 nm,发射波长525 nm 处分析荧光强度,以荧光强度表示ROS水平。
1.6 LDH和MDA含量检测
INS-1 细胞分组处理48 h 后,分别收集细胞上清培养液,除去细胞碎片,使用LDH和MDA含量检测试剂盒分别测定上清液中LDH 和MDA 含量,具体步骤参考试剂盒使用说明。
1.7 ELISA实验检测细胞分泌胰岛素水平
INS-1细胞分组处理48 h后,收集细胞上清液,参照ELISA检测试剂盒说明书分析各组INS-1细胞分泌胰岛素水平,具体操作步骤严格参照胰岛素检测试剂盒说明书进行。
1.8 流式细胞术测定细胞凋亡情况
收集处理48 h后的4组INS-1细胞,PBS洗涤细胞3次,向细胞中加入适量结合缓冲液,制成浓度为1×106个/mL的细胞悬液,再加入AnnexinⅤ-FITC和PI 染液各5 μL,轻轻混匀,室温下避光染色15 min,加入结合缓冲液后立即用流式细胞仪检测细胞凋亡情况。
1.9 Western blotting 实验检测Cleaved Caspase 3蛋白表达
INS-1 细胞分组处理结束后,去上清培养液,PBS洗涤数次,加入适量细胞裂解液,冰上裂解细胞并提取总蛋白,使用BCA蛋白浓度检测试剂盒测定蛋白浓度,取30 μg 蛋白上样,配制10%的SDSPAGE 凝胶,电泳分离蛋白并电转至PVDF 膜上,在含5%脱脂奶粉封闭液中封阻2 h,洗膜后加入稀释的一抗(1∶800稀释),4 ℃过夜孵育,取出膜后洗膜,再加入1∶3 000稀释的二抗,室温反应2 h,洗膜后滴加ECL 化学发光试剂,显影、定影,曝光并采集图像,使用Image J 软件分析各组INS-1 细胞中Cleaved Caspase 3 蛋白相对表达水平,以Cleaved Caspase 3蛋白条带灰度值与GAPDH灰度值的比值表示。
1.10 统计学方法
采用SPSS 21.0 软件对实验数据进行统计分析,计量资料以均数±标准差()表示,多组间差异比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组INS-1细胞中miR-378a表达情况比较
与Con组相比,HG组INS-1细胞中miR-378a的表达量明显升高(P<0.05),细胞活力明显降低(P<0.05);与HG 组相比,HG+anti-miR-378a 组INS-1 细胞中miR-378a 的表达量明显降低(P<0.05),细胞活力明显升高(P<0.05),而HG+antimiR-NC组中miR-378a的表达量和细胞活力无显著改变(P>0.05),见表1。提示高糖刺激能够促进胰岛β 细胞中miR-378a 的表达,而转染miR-378a inhibitors 能够有效抑制高糖刺激的miR-378a 的表达升高,且高糖刺激能够抑制胰岛β细胞活力,而抑制miR-378a能够逆转高糖刺激引起的细胞活力降低。
表1 各组INS-1细胞miR-378a相对表达量和细胞活力比较 ,n=3
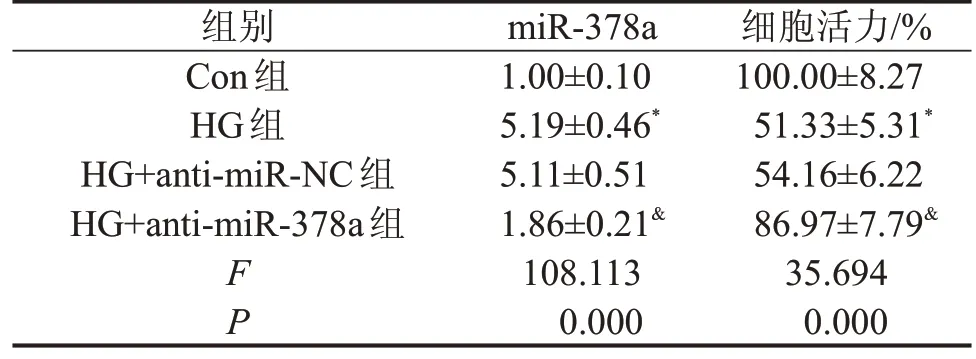
表1 各组INS-1细胞miR-378a相对表达量和细胞活力比较 ,n=3
与Con组比较,*P<0.05;与HG组比较,&P<0.05。
2.2 各组INS-1细胞氧化损伤情况比较
与Con组相比,HG组INS-1细胞内ROS水平明显升高,LDH 漏出量和上清液中MDA 含量明显增多(P<0.05);与HG 组相比,HG+anti-miR-378a 组INS-1 细胞内ROS 水平明显降低,LDH 漏出量和上清液中MDA 含量明显减少(P<0.05),而HG+antimiR-NC组ROS水平、LDH漏出量及上清液中MDA含量均无明显改变(P>0.05),见表2。提示高糖刺激能够引起胰岛β 细胞氧化损伤,而抑制miR-378a能够减轻高糖引起的胰岛β细胞的氧化损伤。
表2 各组INS-1细胞内ROS水平及上清液中LDH 和MDA的含量比较 ,n=3

表2 各组INS-1细胞内ROS水平及上清液中LDH 和MDA的含量比较 ,n=3
与Con组比较,*P<0.05;与HG组比较,&P<0.05。
2.3 各组INS-1细胞分泌胰岛素水平比较
与Con组相比,HG组INS-1细胞中胰岛素水平明显降低(P<0.05);与HG 组相比,HG+anti-miR-378a 组INS-1 细胞中胰岛素水平明显升高(P<0.05),而HG+anti-miR-NC 组中胰岛素水平无明显改变(P>0.05),见表3。提示高糖刺激能够抑制胰岛β细胞分泌胰岛素,而抑制miR-378a能够逆转高糖刺激对胰岛β细胞分泌胰岛素的抑制作用。
表3 各组INS-1细胞胰岛素水平比较 ,n=3

表3 各组INS-1细胞胰岛素水平比较 ,n=3
与Con组比较,*P<0.05;与HG组比较,&P<0.05。
2.4 各组INS-1细胞凋亡情况比较
与Con 组相比,HG 组INS-1细胞凋亡率和Cleaved Caspase 3 的表达水平均明显升高(P<0.05);与HG组相比,HG+anti-miR-378a组INS-1细胞凋亡率和Cleaved Caspase 3的表达水平均明显降低(P<0.05),而HG+anti-miR-NC 组细胞凋亡率和Cleaved Caspase 3 的表达水平均无明显改变(P>0.05),见图1和表4。表明高糖刺激能够促进胰岛β细胞凋亡,而抑制miR-378a能够逆转高糖刺激对胰岛β细胞凋亡促进作用。
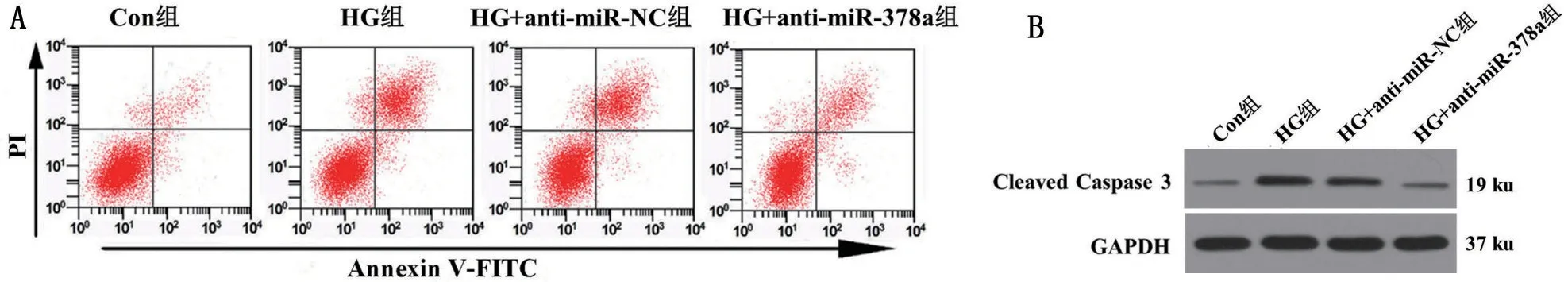
图1 miR-378a介导高糖刺激对胰岛β细胞凋亡的影响
表4 各组INS-1 细胞凋亡率和Cleaved Caspase 3 的表达水平比较 ,n=3

表4 各组INS-1 细胞凋亡率和Cleaved Caspase 3 的表达水平比较 ,n=3
与Con组比较,*P<0.05;与HG组比较,&P<0.05。
3 讨论
据估计,2015年全球有超过4.15亿人患有糖尿病,其发病率和死亡率不断增加[10]。所有糖尿病病例中约95%为T2D。T2D 是一种以胰岛素抵抗和胰岛β细胞功能缺陷为特征的代谢紊乱疾病[11]。实验报告称,β 细胞的损伤是糖尿病的重要病理基础。营养对于维持β细胞功能至关重要,但是,过多的营养素(例如葡萄糖)会诱导对β 细胞功能的损伤[12-13]。LDH含量的高低在一定程度上反应细胞膜的完整性,LDH漏出量越高表明细胞损伤程度越严重。氧化应激在糖尿病的发生和发展中起关键作用,它可以通过检测细胞内ROS的产生,MDA水平和SOD活性来评估。在本研究中,高浓度的葡萄糖培养液孵育胰岛β 细胞INS-1能够显著降低细胞活力,增加细胞凋亡率,提高细胞内ROS 水平,增加LDH 的漏出量及上清液中MDA 的含量,降低胰岛素分泌水平,提示高糖能够抑制胰岛β细胞活力,促进细胞凋亡,引起细胞氧化损伤并阻碍胰岛素的分泌。这些研究结果与以往研究相符,表明高糖刺激能够诱发胰岛β细胞发生损伤。
miRNA 是一组内源性非编码小RNA,长度在21至23个核苷酸之间,是转录后基因表达的关键调控因子。研究表明,miRNA 与T2D 的发病机理有关[14]。更重要的是,miRNA可通过影响胰腺调节脂质和葡萄糖代谢的状态和功能,在代谢疾病的发病机制中发挥关键作用[15-16]。在miRNA 中,据报道miR-378a 在调节葡萄糖代谢中发挥重要作用[17]。Sud等[19]在对高果糖饮食改变的miRNA进行了全面研究,发现包括miR-378a 在内的多种miRNA 在慢性代谢疾病发病机理中的重要性[18]。Mo 等[18]研究发现,降糖消渴颗粒治疗能够降低糖尿病小鼠胰腺组织中miR-378a 表达,进而发挥抗糖尿病的作用。最近的研究表明,miR-378a参与胰岛素抵抗的发病机理,对β细胞功能非常重要。但是,尚未完全了解miR-378a对高糖诱导的糖毒性的确切作用。因此,本实验检测了高糖刺激的胰岛β 细胞中miR-378a的表达,结果发现,高糖能够促进miR-378a的表达,提示miR-378a 可能参与高糖刺激对胰岛β 细胞的损伤。此外,本实验结果发现,抑制miR-378a 能够明显减少高糖诱导的INS-1 细胞凋亡,减轻氧化损伤,提高胰岛素分泌水平。表明miR-378a 可保护INS-1细胞免受高糖诱导的糖毒性。以往大量研究显示,miRNA通常是通过调控下游靶基因的表达从而发挥生物学功能,且已有多篇文献报道了miR-378a 在肿瘤、新陈代谢、线粒体和自噬中的生物学功能和作用机制[20-22]。miR-378a对高糖刺激的INS-1细胞的保护作用可能通过靶向下游基因或信号通路发挥作用,后续研究将对此进行探究。
综上,高糖刺激能够促进INS-1 细胞中miR-378a 的表达,抑制miR-378a 能够逆转高糖刺激对INS-1细胞的损伤,减轻氧化损伤和凋亡。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
