七氟烷逆转氧糖剥夺—复糖复氧诱导的小胶质细胞炎性反应*
2021-08-20侯俊德陈永学
赵 璐,侯俊德,陈永学
(邯郸市中心医院麻醉科,邯郸 056018)
创伤性脑损伤等中枢神经系统疾病的发展和转归中的炎症反应有重要作用,由小胶质细胞介导免疫反应能够促进病原体清除及组织修复再生,但炎症反应可加剧对神经元的损伤[1-3]。因此,临床中应积极寻求有效干预措施,以抑制小胶质细胞的活化,以减轻脑损伤后神经元损伤及促进中枢神经系统损伤修复[4]。七氟烷为临床常用麻醉药物,且在儿童全麻诱导及维持中疗效良好,研究发现,给予氧糖剥夺的神经元七氟烷干预,可促进HO-1-mRNA的表达,降低Fas蛋白的表达,降低人神经元的凋亡率,增加存活率[5-6]。但目前尚未明确其具体作用机制。NF-κB 存在于几乎所有动物细胞类型中,并参与细胞对刺激的反应,且可调节感染的免疫应答过程,而NF-κB 信号通路在经典通路、旁路通路和非典型通路中均被激活,具有重要的调节作用,而小胶质细胞被认为是存在于脑内的巨噬细胞,可表达NF-κB[7-9],推测七氟烷或可降低小胶质细胞诱导的炎性反应且其机制可能与NF-κB 信号通路有关。为此,本研究探讨七氟烷处理对氧糖剥夺—复糖复氧(OGD/R)N9 细胞的影响,以期为临床治疗提供参考。
1 材料与方法
1.1 主要材料及仪器
七氟烷(丸石制药株式会社,进口药物注册证号:H20090714)。胎牛血清(FBS)和DMEM(美国Gibco 公司);细胞培养板(德国Corning 公司);MTT(美国Sigma 公司);乳酸脱氢酶(LDH)试剂盒(南京建成生物有限公司);ELISA 试剂盒(上海康成生物有限公司);二甲基亚砜(上海凌峰化学试剂有限公司);NO 测定试剂盒(南京建成生物工程研究所);兔抗NF-κB(稀释比例1∶800)(美国SAB 公司);蛋白提取试剂盒(南京凯基生物有限公司);大鼠抗CD11b(稀释比例1∶200)(美国Abcam 公司);蛋白定量试剂盒(上海碧云天生物研究所)。电转系统C(美国miniprotein-Ⅲwet transfer unit,Bio-Rad 公司);PVDF 膜(美国Millipore 公司);ECL(美国Thermo Scientific 公司)。本研究经本院医学伦理委员会审核通过。
1.2 细胞培养与分组
N9 细胞来源于小鼠,其细胞结构、功能及形态与小胶质细胞类似,细胞培养于含10% FBS 的DMEM 完全培养基中,培养环境37 ℃、5%CO2。随机分为对照组、七氟烷+对照组、OGD/R组、七氟烷+OGD/R 组。其中对照组不做任何处理;七氟烷+对照组给予七氟烷处理30 min;OGD/R组给予行氧糖剥夺4h,复糖复氧24 h;七氟烷+OGD/R组在OGD/R组的基础上给予七氟烷处理30 min。
1.3 构建OGD/R模型
将正常细胞培养液替换为无糖DMEM 培养基,于37 ℃,5%CO2和95%N2混合气体的培养箱内氧糖剥夺4 h,换为正常细胞培养液后再培养24 h。将细胞培养瓶置于密闭容器内,通过七氟烷挥发罐将不同浓度的(0、0.5%、1.0%、1.5%)七氟烷和含有95%N2及5%CO2的混合气体连续吹入进气口,并在出气口处连接呼吸末气体检测仪,置于37 ℃恒温孵箱内孵育120 min。孵育结束后弃去旧培养基,加入含10%FBS的DMEM培养液洗脱30 min。
1.4 LDH活性检测
各组细胞随机取5 孔,细胞浓度稀释为1×105/mL,接种于24 孔板内,氧糖剥夺4 h,每孔吸取50 μL 培养基,加入适量LDH 测定试剂,于37 ℃下孵育30 min,采用分光光度计于490 nm 处检测OD值,以反映LDH含量。
1.5 MTT活性检测
将各组细胞稀释为5×104个/mL后接种于96孔板内,培养细胞直至其贴壁位置,在各细胞孔内加入20 μL MTT 溶液(5 mg/L),置于37℃培养箱培养4 h,弃上清液在每孔内均加入150 μL DMEM,振荡并反应10 min后,采用分光光度计于490 nm处检测OD值。
1.6 TNF-α、IL-1β及NO 含量检测
收集各组细胞,严格按照ELISA 试剂盒操作说明书进行操作。每组随机取5 孔细胞,浓度为1×105/mL,接种于24 孔板,氧糖剥夺4 h,每孔加入500 μL 培养液,复糖复氧24 h,吸取等体积培养液,加入相应抗体包被过的96 孔板,孵育30 min采用分光光度计于490 nm 处检测OD 值,NO 的含量检测则用分光光度计于550 nm处检测OD 值,以间接计算NO含量。
1.7 免疫荧光化学法检测CD11b表达水平
收集各组细胞弃除细胞培养基,用预冷的0.01 mol/L PBS(pH 7.4)缓冲液洗涤细胞3 次。用4%多聚甲醛室温固定细胞10 min,再用0.01 mol/L PBS缓冲液洗涤1次。分别加入一抗(大鼠抗CD11b,稀释比例1∶200),4 ℃过夜。0.01 mol/L PBS 缓冲液洗涤1次,加入二抗(稀释比例1∶5 000)并在37 ℃下孵育1 h,0.01 mol/L PBS 缓冲液洗涤细胞1次,加入终浓度为1 μg/mL 的荧光染料室温孵育5 min。
1.8 NF-κB 蛋白的表达水平检测
收集各组细胞弃上清液,加入裂解液并将细胞刮下,采用BCA 法测定细胞总蛋白含量。沸水煮5 min 使蛋白预变性。取30 μg 蛋白样品,12%SDS-PAGE 胶电泳分离,利用电转系统C 转至PVDF 膜,10%脱脂奶粉-TBST(pH 7.5,10 mmol/L Tris-HCI,150 mmol/LnaCl,0.1%Tween-20)室温封闭1 h,加入一抗(稀释比例1∶200),4 ℃过夜。TBST 洗涤3次,加入二抗(稀释比例1∶10 000)并在室温孵育1 h。ECL发光底物染1 min。Omega 16IC全自动化学发光凝胶成像系统显影分析。
1.9 统计学方法
采用Graphpad Prism 8.0 软件进行作图及统计分析。计量数据用均数±标准差()表示,服从正态分布和方差齐性的数据采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 N9细胞的活性
七氟烷浓度为0时,N9细胞经OGD/R后,MTT活性无改变(P>0.05),但LDH 活性增加(P=0.023);对照组N9 细胞给予不同浓度的七氟烷(0.5%、1.0%和1.5%)后,LDH、细胞的活性均未改变(P>0.05);OGD/R 组N9 细胞给予不同浓度的七氟烷后,随着浓度的增加细胞活性明显增加(P<0.05),但LDH 活性明显降低(P<0.05),当七氟烷浓度为1.5%时,效果最为明显,见图1。
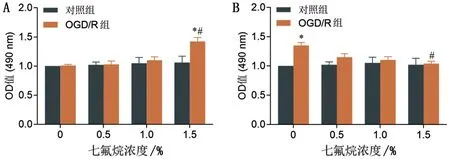
图1 七氟烷逆转OGD/R诱导的小胶质细胞活力的降低
2.2 ELISA 实验检测炎症因子TNF-α、IL-1β及NO的含量
N9 细胞经OGD/R 后,炎症因子TNF-α、IL-1β及NO 的含量均较对照组升高(均P<0.05);给予1.5%的七氟烷后,对照组N9细胞的TNF-α、IL-1β及NO 的含量均无明显变化(均P>0.05),但OGD/R组N9 细胞的TNF-α、IL-1β 及NO 的含量明显降低(均P<0.05),见图2。

图2 七氟烷降低OGD/R诱导的小胶质细胞TNF-α、IL-1β及NO的含量
2.3 免疫荧光化学法检测CD11b表达水平
正常状态下,CD11b 表达在N9 细胞胞膜与细胞质中(图3A)。N9细胞OGD/R后,CD11b 表达水平较对照组N9 细胞升高(P<0.05);给予1.5%的七氟烷后,对照组N9 细胞的CD11b 表达水平无明显变化(P>0.05),但OGD/R组N9细胞的CD11b 表达水平明显降低(P<0.05,图3B)。
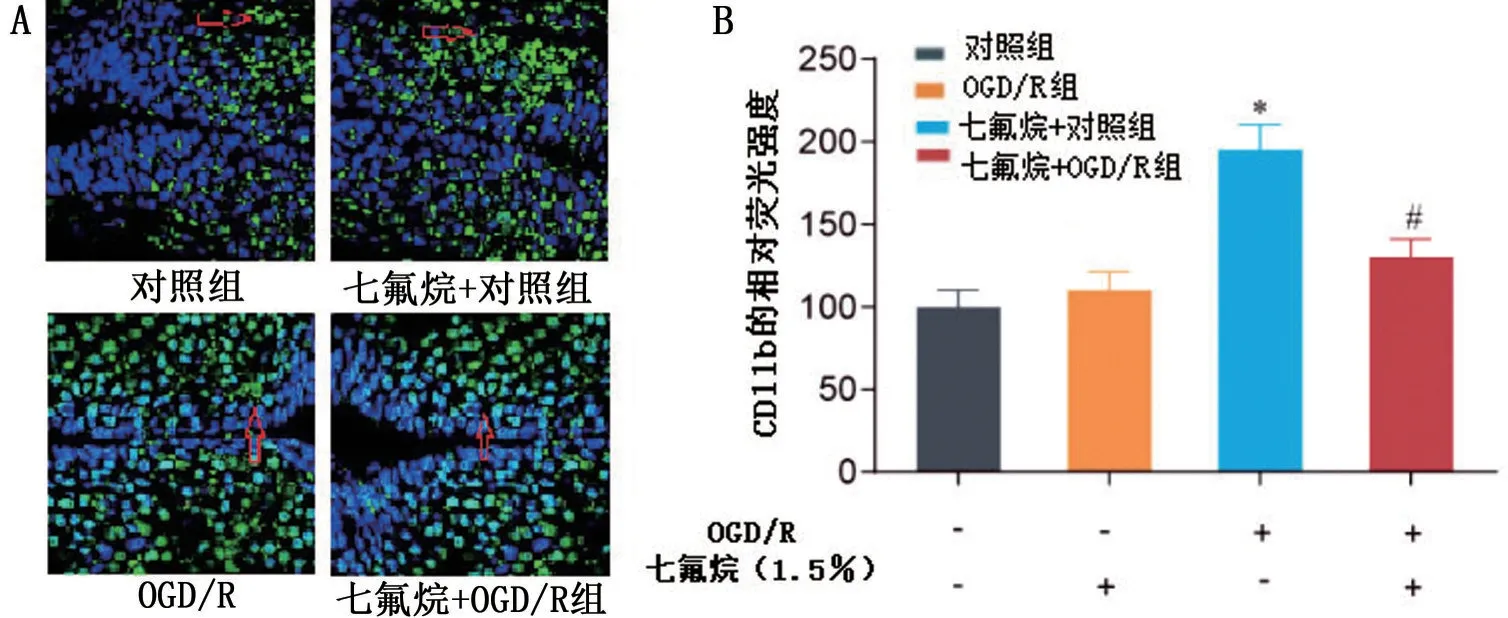
图3 七氟烷抑制OGD/R 诱导的小胶质细胞表面分子CD11b 的表达
2.4 Western blot 实验检测NF-κB 蛋白表达水平
N9 细胞OGD/R 后,细胞核内NF-κB 蛋白表达水平较对照组N9 细胞升高(P<0.05);给予1.5%的七氟烷后,对照组N9 细胞的NF-κB 蛋白表达水平无明显变化(P>0.05),但OGD/R 组N9 细胞的NFκB 蛋白表达水平明显降低(P<0.05),见图4。
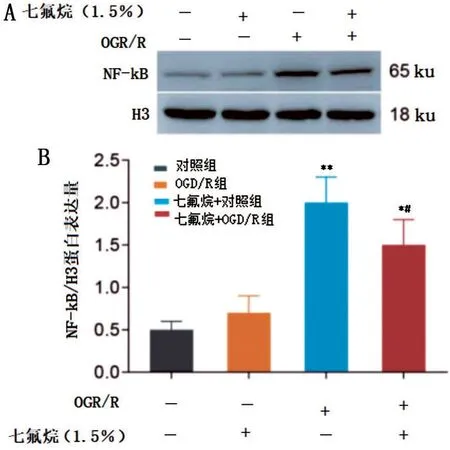
图4 七氟烷抑制OGD/R诱导的小胶质细胞NF-κB 蛋白的表达
3 讨论
脑缺血再灌注损伤和修复过程中炎性反应均有重要作用,依据炎性反应的程度和反应时间的不同,可对神经元产生保护或者损伤的效果[10]。发生缺血性卒中后小胶质细胞可在短时间内激活,并释放TNF-α、IL-β、NO等炎性因子,并诱导细胞黏附分子表达,诱导大量白细胞聚集并穿过血管壁,浸润脑组织,进一步加重神经元损伤[11-12]。本研究中,与正常N9细胞比较,OGD/R组细胞炎症因子TNF-α、IL-1β 及NO 的含量升高。分析其原因,细胞因OGD/R后受到刺激导致氧化和抗氧化能力失衡,引起大量TNF-α、IL-β、NO 等炎性因子的释放,导致OGD/R组细胞炎症因子的含量显著上升[13-14]。CD11b是小胶质细胞的标志物,小胶质细胞活化时,CD11b 表达上调,当细胞过度激活出现凋亡时CD11b 表达下降[15]。本研究亦发现,N9 细胞OGD/R后,CD11b 表达水平较正常N9细胞升高,提示N9细胞氧糖剥夺—复糖复氧模型制备成功,可用于后续实验。
有研究发现,使用2%七氟烷预处理2 h 后洗脱30 min能够减少随后缺氧和血清剥夺诱导的骨髓间充质干细胞(MSCs)凋亡,且不会增加正常培养MSCs 的凋亡[16]。亦有学者提出,高于2.3%的七氟烷孵育4 h可诱发细胞死亡或形态学的变化[17-18],说明七氟烷浓度<2.3%时安全有效。进一步研究结果显示,尽管OGD/R 组N9 细胞随着七氟烷处理浓度的增加细胞活性也不断增加,但LDH活性明显降低,而当七氟烷浓度为1.5%时,效果最为明显,因此考虑选择浓度为1.5%的七氟烷进行后续实验。
NF-κB 广泛存在于真核细胞内,且在多种基因转录调控中均有重要作用,参与多种病理生理过程[19-20]。NF-κB不仅表达于神经元内,亦可表达于血管内皮细胞及胶质细胞中,当发生脑缺血再灌注损伤后,NF-κB的转录活性增强[21-22]。激活NF-kB能够降低氧化应激反应及兴奋性毒性所造成的神经元损伤,当敲除NF-κB 基因后,脑缺血再灌注损伤程度加重[23-24]。本研究发现,七氟烷预处理的OGD/R N9 细胞的培养液中胞核NF-κB 蛋白表达水平降低。提示七氟烷处理的OGD/R N9细胞损伤缓解可能与NF-κB信号通路的活性抑制有关,担尚需更多的实验研究证实。由于NF-κB 涉及到多种基因的表达,其能够受限识别TNF-α 等基因的启动因子,并与启动序列中的共同序列相结合以使各炎性因子水平升高[25-26]。因此,本实验结果进一步说明七氟烷使各炎性因子水平降低,缓解神经炎性反应,其机制可能与NF-κB信号通路有关,但是否通过抑制NF-κB 信号通路进而降炎性因子的水平仍有待下一步验证。
综上所述,七氟烷可降低OGD/R诱导的小胶质细胞炎性反应,其机制可能与抑制NF-κB信号通路有关。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
