中性粒细胞型哮喘患儿急性发作期血清颗粒蛋白前体与疾病严重程度及气道炎症的关系>
2021-08-20雷芳龚霞
雷芳,龚霞>
(重庆市大足区人民医院 儿科,重庆 402360)
哮喘是一种发病机制复杂、涉及多种细胞及细胞组分的慢性气道异质性炎症性疾病。根据痰嗜酸粒细胞(EOS)和中性粒细胞(NEU)的比例,哮喘可分为4种炎症亚型,其中中性粒细胞型哮喘(neutrophilic asthma,NA)在儿童群体中,尤其是严重哮喘表型中十分常见[1- 2]。气道NEU与哮喘恶化、气流受限及类固醇抵抗有关,因此与EOS型哮喘相比,NA患儿肺功能下降更严重、急性发作次数更多,且哮喘标准治疗对NA的治疗效果差强人意[3]。近几年,众多研究集中在研究哮喘不同表型的病理生理学机制方面,试图确定其潜在的治疗靶标。生物标志物是一些生物状态或微环境的定性或定量指标,与疾病的发生、严重程度、病理生理学进展以及治疗反应性或预后有关。血清颗粒蛋白前体(progranulin,PGRN)是一种具有抗炎和免疫调节活性的多效性糖基化蛋白原。最近,Horinokita等[4]发现NEU弹性蛋白酶可以切割PGRN,进而释放颗粒蛋白;此外PGRN可抑制NEU脱颗粒和阻断肿瘤坏死因子- α(tumor necrosis factor α,TNF- α)信号的传递,而TNF- α信号通路激活被认为是参与气道NEU性气道炎症和气道高反应性的重要分子机制[5]。然而,PGRN水平是否可作为一个新的反映哮喘严重程度的血清学指标尚不清楚,故而本研究对血清PGRN水平与NA患儿气道炎症的关系,以及其对NA患儿急性发作的辅助诊断价值和临床意义进行了探讨。
1 资料与方法
1.1 一般资料
在这项观察性队列研究中,185例年龄在6~14岁之间的哮喘患儿被纳入研究,处于哮喘急性发作期的患儿115例(急性组),其中男67例,女48例,平均年龄(9.63±2.48)岁;处于临床缓解期的患儿70例(缓解组),其中男44例,女26例,平均年龄(9.30±2.87)岁。所有参与者均来自于2019年1月至10月期间在我院儿科就诊的患儿。纳入标准:(1) 年龄在6~14岁之间,符合中华医学会儿科学分会呼吸学组《儿童支气管哮喘诊断与防治指南(2016年版)》[6]诊断标准;(2) 急性组患儿首次发病,具有典型的临床症状及体征(排除其他疾病因素),且发病至血样采集时间≤48 h;经运动激发试验或支气管激发试验阳性,结合CT检查和实验室检查结果等明确哮喘诊断;(3) 临床缓解期患儿哮喘症状体征消失,第1秒用力呼气容积(forced expiratory volume in one second,FEV1),或者最大呼气峰值流速(peak expiratory flow,PEF)≥80%预计值,且维持3个月及以上。排除标准:(1) 近1个月内接受激素或免疫抑制剂治疗者;(2) 合并过敏性鼻炎、结核感染、肺炎、肺功能不全或其他器官严重感染者。另外选取30例健康儿童作为对照组,其中男16例,女14例,年龄6~14岁,平均年龄(9.93±2.78)岁,体格检查和肺功能检查正常,排除任何感染性疾病、哮喘病史、过敏病史、免疫系统疾病等以及近1个月内接受激素或免疫抑制剂治疗者。急性组、缓解组和对照组年龄、性别构成因素一致,差异无统计学意义(P>0.05),具有可比性。本研究方案获得我院医学伦理委员会批准和法定监护人的知情同意。
1.2 方法
1.2.1 痰诱导检测 急性组及缓解组患儿参照欧洲呼吸协会诱导痰液指导小组制订的指南,痰液诱导前吸入400 μg沙丁胺醇10~15 min;生理盐水漱口后用3%高渗盐水超声雾化吸入,嘱患儿主动咳痰。将3 ml痰液置于无菌试管中,加入4倍体积的0.1%二硫苏糖醇(dithiothreitol),在37 ℃水浴中孵育15 min,用离心机3 500 r·min-1离心10 min。沉淀物进行涂片并对细胞分类计数。镜检视野中鳞状上皮细胞/有核细胞<20%痰涂片可用。根据痰液NEU是否≥61%以及EOS是否≥3%,将患儿分为NEU型(EOS<3%,NEU≥61%)、EOS型(EOS≥3%,NEU<61%)、混合型(EOS≥3%,NEU≥61%)和寡细胞型(EOS<3%,NEU<61%)。
1.2.2 肺功能检查和病情严重程度分级[7]所有患儿在痰诱导前采用AS- 507肺功能检查仪(日本美能公司)检测用力肺活量(forced vital capacity,FVC)、FEV1,计算FEV1占预计值的百分比(FEV1% pred)和FEV1/FVC,另外测定PEF。根据肺功能检查,将患儿分为轻度、中度和重度组。
1.2.3 血清PGRN、炎症因子测定 所有患儿分别采取外周静脉血3、5 ml,将5 ml静脉血3 000 r·min-1离心10 min,取上清液置于-80 ℃储存待测,采用酶联免疫吸附法(enzyme- linked immunosorbent assay,ELISA)测定血清PGRN、TNF- α、白细胞介素(interleukin,IL)- 8水平,试剂盒购自美国R&D公司;3 ml静脉血采用SF- 3000型自动全血分析仪(日本SYSmex公司)检测全血NEU。
1.3 统计学处理
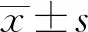
2 结 果
2.1 3组患儿血清PGRN水平比较
急性组、缓解组、对照组患儿血清PGRN水平分别为(26.29±10.62)、(38.95±5.73)、(45.37±3.17)ng·ml-1,急性组和缓解组患儿血清PGRN水平低于对照组,尤其是急性组患儿血清PGRN水平降低更明显,差异有统计学意义(F=84.205,P<0.001)。
2.2 两组哮喘患儿气道炎症分型以及血清PGRN水平比较
对于缓解组患儿,比较4个亚型血清PGRN水平,差异无统计学意义(F=0.177,P=0.912)。但是对于急性组患儿,NEU型和混合型哮喘患儿血清PGRN水平低于EOS型和寡细胞型哮喘患儿,差异有统计学意义(F=69.148,P<0.001),但是NEU型与混合型哮喘患儿血清PGRN水平差异无统计学意义(q=0.194,P>0.05)。见表1。
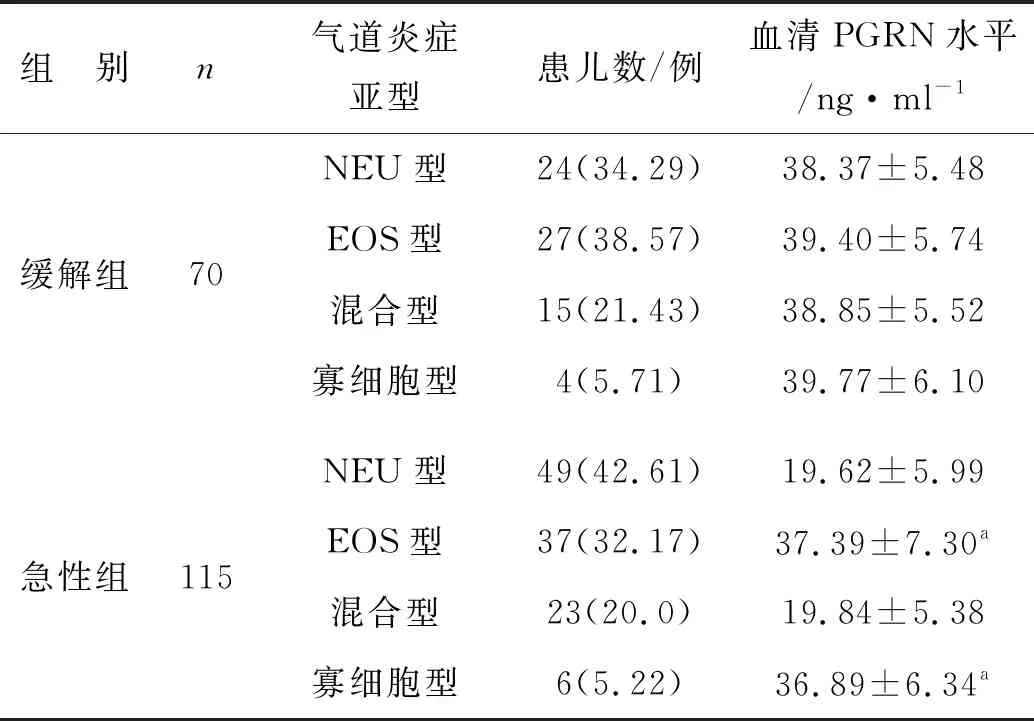
表1 两组哮喘患儿气道炎症亚型分布和血清PGRN水平比较
2.3 NA急性发作期患儿血清PGRN水平与肺功能的关系
NA急性发作期患儿随着疾病严重程度的加重,各项肺功能指标(FEV1%pred、FEV1/FVC、PEF)和血清PGRN水平逐渐降低,差异有统计学意义(P<0.05),见表2。另外经Pearson相关性分析显示,NA急性发作期患儿血清PGRN水平与FEV1%pred、FEV1/FVC、PEF均呈正相关,r=0.756、0.703、0.411,P<0.001,见图1。
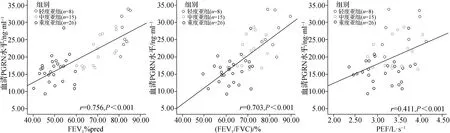
图1 NA患儿急性发作期时血清PGRN水平与肺功能指标的关系
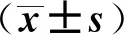
表2 NA急性发作期患儿不同疾病严重程度血清PGRN水平和肺功能指标的差异
2.4 单因素和多因素分析影响NA急性发作期患儿疾病严重程度的危险因素
经单因素分析显示,血清PGRN水平每升高1 ng·ml-1时NA急性发作期患儿进展至重度的危险率为0.877(95%CI:0.841~0.930,P<0.001)。进一步校正年龄、性别、肥胖、痰液NEU和EOS百分比后,血清PGRN水平升高仍是NA急性发作期患儿重度疾病的独立保护因素(OR=0.886,95%CI:0.847~0.958,P<0.001)。见表3。
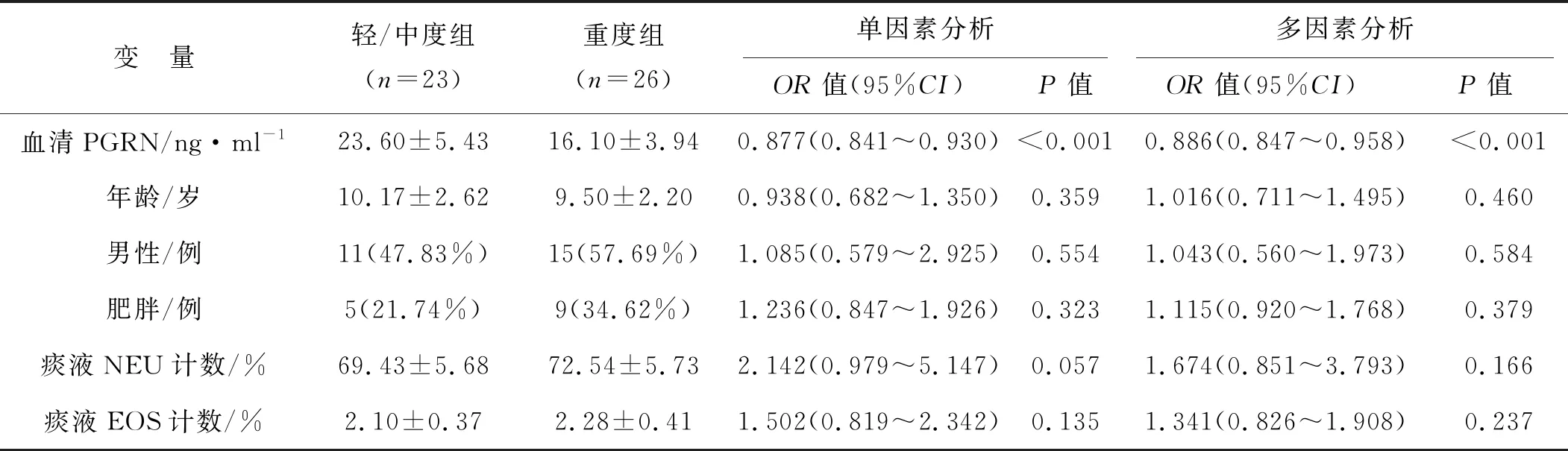
表3 单因素和和多因素分析影响NA急性发作期患儿疾病严重程度的危险因素
2.5 血清PGRN水平对重度NA急性发作期患儿的诊断价值
经ROC曲线分析显示,血清PGRN水平诊断NA急性发作期患儿重度疾病的AUC为0.876(95%CI:0.781~0.972),cut- off值为19.51 ng·ml-1,在该阈值下灵敏度和特异度分别为73.90%和88.50%,约登指数为0.624,见图2。

图2 血清PGRN水平对NA急性发作期患儿重度疾病的诊断ROC曲线
2.6 NA急性发作期患儿血清PGRN水平与气道炎症的关系
经Pearson相关性分析显示,NA急性发作期患儿血清PGRN水平与血清TNF- α水平、IL- 8水平、全血NEU计数均呈负相关,r=-0.537,-0.541,-0.413,P<0.001,见图3。
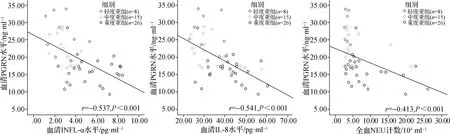
图3 血清PGRN水平与血清TNF- α水平、IL- 8水平、全血NEU计数的Pearson相关性
3 讨 论
本研究中我们评估了血清PGRN水平在不同气道炎症亚型的哮喘患儿急性发作期、临床缓解期表达水平的变化,对于以NEU气道浸润为主的哮喘患儿,急性发作期时血清PGRN水平显著低于临床缓解期;而对于以EOS增多为主的哮喘患儿,血清PGRN在急性发作期和临床缓解期的表达水平变化并不明显。说明血清PGRN水平降低与NEU增多之间存在一定的联系,而且对于NA患儿在急性发作期时,随着疾病严重程度的加重血清PGRN水平逐渐降低,并且与主要肺功能指标(FEV1%pred、FEV1/FVC、PEF)呈正相关,说明PGRN参与了NA的发生和进展过程。另外TNF- α和IL- 8是调节气道炎症反应的重要细胞因子,血清PGRN水平与TNF- α水平、IL- 8水平、全血NEU计数呈负相关,说明PGRN与NEU性气道炎症有关,这可能是诱发严重NA的重要原因。
哮喘是一种以慢性气道炎症和气道高反应性为特征的异质性疾病,这种异质性反映在病理学、临床进展过程和对标准治疗反应性的差异。了解造成异质性的分子机制可为患者的个体化治疗提供一定的理论基础,例如,抗白细胞介素- 5和抗IgE分别用于治疗EOS炎症和2型辅助性T细胞(type 2 T- helper cell)升高为主的重症哮喘患者。但是目前针对NEU气道炎症优势浸润的哮喘尚无有效的治疗策略,这与对这些患者哮喘发病机制认识不足有关。虽然NEU表型可见于大多数哮喘患儿,但从比例上分析,在严重哮喘表型中更为常见,这可能是因为NEU性气道炎症与气道微生物菌群组成、哮喘恶化、空气受限和类固醇抵抗等因素有关[8- 9]。Grunwell等[10]认为NA患儿气道NEU机能障碍,使促炎症介质和颗粒释放更多,导致平滑肌收缩、黏膜水肿、呼吸道上皮结构损坏及呼吸道重构,引发支气管狭窄、肺功能下降。除此以外,在本研究中我们发现血清PGRN水平降低也是NA患儿急性发作期肺功能降低和气道炎症反应加重的重要原因之一。
PGRN是一种分泌型、多功能糖蛋白,在支气管上皮细胞中呈高表达,属于一类强有力的抗炎分子,其抗炎作用是通过抑制NEU脱颗粒进而激活TNF- α相关炎症信号通路而实现的[11]。PGRN可被多种基质金属蛋白酶类、NEU弹性蛋白酶等降解,形成颗粒蛋白发挥促炎作用,并中和PGRN的抗炎作用[12]。例如,颗粒蛋白B可刺激气道上皮细胞中IL- 8的表达,诱导NEU吞噬和杀菌性能增加[13]。目前为止,已知有20多种蛋白可与PGRN结合,尤其是富含半胱氨酸的肿瘤坏死因子受体1/2(tumor necrosis factor receptor,TNFR1/2),Tang等[14- 15]证实,PGRN与TNFR1和TNFR2的结合能力基本一致,但是都远远高于TNF- α。哮喘的特征之一是支气管高反应性,即由各种特异性和非特异性刺激引起的过度支气管痉挛。这种反应在健康人群中是不会发生的,但是这种现象的病理机制尚不完全清楚。众所周知,不同的哮喘表型其气道反应性也有所差异,这强调了气道上皮细胞的重要性。上皮细胞分泌炎症细胞因子以及支气管收缩/扩张因子,如IL- 6、IL- 8、TNF- α等通过直接改变气道平滑肌的特性而参与气道高反应性的发生。对于严重的EOS型哮喘,2型免疫细胞因子(如IL- 4、IL- 5和IL- 13)的过度产生被认为是关键的病理机制。阻断这些分子或其受体的生物制剂的开发,以及证实其有效性和安全性的临床试验正在不断进行。因此,PGRN/TNF- α信号通路有望成为一种新的抑制NEU型气道高反应性的潜在机制。
为了支持上述推断,在本研究中我们通过单因素和多因素Logistic回归分析证实,血清PGRN水平降低是NA急性发作期患儿哮喘加重的独立危险因素,并且低水平的血清PGRN可作为重度NA的诊断指标,而且作为NEU相关抗炎因子,血清PGRN水平降低也反映了NEU性气道炎症状态。例如,Chen等[16]使用人痰标本评估了PGRN可能对慢性阻塞性肺疾病的影响,发现痰PGRN水平与NEU弹性蛋白酶和蛋白酶3等NEU炎症标志物呈负相关,而且血清PGRN水平降低可作为慢性阻塞性肺疾病急性加重的一个独立预测因素。虽然PGRN在NEU气道炎症发生发展中的确切作用机制尚不清楚,但我们的试验结果证实了血清PGRN水平降低与气流受限引起的重度NA有关,同时血清TNF- α、IL- 8水平降低且全血NEU计数增高。而且我们校正一些重度哮喘的高危因素后,血清PGRN仍然是NA急性发作期患儿哮喘加重的独立影响因素。严重哮喘对于哮喘的治愈是个非常重要的障碍,其肺功能降低、气流受限程度加重以及小气道重构等都增加了临床治疗的困难。在本研究中我们只是初步鉴定了PGRN可能是重度NEU型急性发作期哮喘的生物学标志物之一,未来还需要加深对PGRN分子机制的研究,并结合已知的细胞因子和趋化因子等进一步确认PGRN在NEU性气道炎症调节中的作用。
综上所述,NA患儿急性发作期血清PGRN水平较临床缓解期有所降低,而且与严重哮喘和NEU型气道炎症有关。因此检测血清PGRN水平可以反映NA患儿急性发作期的疾病严重程度,其有望成为一种新的抑制NEU型气道高反应性的潜在靶点。
