长链非编码RNA-EPIC1在前列腺癌中的表达及其临床意义
2021-08-19唐智国
唐智国 魏 灿 邰 胜
前列腺癌(prostate cancer, PCa)是严重威胁老年男性健康的恶性肿瘤,在欧美发达国家是男性发病率第一的恶性肿瘤。近年来,随着我国民众饮食结构的变化,PCa的发病率也迅速升高,已成为我国最常见的恶性肿瘤之一。长链非编码RNA(long non-coding RNA, LncRNA)是一类无蛋白质转录功能的RNA,广泛存在于人体组织中,参与调控细胞生长分化、恶性转变等多种生理病理过程,作用机制复杂。现已证实LncRNA在PCa的发生和发展中起到重要作用。表观遗传诱导LncRNA-1(Epigenetically-induced lncRNA1,EPIC1)是新近发现的一种LncRNA,在肺癌、胆管癌的进展中起到重要作用。本文研究了EPIC1在PCa细胞系和病理组织中的表达情况,探讨了EPIC1与PCa预后的关系,现报道如下。
1 资料与方法
1.1 一般资料 收集2017年3月至2020年1月在合肥市第八人民医院、合肥市第二人民医院及安徽医科大学第一附属医院诊断为PCa并手术切除的10例病理标本,取新鲜肿瘤组织及癌旁正常组织(距肿瘤边缘>3 cm并经病理检查确认无癌细胞浸润)。另收集2012年1月至2020年1月上述3家医院病理科贮存的有详细随访信息的69例PCa手术标本进行数据分析,患者平均年龄(69.70±6.64)岁,均行PCa根治术并辅以术后内分泌治疗。以上组织均在手术切除后,迅速浸于RNA保存液并超低温冷冻保存。本研究经医院伦理委员会批准,所有患者或家属均知情并签字同意。
1.2 细胞培养和转染 人PCa细胞系(PC3、DU145)和人前列腺正常细胞系(RWPE-1)购自美国模式培养物集存库,细胞复苏后,培养于37℃、5%CO培养箱中,选取对数生长期细胞进行研究。将PCa细胞接种于6孔板后,随机分为siR-EPIC1组与siR-NC组,每组18株。用Lipo2000脂质体转染法转入siRNA。siR-EPIC1组引物序列:上游5’-CCUUCAGACUGUCUUUGAA-3’,下游5’-AGUGUGGCCUCAGCUGAAA-3’;siR-NC组引物序列:上游5’-AGACCUUCAUCAAAAACAU-3’,下游5’-GAGCUAAAACGGAGCUUUU-3’。
1.3 实时定量聚合酶链反应(Real-Time Polymerase Chain Reaction,RT-PCR)分析 取40 mg组织标本,Trizol法提取总RNA,再用Omniscript RT试剂盒将RNA反转录成cDNA。采用SYBR Select Master Mix试剂盒、ABI PRISM 7000进行RT-PCR反应检测EPIC1的表达,反应条件:95℃预热5 min,95℃变性15 s,55℃退火15 s,72℃延伸15 s,40个循环。采用2法计算EPIC1表达量。EPIC1引物序列:上游5’-TATCCCTCAGAGCTCCTGCT-3’,下游5’-AGGCTGGCAAGTGTGAATCT-3’;内参U6引物序列:上游5’-CTCGCTTCGGCAGCACA-3’;下游5’-AACGCTTCACGAATTTGCGT-3’。
1.4 细胞增殖实验(CCK-8法) 将细胞接种于96孔,接种密度5×10个/孔,分别培养1、2、3、4和5 天后,弃去培养液,每孔加入100 μL的CCK-8检测液,作用30 min后,在酶标仪上检测450 nm处的吸光度值。
1.5 细胞侵袭实验(Transwell法) 将预先配置好的Matrigel基质胶铺在Transwell小室的上室底膜,将200 μL无血清细胞培养液接种于上室,接种密度每毫升2.5×10个,下室置入700 μL含血清的完全培养基,培养24 h后弃上室培养基,棉签拭去上室里的细胞,多聚甲醛固定细胞后,用结晶紫染色,倒置显微镜下,计数从上室侵袭至下室的细胞数。
1.6 随访 最后随访日期为2020年8月,全部患者中位随访31.3个月(8~67个月)。随访的内容主要包括患者身体的一般状况、生存状态等。
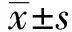
2 结果
2.1 EPIC1在PCa细胞系和PCa组织中的表达情况 EPIC1在PC3、DU145中的表达量分别为(0.12±0.02)和(0.20±0.03),在RWPE-1中的表达量为(0.01±0.001)。与RWPE-1细胞相比,EPIC1在PC3、DU145细胞中的表达增高,差异有统计学意义(t
RWPE-1 PC3=10.515,P
=0.001;t
RWPE-1 DU145=17.144,P
<0.001)。EPIC1在患者PCa组织中的平均表达量为(0.61±0.05),在癌旁正常组织中的平均表达量为(0.06±0.003),差异有统计学意义(t
=23.687,P
<0.001)。2.2 EPIC1对PCa细胞增殖能力的影响 在PC3细胞中转入siRNA后的第1、2、3、4和5天,siR-EPIC1组和siR-NC组的吸光度均有升高的趋势,不同组别和处理时间对PC3细胞增殖能力无交互作用(P
>0.05)。siR-EPIC1组在各个时间点的吸光度均低于siR-NC组,细胞增殖能力下降,组间差异有统计学意义(P
<0.05)。见表1。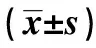
表1 PC3细胞siR-EPIC1组与siR-NC组各时间点吸光度比较
在DU145细胞中分别转入siR-EPIC1和siR-NC后,不同组别和处理时间对DU145细胞增殖能力无交互作用(P
>0.05)。相较于siR-NC组,siR-EPIC1组细胞的增殖能力下降,组间差异有统计学意义(P
<0.05)。见表2。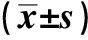
表2 DU145细胞siR-EPIC1组与siR-NC组各时间点吸光度比较
2.3 EPIC1对PCa细胞侵袭能力的影响 在PC3细胞中,siR-NC组侵袭的细胞数为(259.25±43.59),siR-EPIC1组为(73.25±25.75),两组差异有统计学意义(t
=7.348,P
<0.001)。在DU145细胞中,siR-NC组侵袭的细胞数为(182.75±35.52),siR-EPIC1组为(53.25±17.13),两组差异有统计学意义(t
=6.568,P
<0.001)。Tranwell检测显示,siR-EPIC1抑制了PC3和DU145细胞的侵袭能力。见图1。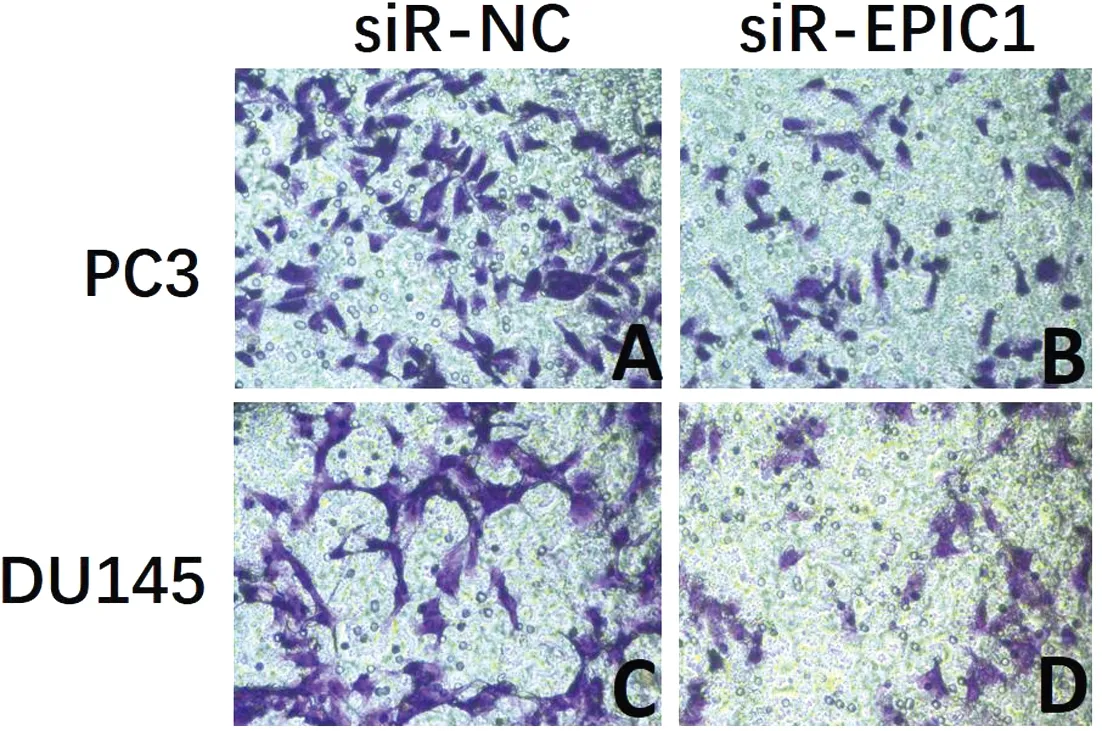
图1 siR-EPIC1对PCa细胞的侵袭能力的影响
2.4 EPIC1的表达水平与PCa患者临床病理参数之间的关系 采用RT-PCR法分别检测EPIC1在69例PCa组织中的表达量,再以表达量的平均值为界,将患者分为EPIC1高表达组(n
=38)和低表达组(n
=31)。相较于EPIC1低表达组,EPIC1高表达组的Gleason评分高,局部淋巴结转移明显,TNM分期晚,差异有统计学意义(P
<0.05)。见表3。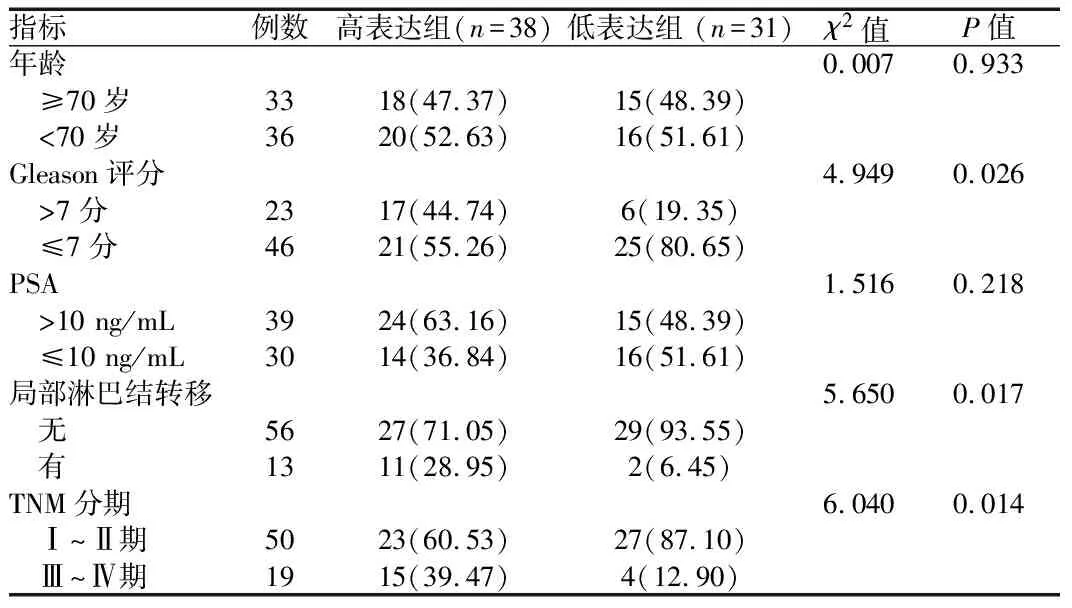
表3 EPIC1高表达组与低表达组患者临床病理参数比较[例(%)]
2.5 EPIC1的表达水平与患者生存率的关系 69例患者总体的3年生存率为62.5%,其中EPIC1高表达组患者的3年生存率为53.7%,低表达组为78.1%。Kaplan-Meier法生存分析结果显示,EPIC1高表达组患者生存曲线在各个时间段均低于低表达组,两组患者生存率的差异有统计学意义(P
=0.040)。见图2。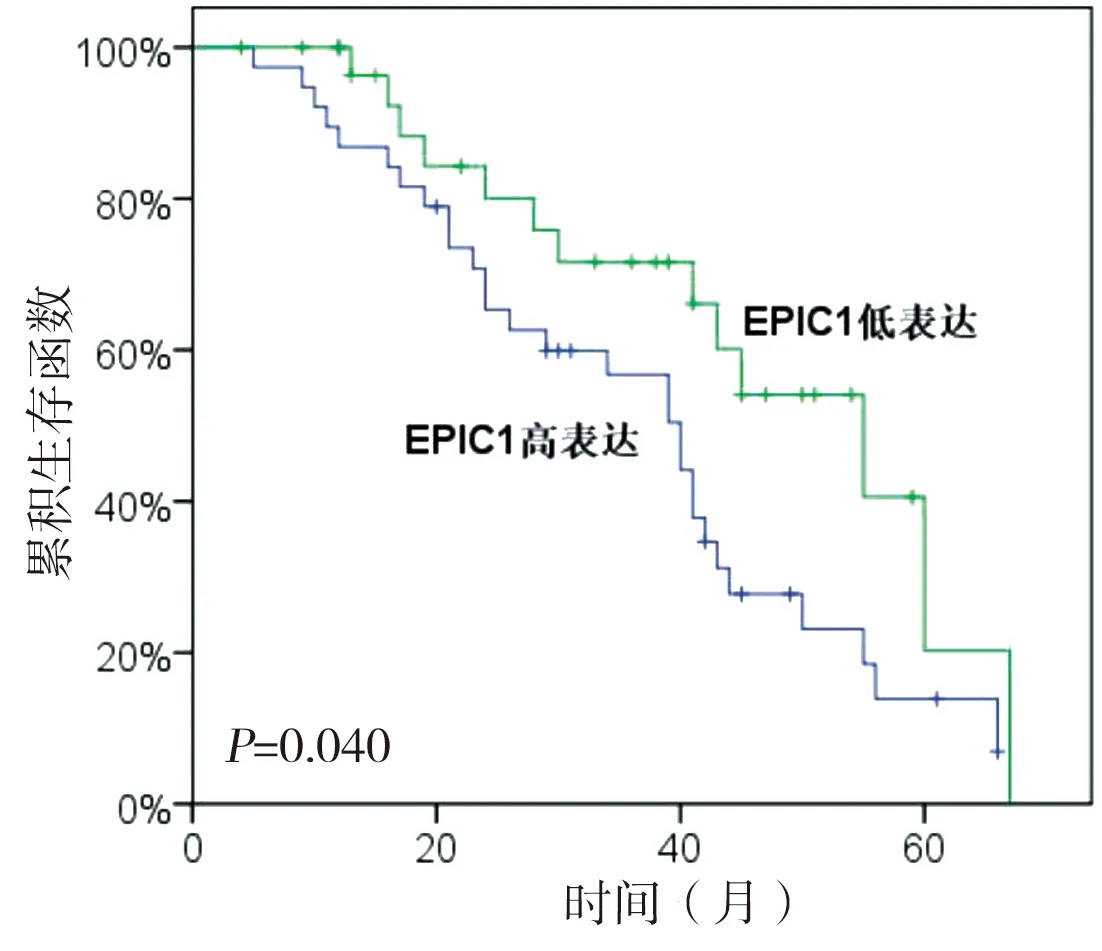
图2 EPIC1高表达组与低表达组患者生存分析
3 讨论
生物信息学研究表明,LncRNA在多种人类肿瘤细胞中起到抑癌或促癌的作用。EPIC1是新近发现的一种LncRNA,表观遗传学分析确定它与癌基因Myc
相互作用,并促进癌症细胞周期的进展,并且在肺癌、胆管癌等肿瘤的核苷酸序列处形成EPIC1-Myc
复合体,促进Myc
的转录和翻译,并增强下游MYC、Cyclin A1、CDC20和CDC45等蛋白分子的表达,加速细胞分裂和周期进展,发挥致癌作用。然而EPIC1与PCa的关系尚未有研究报道。本研究结果显示,EPIC1在PCa细胞系中的表达水平高于正常前列腺RWPE-1细胞系,提示EPIC1对PCa的发生和转移起到一定作用。Li等研究发现,EPIC1能激活MYC蛋白下游的Cyclin A/D、CDK9等靶分子,加速细胞周期G1/S/G2的进程。Zhao等研究发现,EPIC1能够促进MEF2D蛋白复合体的泛素化进而抑制癌细胞的活力和侵袭转移。本研究结果发现,EPIC1在PCa组织中的表达水平高于癌旁正常组织,进而从细胞学和人体组织标本2个层面验证了EPIC1的表达差异,证实了EPIC1对PCa具有促进作用。
本研究采用siRNA技术抑制EPIC1的表达后,发现PCa细胞的增殖和侵袭均明显下降,表明EPIC1具有促进PCa细胞分裂增殖和侵袭转移的功能。目前,对于EPIC1促癌机制的研究主要集中于EPIC1-MYC复合体的功能。研究表明MYC家族蛋白能促进PCa细胞的分裂增殖,并能诱导PCa的激素抵抗性。笔者认为,EPIC1可能在Myc
基因表达和MYC蛋白功能调控中扮演重要作用,进而对细胞周期产生调控作用,但其具体机制尚需进一步研究。本研究结果显示,癌组织中的EPIC1水平越高,患者的Gleason评分越高、局部淋巴结转移越明显、TNM分期越晚。生存分析发现,EPIC1高表达组患者的存活率低于EPIC1低表达组,表明EPIC1对患者体内PCa细胞的恶性程度和转移能力具有促进作用,同时EPIC1也具有预测患者生存期的作用。一项针对111例晚期乳腺癌患者的研究表明,EPIC1高表达的患者也常合并Ki-67的高表达,易出现早期转移,3年存活率较低,而且对紫杉醇-顺铂化疗方案具有耐药性。笔者将会对前列腺癌化疗耐药与EPIC1的关系进行进一步研究。综合目前文献资料,本研究首次在PCa中研究了EPIC1与患者的生存和预后的关系,表明EPIC1有希望成为判断PCa患者预后的有效的辅助因子。但本研究为单一中心研究,且纳入病例数依然偏少,后续仍需多中心大样本的研究,以进一步发掘EPIC1的作用机制和临床意义。综上所述,本研究证实了新型LncRNA-EPIC1对PCa的促进作用,EPIC1能提高PCa细胞的增殖和侵袭能力,促进PCa的恶性程度。针对EPIC1的靶向治疗方案有可能成为PCa治疗的新手段。
