野生假芝的驯化栽培与抗氧化活性研究
2021-08-18赖丽红叶丽云吴小平谢宝贵
赖丽红 叶丽云 吴小平 谢宝贵
野生假芝的驯化栽培与抗氧化活性研究
赖丽红 叶丽云 吴小平*谢宝贵
(福建农林大学菌物研究中心,福州 350002)
假芝的民间药用历史悠久,有消炎、利尿、抗肿瘤、抗氧化、免疫调节、神经调节等功效,开发价值大,对福建青芝山上采集到的一株野生假芝进行分离,并利用形态学方法和ITS测序手段鉴定,确定其为假芝()。对该野生假芝的生物学特性、驯化栽培以及子实体多糖清除DPPH自由基的抗氧化活性进行探究的结果:菌丝生长的适宜碳源为蔗糖,适宜氮源为大豆蛋白胨,最适温度范围为25~30 ℃,最适pH范围为8~9;采用仿野生短段木林下覆土栽培,两年可产4潮子实体,生物转化率达6.52%;其子实体多糖成分的抗氧化活性高于赤芝、紫芝。
野生假芝;鉴定;生物学特性;驯化栽培;抗氧化
假芝()为灵芝科假芝属真菌,别名乌芝,一般生长在林中地上或埋于地下的腐木上,是一种传统的民间中草药,具有重要的药用价值[1-2]。由于野生假芝生长缓慢、产量低,供不应求,价格昂贵,因而对野生假芝予以驯化栽培十分必要[3]。短段木林下覆土栽培,是一种将“林”和“菌”结合在一起的仿野生栽培模式,常用于灵芝的驯化栽培[4-5]。
赤芝、紫芝是灵芝科中分布和开发利用较为广泛的种类,现代研究表明其多糖成分具有抗氧化、清除自由基的功效,但目前对假芝多糖抗氧化活性的研究报道尚少[6-7]。
DPPH自由基清除率检测法,是一种简单、快速、准确、灵敏地筛选和评价天然抗氧化剂的检测手段,可用于假芝多糖抗氧化活性的检测[8-10]。青芝山是福建省五大名山之一,具有丰富的野生灵芝资源。本试验对一株采自青芝山上的野生假芝进行分离鉴定,并研究其生物学特性、驯化栽培模式和多糖的抗氧化活性,以为野生假芝资源进一步开发利用提供参考。
1 材料与方法
1.1 供试菌株
假芝:采自福建省青芝山,经组织分离获得的纯培养菌丝,编号为QZSJZ。赤芝J-7/AL-2、紫芝ZW-03均为子实体分离培养后获得的菌种,由福建农林大学菌物研究中心提供。
1.2 培养基
PDA固体培养基:土豆200 g、葡萄糖20 g、琼脂粉20 g、蒸馏水1 L,pH 7.0。
母种培养基:土豆200 g、葡萄糖20 g、琼脂粉20 g、大豆蛋白胨2 g、磷酸二氢钾1 g、硫酸镁0.5 g、维生素B10.01 g、蒸馏水1 L,pH 8.0。
原种培养基:麦粒98.5%、石膏1.5%。
栽培种培养基:木屑78%、麸皮20%、石膏1%、石灰1%。
碳源实验基础培养基:琼脂粉20 g、大豆蛋白胨2 g、磷酸二氢钾1 g、硫酸镁0.5 g、维生素B10.01 g、蒸馏水1 L,pH 7.0。
氮源实验基础培养基:琼脂粉20 g、葡萄糖20 g、磷酸二氢钾1 g、硫酸镁0.5 g、维生素B10.01 g、蒸馏水1 L,pH 7.0。
温度实验培养基:土豆200 g、葡萄糖20 g、琼脂粉20 g、大豆蛋白胨2 g、磷酸二氢钾1 g、硫酸镁0.5 g、维生素B10.01 g、蒸馏水1 L,pH 7.0。
pH实验基础培养基:土豆200 g、葡萄糖20 g、琼脂粉20 g、大豆蛋白胨2 g、磷酸二氢钾1 g、硫酸镁0.5 g、维生素B10.01 g、蒸馏水1 L。
1.3 野生假芝的形态学鉴定
测量野生假芝的菌盖直径和厚度、菌柄直径和长度等,并观察表面形态,记录其表观特征;在体式显微镜下观察野生假芝的纵切面结构;组织分离获得纯菌丝体,25 ℃避光培养,再次扩接于平板上,观察和记录菌落生长初期和后期的形态,并在显微镜下观察菌丝形态;在显微镜下观察野生假芝的孢子形态。
1.4 野生假芝的ITS序列鉴定
假芝DNA提取的方法参考傅俊生的方法[11],以假芝DNA为模板,以ITS1(5’-TCCGTAGGT GAACCTGCGG -3’)、ITS4(5’-TCCTCCGCTTATT GATATGC -3’)为引物,在PCR仪上进行ITS序列扩增。PCR 产物交由铂尚生物技术有限公司完成测序工作。将测序的结果在NCBI上进行Nucleotide BLAST比对,再与GenBank中已有的ITS序列进行同源性比较,利用MEGA5.05中的邻位相连法(Neighbor-joining)构建系统进化树,分析亲缘关系,验证其形态学鉴定结果。
1.5 野生假芝的生物学特性研究
(1)最适碳源。在碳源实验基础培养基中,分别添加20 g/L的葡萄糖、果糖、乳糖、麦芽糖、蔗糖和淀粉,以碳源实验基础培养基作为对照,培养假芝菌丝。每处理设5个重复。
(2)最适氮源。在氮源实验基础培养基中,分别加入2 g/L的大豆蛋白胨、牛肉浸膏、酵母浸
膏等有机氮,硫酸铵、硝酸铵、氯化铵等无机氮作为氮源,以氮源实验基础培养基作为对照,培养假芝菌丝。每处理设5个重复。
(3)最适温度。设置6个温度梯度:10、15、20、25、30、35 ℃。每处理设5个重复。
(4)最适pH。设置7个pH梯度:5.0、6.0、7.0、8.0、9.0、10.0、11.0。每处理设5个重复。
(5)菌丝生长速度的测定。参照叶丽云的方法[12]测量菌丝的生长速度,并记录菌丝长势。
1.6 野生假芝的驯化栽培
本实验菌种的生产分为三级:母种、原种、栽培种,野生假芝驯化栽培的模式采用短段木林下覆土栽培,短段木选用阔叶林原木,截断至15 cm左右,具体工艺参照林下灵芝覆土栽培技术[13]。记录主要商品性状及栽培性状,计算生物转化率。
1.7 多糖提取与抗氧化活性测定
参考胡斌杰等[14]的方法,采用热水浸提法提取假芝、赤芝、紫芝多糖,每样品设5个重复,再利用苯酚—硫酸法检测多糖的含量。参考曹正[15]的方法,采用DPPH法测定三种多糖的抗氧化活性,设5个多糖浓度梯度:0.2、0.4、0.6、0.8、1.0 mol/ L,以相应浓度的维生素C水溶液作为阳性对照。按下列公式计算清除率:
清除率%=[(0-i+j)/A0]×100%。
式中:i为2 mL样品溶液+2 mL DPPH溶液的吸光度;j为2 mL样品溶液+2 mL无水乙醇的吸光度;0为2 mL DPPH溶液+2 mL蒸馏水的吸光度。
1.8 数据处理
利用Excel和SPSS软件对获得的实验数据进行统计和分析。
2 结果与分析
2.1 野生假芝的形态学鉴定
(1)外观性状(图1)。假芝为木栓质,菌盖近肾形或半圆形,灰褐色至暗褐色,直径4~8 cm,厚约1.0 cm,有显著的同心环带,无亮漆状光泽,有细微绒毛,边缘呈波浪状。菌背初期为白色,伤变血红色,成熟后为灰褐色,伤变不变色。菌柄近乎实心,侧生或偏生,长5~12 cm,粗0.5~1.2 cm,近圆柱形或稍扁平,具短绒毛,与菌盖颜色相同或稍深。这与黄年来《中国大型真菌原色图鉴》[16]中描述的假芝()外观性状一致。
在体视显微镜下,可观察到假芝子实体的结构主要由6个部分组成,从上到下分别为菌盖表面、菌皮、皮层、菌肉、菌管和菌柄。皮层是菌皮和菌肉的过渡层,颜色较淡,从近菌柄端到菌盖边缘不断变薄直至消失;菌皮、菌肉的排列较疏松,结构柔软;而菌管排列紧密,由管状结构组成,菌管口呈近圆形或多边形。

图1 野生假芝的子实体形态
(2)菌丝及孢子的形态特征(图2)。假芝菌落生长初期为白色,菌丝生长旺盛,致密,边缘整齐;随着培养时间的增加,菌落开始产生褐色分泌物,从接种块往外逐渐变成褐色。在显微镜400倍下观察,菌丝细长,壁薄,具隔膜、分枝和粉孢子。孢子近球形,淡黄褐色,与黄年来《中国大型真菌原色图鉴》[16]中描述的假芝孢子形态特征一致。

图2 假芝菌丝及孢子的形态
2.2 野生假芝的ITS序列鉴定
将采集的野生假芝样本的DNA测序结果在NCBI上进行Nucleotide BLAST比对,结果与登录号为KU219986.1的假芝()的相似度高达98%。将GenBank中已知的假芝属真菌片段序列与QZSJA菌株以邻位相连的方法构建系统进化树(图3),可以看出QZSJZ菌株与假芝的亲缘关系最近,支持率达100%,进一步验证了形态学鉴定结果。
2.3 假芝的生物学特性
(1)最适碳源。假芝菌丝在不同碳源培养基中均能生长(表1),其中以在蔗糖培养基中生长表现佳,菌丝洁白致密,边缘整齐,日均生长速度快,达0.78 cm,其次是麦芽糖、淀粉、果糖、葡萄糖。以乳糖为碳源时,菌丝生长速度慢,各重复处理的一致性较差。
(2)最适氮源。假芝菌丝在3种有机氮源培养基中均能正常生长(表1),其中以大豆蛋白胨为氮源时,生长表现佳:菌丝洁白浓密,重复处理的一致性好,日均生长速度快,达0.79 cm。其次为酵母浸膏。以牛肉浸膏为氮源时,菌丝生长较慢,各重复处理的一致性较差。三种有机氮源之间均具有极显著的差异。
而在以无机氮源(硫酸铵、硝酸铵、氯化铵)为氮源时,假芝菌丝与对照表现相同,均不生长(表1),说明假芝菌丝无法利用无机氮源。
综上,假芝菌丝的最适氮源为大豆蛋白胨。

表1 不同碳源和氮源条件下QZSJZ菌株菌丝的生长速度
注:+++、++和+分别表示菌丝生长致密、较致密和稀疏,-表示菌丝不生长;同列数据后大小写字母不同表示差异极显著(<0.01)和显著(<0.05)。表2同。
(3)最适温度。假芝菌丝在10 ℃、15 ℃、35 ℃时基本不生长,在20~30 ℃下可正常生长(表2),其中以30 ℃时,菌丝洁白、致密,边缘平整,长势好,日均生长速度快,达0.96 cm。其次为25 ℃时,菌丝长势较好,生长速度较快。在20 ℃时,菌丝长势稀疏,边缘较不规则。综上,假芝菌丝的最适温度范围25~30 ℃。
(4)最适pH。假芝菌丝在pH 5.0~10.0均能正常生长(表2)。以pH为8.0时,菌丝洁白浓密,边缘平整,重复处理的一致性好,日均生长速度快,达0.80±0.04 cm;其次是pH 9.0,日均长速为0.76±0.11 cm。pH为6.0时,虽然菌丝生长较快,但不致密。综上,假芝菌丝最适pH为8.0~9.0。
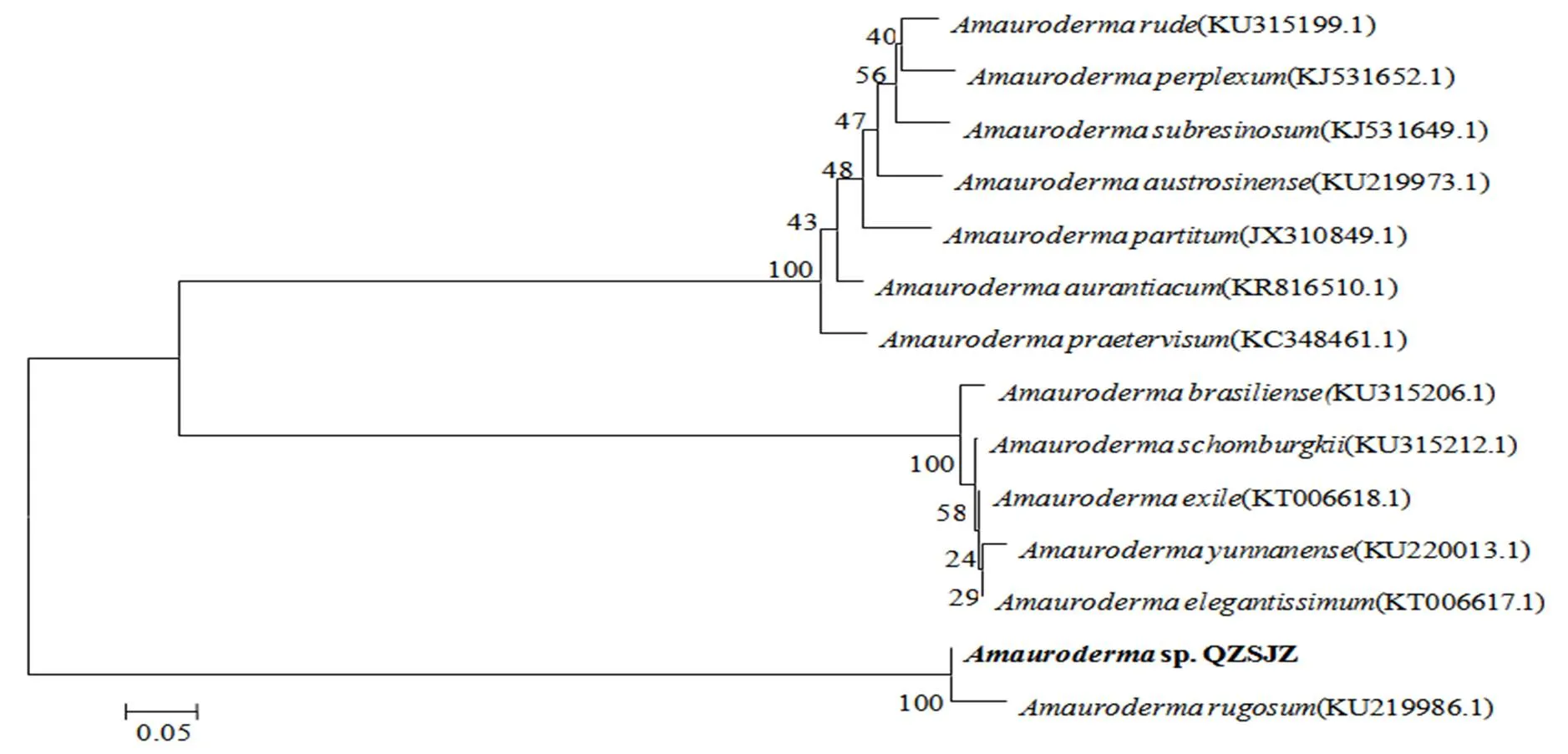
图3 QZSJZ菌株的系统进化树

表2 不同温度和pH条件下QZSJZ菌株菌丝的生长速度
2.4 假芝的驯化栽培
试验结果表明,假芝可以采用短段木林下覆土模式进行栽培,栽培获得的子实体菌盖为灰褐色,直径7.03±0.47 cm,厚度1.07±0.13 cm;菌背幼芝时为白色,成熟后为灰褐色;菌柄长10.50±2.53 cm;单生,出菇整齐(图4)。该栽培模式下,两年可产4潮子实体,子实体大量发生在第二年,两年总产量为75 kg/m3(鲜重),生物转化率达6.52%。
2.5 抗氧化活性的比较分析
通过DPPH法测定子实体多糖的抗氧化活性,结果表明,假芝、赤芝、紫芝的多糖成分对DPPH自由基均表现出一定的清除能力,并且在一定范围内,随多糖浓度的提高,清除能力增强(图5)。其中,以多糖浓度为1.0 mg/mL时,假芝(人工栽培)清除DPPH自由基的能力强,清除率为70.04%;紫芝次之,为62.28%;赤芝最低,为50.07%。表明假芝是一种优质的天然抗氧化剂,对DPPH自由基清除作用优于赤芝和紫芝,非常值得开发利用。

图4 驯化假芝的子实体形态
3 小 结
假芝属()是灵芝科中的重要亚属之一,主要分布在热带和亚热带地区,其模式产地在萨摩亚。目前我国已报道的假芝共有22种,包括邹盖假芝()、福建假芝()、厦门假芝()、假芝()、漆黑假芝()等[17]。假芝的民间药用历史悠久,有消炎、利尿、抗肿瘤、抗氧化、免疫调节、神经调节等功效,开发价值高。但目前仍未见假芝的正式开发利用和成果转化的报道,这可能是同科内的赤芝、紫芝为大众所认知,具有压倒性的优势所致。因此,对假芝进行深入研究和开发利用很有必要[18]。
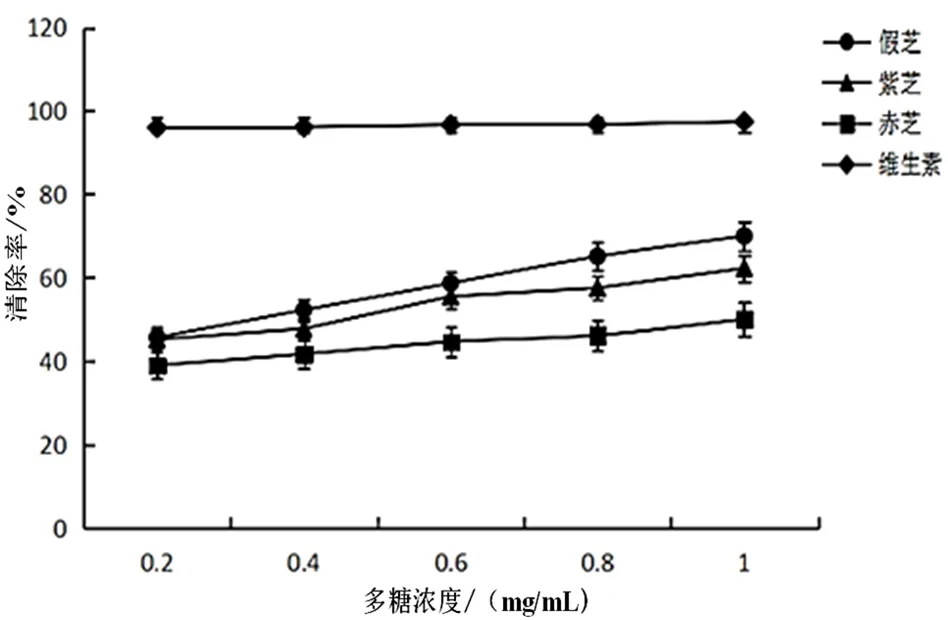
图5 3种不同子实体多糖对DPPH自由基的清除能力
本研究利用形态学方法和ITS测序手段对一株野生菌进行鉴定,确定其为假芝(),并探索其适宜的培养条件,结果:最适碳源为蔗糖,最适氮源为大豆蛋白胨,最适温度25~30 ℃,最适pH为8.0~9.0。采用仿野生短段木林下覆土栽培获得成功,生物转化率达6.52%。对其抗氧化活性的测定结果显示,假芝多糖的抗氧化能力高于赤芝和紫芝。后续将探究假芝多糖的结构、抗氧化作用机理以及其他活性成分的功效,为其进一步开发利用和成果转化奠定基础。
[1] 麦艳珍, 申茹, 徐英辉, 等. 一株驯化血芝的基源鉴定[J]. 生物资源, 2019, 41(04): 348-352.
[2] 张一帆, 谢意珍, 杨小兵. 假芝功效研究进展[J]. 食用菌, 2018, 40(02): 1-4 .
[3] 肖自添, 刘明, 何焕清. 一株野生乌芝的鉴定及其生物学特性研究[J]. 广东农业科学, 2016(3): 72-76.
[4] 郭俊秀, 宋秀敏, 张雪莲, 等. 塑料大棚灵芝短椴木高产栽培技术[J]. 农业工程技术(温室园艺), 2015(13): 66, 68.
[5] 明凤恩, 陆荣生. 紫灵芝林下仿野生椴木栽培技术[J].园艺与种苗, 2020, 40(03): 25-27.
[6] 吴杨洋, 周妍汝, 刘春燕, 等. 灵芝多糖提取工艺优化及抗氧化活性的研究[J]. 食品安全质量检测学报, 2020, 11(14): 4636-4642.
[7] 张瑞婷, 周涛, 宋潇潇, 等. 灵芝活性成分及其药理作用的研究进展[J]. 安徽农业科学, 2018, 46(03): 18-19.
[8] Xu G(许刚).Study on scavenging free radicals by active compounds from natural[J]. J Wuxi Univ of Light Indus(无锡轻工大学学报), 2005(1): 89-94.
[9] 梁蓉蓉, 贾振斌, 罗辉, 等. DPPH在抗氧化活性评价中的应用[J]. 广东化工, 2014, 41(20): 57-58.
[10] 王会. 筛选和评价天然抗氧化剂的方法-DPPH法[J]. 广州化工, 2013, 41(22): 30-32, 42.
[11] 傅俊生. 草菇杂交育种研究及其分子遗传标记的建立[D]. 福州: 福建农林大学,2007(05): 55.
[12] 叶丽云,鲁欣,林强,等.灵芝单、双核菌丝差异研究[J]. 食品工业科技,2016,37(20): 211-215.
[13] 邓代宇,邓贵华,罗迷. 林下灵芝覆土栽培技术[J]. 现代园艺,2016(6): 31-32.
[14] 胡斌杰, 陈金锋, 王宫南. 超声波法与传统热水法提取灵芝多糖的比较研究[J]. 食品工业科技, 2007(2): 190-192.
[15] 曹正,凡军民,谢春芹,等. 不同灵芝菌株功能性成分含量及其抗氧化活性比较[J]. 江苏农业科学,2016,44(9): 281-283.
[16] 黄年来. 中国大型真菌原色图鉴[M]. 北京: 中国农业出版社, 1998: 80-81.
[17] 秦改娟, 王珊珊, 陈青君, 等. 一株假芝的分离鉴定与生物学特性[J]. 应用与环境生物学报, 2015(3): 464-469.
[18] 张一帆, 谢意珍, 杨小兵. 假芝功效研究进展[J]. 食用菌, 2018, 40(02): 1-4.
Study on biological characteristics and antioxidant activity of a wild
Lai Lihong Ye Liyun Wu Xiaoping*Xie Baogui
(Mycological Research Center of Fujian Agricultural and Forestry University, Fuzhou 350002, China)
In this study, a wildwas collected in Qingzhi Mountain, Fujian Province, pure mycelium was obtained by separation. Using morphological method and ITS sequencing analysis, the strain was identified as. Biological characteristics, domesticated methods and antioxidant activity of free radicals scavenging DPPH polysaccharides were investigated. The results showed that the optimal carbon source of the wildmycelium was sucrose; The optimum nitrogen source was peptone; the optimum temperature range for 25~30 ℃; the optimum pH range is 8~9. Its artificial cultivation is feasible, the biological conversion rate is 6.52%, and the antioxidant activity of subentity polysaccharide was higher than that of theand.
wild; identification; biological characteristics; domesticated; antioxidant
S646.2
B
2095-0934(2021)04-328-06
国家重点研发计划“中医药现代化研究”重点专项——闽产高品质道地中药材灵芝、太子参规范化种植及精准扶贫示范研究(2019YFC1710500)
赖丽红(1993-),女,理学学士,主要研究方向为食用菌遗传育种。E-mail:953254839@qq.com。
吴小平(1965-),男,博士,教授,从事食用菌教学与科研。E-mail:fjwxp@126.com。
