三七总皂苷对脂多糖(LPS)诱导小鼠急性肺损伤的保护作用
2021-08-18闫旭苗芳徐淑建魏勤庚魏新明方圆祁艺新孙柯嘉董素淼娄志国隋宏书
闫旭,苗芳,徐淑建,魏勤庚,魏新明,方圆,祁艺新,孙柯嘉,董素淼,娄志国,隋宏书
(1.山东第一医科大学基础医学院,山东 泰安 271000;2.山东第一医科大学基础医学院病理教研室,山东 泰安 271000;3.山东第一医科大学通识教育部,山东 泰安 271000;4.山东第一医科大学组织学与胚胎学教研室, 山东 泰安 271000)
0 引言
急性肺损伤(acute lung injury,ALI)是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全。以肺容积减少、肺顺应性降低、通气/血流比例失调为病理生理特征,临床上表现为进行性低氧血症和呼吸窘迫,肺部影像学上表现为非均一性的渗出性病变,最终发展为更为严重的致命性急性呼吸窘迫综合征ARDS[1]。经过不断研究,人们对ALI 的发病机制有了一定的认识,患者由于肺部损伤引起全身过度的炎症反应,加速肺部炎症反应过程并促进ALI 的发展。尽管我们对ALI 有了一定的了解,但是ALI/ARDS 的致死率仍然高达30%~50%[2]。现阶段主要通过控制原发病、对症处理和支持治疗等以改善肺通气和组织氧供,但均未取得理想效果。因此,开发高效的治疗药物是治愈ALI 的当务之急。
自噬是一种高度保守的细胞降解和再循环过程。在哺乳动物细胞中有3种主要类型的自噬:微自噬、巨自噬和分子伴侣介导的自噬(CMA)[3]。这3种自噬方式最终都是将细胞质(受损的细胞器或蛋白质)运送到溶酶体进行降解和再循环。自噬通常被认为是细胞的保护机制[4]。越来越多的证据表明自噬在各种条件下的ALI发病机理中[5]。一方面适度的自噬能抑制炎性因子的释放;另一方面,过度的自噬能加重细胞损伤。大量研究结果表明自噬在ALI的炎症发生、发展以及发病机制中起关键作用,但其调控ALI炎症的最终结果与不同的细胞类型有关。比如,自噬缺陷小鼠体内巨噬细胞自噬受到抑制,诱导炎症发生,小鼠死亡率上升[6]。在LPS诱导的小鼠ALI中,中性粒细胞的自噬为中性粒细胞的活化及颗粒内容物的释放所必须的;在ALI期间中性粒细胞自噬增加,导致颗粒内容物释放增加[7]。还有研究发现,抑制肺上皮细胞自噬,可以缓解ALI[8]。有研究发现在LPS诱导的ALI小鼠模型中出现过度自噬[9]。PI3K/AKT/mTOR途径被认为是调节自噬的必要信号途径[10]。经了解,有实验成功通过激活PI3K/AKT/mTOR途径来抑制LPS诱导的小鼠ALI模型的细胞自噬[11]。这证明,PI3K/AKT/mTOR途径与自噬是治疗ALI的一个潜在靶点。但目前仍未见有将该通路和自噬与ALI联系在一起的文章。
三七又名田七,是我国传统名贵中药,具有散瘀止血、消肿定痛等功效。三七总皂苷(PNS)是三七的有效活性成分,含有人参皂苷Rh、人参皂苷Rg、三七皂苷R。等主要成分,随着研制成血塞通、血栓通等中药制剂后,三七总皂苷广泛应用于脑梗死的临床治疗[12]。近期有研究证明,三七总皂苷可以通过激活PI3K/AKT/mTOR途径来促进细胞再生,抑制自噬[13]。这证明三七总皂苷有通过该通路来治疗ALI的可能性。但目前尚未出现用三七总皂苷治疗ALI的相关研究。
三七总皂苷,作为早已被广泛应用的临床药物,其安全性是公认的,鉴于其抗炎作用和调节自噬的作用,三七总皂苷很有可能成为治疗ALI的高效药物。但最终三七总皂苷是否可以有效治愈ALI以及使用的最佳药量,我们仍需通过实验去求证和探索。本实验拟对此进行研究,为三七总皂苷在治疗ALI的应用提供实验依据。
1 材料与方法
1.1 动物与试剂
雄性BALB/C小鼠(8~10周,25~30g)购于山东省朋悦实验动物繁育有限公司;LPS(5mg/kg,Sigma-Aldrich);三七总皂苷(Panax notoginseng saponins,PNS),购自广西梧州制药股份有限公司;SOD测试盒(Solarbio Science and Technology Corporation,Beijing,China);MDA(丙二醛)检测试剂盒(Sigma-Aldrich)。
1.2 动物分组及模型制备
实验小鼠采用随机数字表法将小鼠分为4组,每组6只:LPS组(LPS处理),对照组(50μL生理盐水处理),LPS+低剂量PNS组,LPS+高剂量PNS组。LPS组:通过腹膜内注射戊巴比妥钠(50mg/kg)麻醉小鼠,然后气管内滴注50μLLPs(5mg/kg)刺激小鼠,6h后处死小鼠。对照组:通过腹膜内注射戊巴比妥钠(50mg/kg)麻醉小鼠,然后气管内滴注50μL生理盐水,6h后处死小鼠。LPS+低剂量PNS组与LPS+高剂量PNS组:通过尾静脉向小鼠注射低剂量(5mg/kg)或高剂量PNS(20mg/kg),每日一次,连续给药3天。3天给药结束后,进行LPS处理,6h后腹腔注射10%水合氯醛0.5mL处死小鼠。保存各组小鼠肺组织样本以进行进一步分析。
1.3 检测指标
1.3.1 苏木素-伊红染色(H&E染色)
分离右肺组织,并在4℃的4%多聚甲醛中固定24h,然后用10%,20%,30%的梯度蔗糖脱水。将组织的表面干燥并且将组织包埋在石蜡中以制备厚度为8μm的切片。切片用伊红和苏木素染色。
1.3.2 肺干重(W/D)比值
为评估小鼠肺水肿程度,切除小鼠的肺组织并立即称重以获得湿重(W)。然后将肺组织置于60℃的干燥箱中加热5天以获取干燥重量(D)。通过评估W/D比来评估肺组织中的水肿。
1.3.3 肺组织SOD活性和MDA含量测定
收集小鼠右肺组织制备组织匀浆,以300g离心5min后收集上清液。分别使用SOD测定试剂盒和MDA检测试剂盒测定超氧化物歧化酶(SOD)和丙二醛(MDA)的含量。严格按照试剂盒说明测定SOD活性和MDA含量。
1.4 统计分析
每次实验至少重复进行3次,实验数据的处理均由SPSS 17.0 软件分析,作图软件选用 GraphPadPrism 5.0;计量资料以 (mean±SD)表示。3组或3组以上的多样本间的数据比较采用单因素方差分析,多重比较使用LSD方法。如果数据不符合单因素方差分析的条件,则采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺组织形态学损伤的比较
对照组肺组织结构形态正常;LPS组小鼠肺组织损伤严重,伴有大量炎性细胞浸润,血管充血和支气管壁增厚;LPS+低剂量PNS组小鼠肺组织损伤严重,同LPS组并无明显差异;LPS+高剂量PNS组小鼠肺组织仅部分受损,轻度炎性细胞浸润(见图1)。
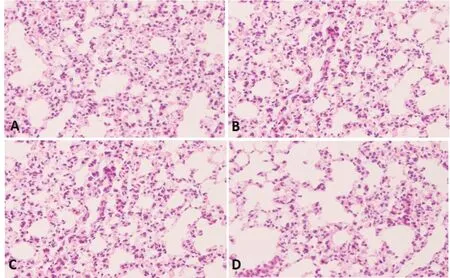
图1 各组小鼠肺组织HE染色图
2.2 肺组织湿干重比的比较
图2所示,与对照组相比,LPS组、LPS+低剂量PNS组和LPS+高剂量PNS组湿干重比升高(P<0.05);与LPS组相比,LPS+低剂量PNS组湿干重比降低但差异较小,LPS+高剂量PNS组湿干重比降低(P<0.05);与LPS+低剂量PNS组相比,LPS+高剂量PNS组湿干重比降低(P<0.05)。

图2 各组小鼠肺组织湿/干重(W/D)
2.3 肺组织氧化应激水平的比较
图3所示,与对照组相比,LPS组、LPS+低剂量PNS组和LPS+高剂量PNS组SOD活性降低,MDA含量升高(P<0.05);与LPS组相比,LPS+低剂量PNS组SOD活性降低,MDA含量降低,但差异较小,LPS+高剂量PNS组SOD活性升高,MDA含量降低(P<0.05);与LPS+低剂量PNS组相比,LPS+高剂量PNS组SOD活性升高,MDA含量降低(P<0.05)。

图3 各组小鼠肺组织SOD和MDA的活力水平
3 讨论
急性肺损伤是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全。其病死率高达68%,发病机理和治疗策略有待深入研究。目前在活体水平上尚无合适手段来研究ALI的发病机制、治疗策略和预后评估;临床上患者对治疗反应也存在很大差异,至今尚无明确的治疗靶点和合理的治疗方案。研究表明,在ALI 早期,细胞自噬被认为是ALI 发展的重要环节。三七总皂苷可以通过激活PI3K/Akt/mTOR 通路提高细胞存活率并诱导细胞再生。为了探究三七总皂苷对ALI的保护作用,本研究通过气管滴注LPS构建ALI模型。本研究发现,气管滴注LPS后,肺组织湿干重比明显增加,肺组织损伤和水肿加重,这表明ALI模型建立成功。
ALI的发病机制涉及氧化和抗氧化之间的失衡[14],因此,我们确定了SOD的活性以及MDA的表达。MDA为氧自由基脂质过氧化反应的产物,其含量与自由基损伤细胞程度成正比。而SOD为体内的一种自由基清除剂,SOD活性的高低反映体内自由基是否过剩[15]。本研究发现,气管滴注LPS后,肺组织SOD活性降低,MDA含量升高。而高剂量三七总皂苷预处理则明显的改善了这种变化,这表明三七总皂苷可以通过减轻氧化应激反应对ALI产生保护作用。这与三七总皂苷减轻细胞损伤,减弱细胞过度自噬,抑制细胞凋亡的功能是一致的。
综上所述,本研究发现三七总皂苷可以通过发挥其抗氧化应激,减轻细胞过度自噬抑制细胞凋亡的作用来对LPS引起的小鼠ALI起到一定的保护作用。
