电化学脱嵌法盐湖提锂多孔LiFePO4电极的制备
2021-08-18殷睿鑫何利华唐忠阳赵中伟
殷睿鑫, 何利华,2, 唐忠阳,2, 赵中伟,2
1.中南大学 冶金与环境学院,湖南 长沙 410083; 2.稀有金属冶金与材料湖南省重点实验室,湖南 长沙 410083
引 言
近年来,随着新能源汽车领域的迅速发展,锂需求量激增,提锂技术的发展也日益受到重视[1-2]。世界锂资源 70% 赋存于盐湖卤水中,而且从盐湖卤水中提取锂具有提取成本低、绿色环保、能耗小等优势[3-4]。但是我国盐湖卤水资源大多呈现出高镁锂比的特点,采用传统沉淀法提锂存在耗碱量大、成本高、污染严重等问题[5],因此开发适用于我国盐湖卤水资源的提锂技术具有重大的经济价值和战略意义。
针对盐湖卤水提锂,目前已开发出了吸附法、石灰-苏打蒸发法、溶剂萃取法、电渗析法等提锂方法[6-9]。这些方法虽然各具特点,但是均存在提锂周期长、锂回收率低、环境污染严重等问题。为此,我们提出了一种基于锂离子电池工作原理的卤水提锂新方法——电化学脱嵌法[10-12]。该方法采用LiFePO4/FePO4或LiMn2O4/λ-MnO2电极作为阳极/阴极,通过外电路驱动Li+离子嵌入FePO4或λ-MnO2电极材料中,从而实现对锂的选择性提取[13-14]。LiFePO4在不同电解质溶液中的循环伏安特性表明[15],Li+离子很容易嵌入FePO4晶格中,而且可逆性能优异,Na+离子和Mg2+离子则需要较低的阴极电位才能少量嵌入,而K+离子基本无法嵌入,因此通过合理控制体系槽电压,即可实现对盐湖卤水中锂元素的选择性提取。
电化学脱嵌法的工作原理与锂离子电池类似,相应的电极制备工艺与锂离子电池电极的制备工艺也大同小异。所不同的是,为了保证电极单位面积上的产能,电化学脱嵌法所用电极的涂覆密度远大于锂离子电池中电极的涂覆密度,这将造成Li+离子在电极内传质缓慢的问题,从而影响实际提锂速率[16-17]。如当电极材料涂覆密度大于20 mg (LiFePO4)/cm2时,电化学脱嵌体系提锂反应主要受限于Li+离子的内扩散过程,即Li+离子在电极涂层内的传质限制了反应的进行[18]。因此,提高电极单位面积产能和提锂速率的关键是解决Li+离子在电极涂层内的扩散缓慢的难题。通过制备多孔电极,为溶液传质提供良好的传输途径就是有效办法之一[19-20]。
基于此,本文利用NH4HCO3受热易分解的特性,提出以NH4HCO3为造孔剂来制备多孔LiFePO4/FePO4电极的思路。在电极浆料制备过程中添加一定比例的NH4HCO3粉末,并使其在电极浆料烘干过程分解,并保留原有粉末所占据的物理空间,从而形成具有微孔结构的多孔电极。这些微孔结构,一方面可有效强化溶液在电极内部的扩散传质,另一方面,多孔电极更大的比表面积大,能够为电化学反应提供更多的活性位点,有利于嵌锂反应的进行。
1 试验研究
1.1 电极的制备
(1) LiFePO4电极的制备:将LiFePO4粉末、 PVDF和乙炔黑按质量比为7:1:2进行充分地混合,再将混合物加入至N-甲基吡咯烷酮 NMP溶剂中,在双行星真空搅拌机中搅拌6 h;之后加入质量分数为20% (按固体总质量计算) 的NH4HCO3粉末继续搅拌2 h,得到电极浆料。采用刮涂法将浆料涂覆在集流体上 (浆料涂覆面积为1 720 cm2,涂覆密度为85 mg (LiFePO4)/cm2,最后在真空干燥箱中80 ℃ 烘12 h。
(2) FePO4电极的制备:以制备好的LiFePO4电极和泡沫镍电极为阳/阴极,阴阳极之间采用阴离子膜 (MA-7500,SYBRON) 进行分隔,电解质溶液均为25 g/L NaCl溶液。控制阴极室pH在2 左右,通过在阴阳极两端施加1.1 V的直流电压进行电解脱锂,直至电流小于2 A/m2,即得到FePO4电极。
1.2 试验过程与分析检测
提锂试验:以制备好的LiFePO4电极为阳极, FePO4电极为阴极,阳极室电解质溶液为25 g/L的NaCl溶液,阴极室电解质溶液为12 g/L的LiCl溶液。采用先恒流再恒压的工艺条件进行脱/嵌锂,直至电流小于2 A/m2,以探究电极造孔改性后,电化学脱嵌体系的吸附容量和提锂速率的变化情况。
分析检测:元素含量采用ICP (Thermo Scientific iCAP-7200, USA) 进行检测;电极形貌采用超景深三维显微镜 (VHX-5000, USA) 和扫描电镜 (SEM, JEOL JSM-6490LV, Japan) 进行表征;循环伏安曲线采用普林斯顿电化学工作站 (Princeton Applied Research, USA) 进行测定。
2 结果与讨论
2.1 造孔改性对电极形貌的影响
为了强化电化学脱嵌法盐湖提锂过程中Li+离子在电极涂层中的传质过程,以NH4HCO3为造孔剂,通过造孔法制备了多孔电极,电极表面的二维形貌如图1(a) 和图1(d) 所示。从图1(a) 中可以看出未造孔电极表面存在一些细小裂纹,但电极表面整体较为平滑致密。特别是从图1(b)所示的电极表面微区SEM图中可以看出,LiFePO4颗粒间相互紧密相连,“团聚”现象严重,这会导致溶液在电极内部传质困难,从而影响活性颗粒与电解质溶液的接触,阻碍电化学反应的进行。对比而言,通过NH4HCO3造孔后所得的多孔电极,电极表面变得明显粗糙和不规则。特别是从图1(e) 中可以看出,由于NH4HCO3造孔剂的受热分解,使得整个电极涂层结构变得蓬松多孔,LiFePO4活性颗粒的分布变得更加弥散。这些电极内部和表面形成的微观孔洞,可有效强化Li+离子在电极内的传质;与此同时,微孔结构的存在也大幅度提高了电化学反应界面面积,有利于嵌锂速率的提高,有望实现高电流密度下提锂。此外,对比造孔前后电极的三维超景深图 (图1(c) 和图1(d)) 可以看出,未造孔的电极表面裂纹数量虽多,但深度均较低,导致电解液仍然难以渗入电极内层,这可能会影响电极内部的反应情况;而通过造孔改性,电极表面的裂纹深度显著增大,使得电解液能够快速渗入电极内层参与化学反应。通过裂纹和微孔的双重作用,电解液中的Li+离子更容易扩散至电极内部反应界面,电极的吸附性能得到改善。

图1 电极的二维形貌图:(a)未造孔电极,(d)造孔电极;电极的SEM形貌图:(b) 未造孔电极,(e) 造孔电极;电极的三维形貌图:(c) 未造孔电极,(f) 造孔电极
2.2 造孔改性对电极电化学性能的影响
电化学提锂过程实际上是Li+离子在电场力的驱动下从电解质溶液移动至FePO4阴极反应界面参与化学反应的过程。由于所采用的电极涂覆密度 (85 mg(LiFePO4)/cm-2) 较大,整个过程受限于Li+离子的扩散。图2a所示为造孔前后电极的CV曲线对比,从图中可以看出,由于溶液的传质效果较差,Li+离子在未造孔电极内的扩散阻力较大,导致电极极化严重,其氧化还原峰的间距达到0.8 V以上。通过NH4HCO3造孔改性,电极涂层结构变得疏松多孔,这有效的降低Li+离子在电极内的传质阻力,因此Li+离子在较高的阴极电位下即可嵌入FePO4材料中,其氧化还原峰的间距也降低至0.5 V,电极极化程度明显降低。此外,造孔后电极较大的比表面积可以有效增大化学反应接触面积,有利于提高电化学脱嵌体系的提锂速率,因此,在相同电势下,多孔电极脱锂过程和嵌锂过程的电流均明显高于未造孔电极。
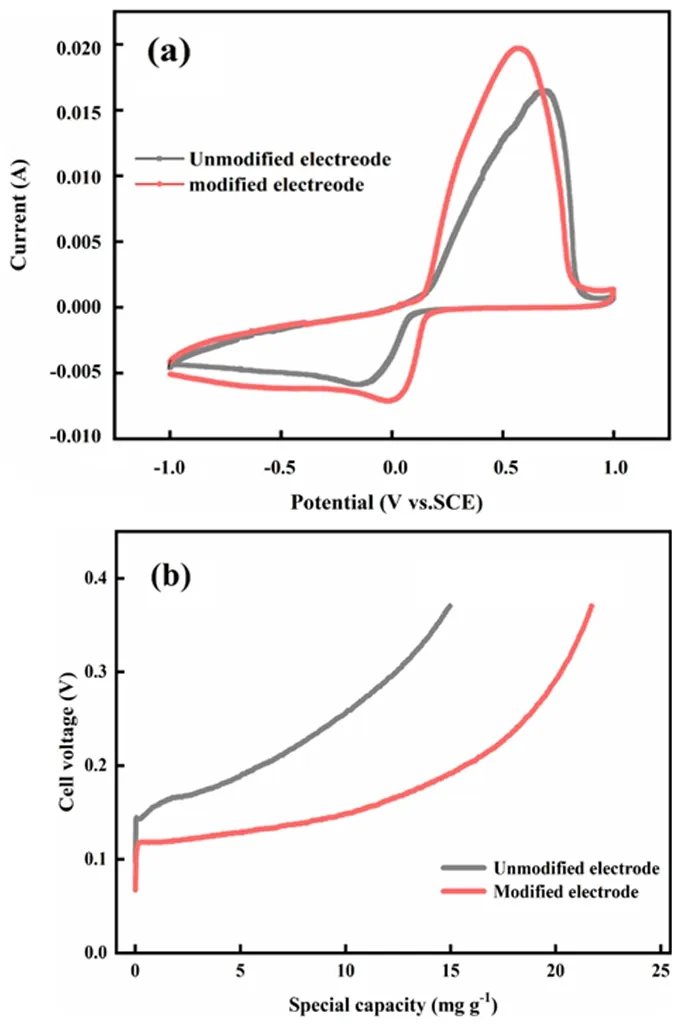
图2 (a) 造孔前后电极在0.2 mV/s 扫速下的循环伏安曲线,(b) 造孔前后电极在20 A/m2电流密度条件下槽电压随吸附容量变化曲线
图2b所示为恒流电解 (20 A/m2) 过程中,电化学脱嵌体系槽电压随吸附容量的变化曲线。对比分析可以明显看出,使用未造孔的电极进行提锂时,其槽电压增长速率较快,电解过程在较短时间内就达到截止电压条件,电极嵌锂容量仅为15 mg (Li)/g (LiFePO4)。
原因主要是未造孔改性电极内部活性材料颗粒紧密接触,导致溶液在电极内部传质缓慢, Li+离子难以快速扩散至电极内部活性颗粒的反应界面,电极浓差极化严重。此外,由于电化学反应速率较快,进入电极内部的Li+离子很快就被消耗完全,导致电极内部锂浓度急剧降低,电极浓差极化进一步加剧,提锂体系槽电压迅速增长。反观通过NH4HCO3造孔改性后的电极,体系的槽电压明显低于未造孔改性电极体系,并且在0.11 V左右存在一个较长的电压平台。说明溶液在电极内部的传质效果较好,在平台范围内主要受电化学控制。这再次印证了,通过对电极进行造孔改性,可有效降低Li+离子在电极内的传质阻力,弱化电极的浓差极化,提高界面电化学反应速率。
上述研究可以推断,未造孔电极极化严重的主要原因是电极的渗透性能差,电解质溶液难以快速渗入电极内部,造成电极内部Li+离子浓度偏低,浓差极化加剧。不仅如此,电极内部较低的Li+离子浓度也会影响到活性材料与Li+离子的有效接触,电极内部反应情况不容乐观。为了进一步验证该推论,我们通过探究恒电流 (20 A/m2) 电解过程中,电极涂层内、中、外三层FePO4活性材料的锂、铁摩尔比值n(Li/Fe) 的变化,来判断电极各层活性材料的反应情况,结果如图3所示。从图3a中可以看出,采用未造孔改性的FePO4电极进行电化学脱嵌法提锂,嵌锂反应主要发生在电极外层,其n(Li/Fe) 值随着电解过程的进行迅速增大。然而,电极中、内层活性物质的n(Li/Fe) 值变化较为缓慢,这说明了电极内部反应缓慢。电解结束后,电极各层活性物质利用率如下:外层81%、中层48%、内层不足35%。由于电极板内部活性物质反应极其不充分,导致活性物质利用率偏低。通过对电解结束后的阴极浆料进行XRD分析也佐证了电极内、外层反应的差异 (图3c)。从图中可知,电极外层主要为LiFePO4材料的衍射峰,说明了外层FePO4活性材料基本转变为了LiFePO4。反观电极中、内层的XRD图谱,其中仍然存在较多的FePO4峰,较多的FePO4活性物质因为无法及时有效的接触到Li+离子而未参与嵌锂反应,电极内部反应情况不佳。相较之下,采用造孔后的电极体系进行提锂,电极内部反应情况得到明显改善,其中、内层的n(Li/Fe) 值随着电解过程的进行迅速增加 (图3b),说明随着电极渗透性能的改善,电极内部反应速率显著增大。电解结束后,电极中、内层活性材料的利用率达到了67% 和56%。这也印证了,通过制备多孔电极,可有效提升电极的渗透性能,提高溶液在电极内的传质速率,从而改善电极内部的反应情况,有助于电极嵌锂容量的提升。
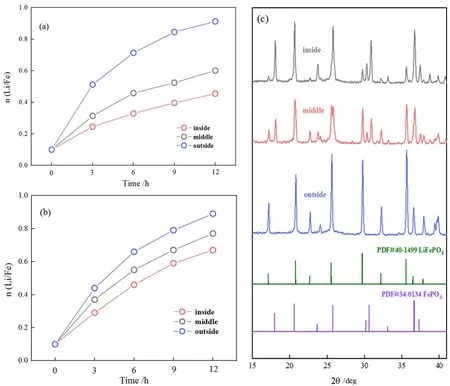
图3 FePO4电极嵌锂过程中各层的锂铁比值变化曲线: (a) 未造孔电极,(b) 造孔后电极;(c) 未造孔电极嵌锂结束后各层电极材料的XRD分析
2.3 造孔改性对电极提锂性能的影响
造孔前后电极的嵌锂容量和电压电流变化情况如图4所示,电解工艺参数为20 A/m2电流密度下恒流电解至槽电压达到0.35 V,再采用0.35 V恒压电解至电流密度小于2 A/m2。从图4a中可以看出,采用造孔改性后的电极体系进行提锂,其嵌锂容量达到35.2 mg (Li)/g (LiFePO4),相较于未造孔电极体系25.6 mg (Li)/g (LiFePO4) 的嵌锂容量提升近40%,这主要得益于电极内部反应情况的改善。此外,多孔电极所具备的更大的比表面能够有效提高反应速率,整个提锂过程耗时相较于未改性电极缩短了5 h,其中恒流电解时长也长达7 h以上 (图4b),电极的电化学动力学性能显著提升。如果以嵌锂容量25 mg (Li)/g (LiFePO4) 为标准,采用多孔电极的提锂体系的平均电流密度高达17.9 A/m2,远大于未造孔电极提锂体系的8.7 A/m2,嵌锂速率显著提高。

图4 (a) 电解过程中电极吸附容量随时间变化曲线,(b) 电解过程中电压和电流变化曲线
电极材料的循环性能是衡量电化学脱嵌体系稳定性和提锂工艺经济性的重要指标。图5所示为造孔前后电极材料的循环性能对比。从图5a中可以看出,由于未造孔电极的渗透性能较差,电解过程中主要以恒压电解为主,循环30个周期后,其吸附容量由初始的25.6 mg (Li)/g (LiFePO4) 降至约23 mg (Li)/g (LiFePO4),容量保持率为90.2%。采用造孔后的电极体系进行循环提锂,从图5a和图5b中可以明显看出,提锂过程主要以恒流为主,并且随着Li+逐渐嵌入至FePO4材料,其槽电压呈缓慢上升的趋势,说明其电化学动力学性能较好。此外,从图5c中可以看出,多孔电极材料的吸附容量在循环30个周期后仍然可以达到35.1 mg (Li)/g (LiFePO4),容量保持率高达98%,其循环性能得到了明显提升。
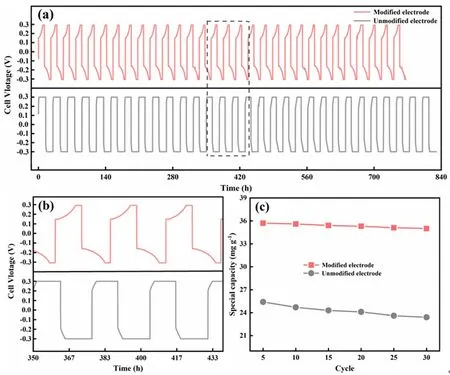
图5 造孔前后电极的循环性能对比: (a) 槽电压变化曲线;(b) 局部放大图;(c) 吸附容量变化曲线
3 结论
本文以NH4HCO3为造孔剂制备了一种具有良好渗透性和传质性能的多孔LiFePO4电极,可有效强化Li+离子在电极内部的传质过程,提高电化学脱嵌体系的提锂速率和吸附容量。主要结论如下:
(1)通过NH4HCO3造孔改性,电极表面出现微裂纹-微孔的复合结构,这有利于增强电极反应传质过程。此外,电极较大的比表面积可以为嵌锂反应提供更多的活性位点,提高嵌锂速率。
(2)随着电极渗透性能的提升,造孔后电极的极化程度显著降低,电极内部活性物质利用率由35% 提高至56%,电极内部反应情况得到改善。
(3)采用造孔后的电极体系进行电化学脱嵌法提锂,其嵌锂容量高达35.2 mg (Li)/g (LiFePO4),且电流密度提高至17.9 A/m2,体系提锂效率显著提升。此外,造孔改性后电极的循环性能也明显得到改善,其循环30个周期后容量保持率高达98%。因此,通过对电极进行造孔改性,电化学脱嵌体系的生产效率和经济效益均能得到显著提升。
