浓香型白酒发酵过程中酒醅的原核生物群落演替过程
2021-08-17李泽,邱磊
李 泽,邱 磊
作为世界六大蒸馏酒之一,中国白酒历史悠久,是中国传统文化的象征,人们最常见、常喝的的是浓、酱、清三种香型的白酒,其中又以浓香型白酒的产量最高,消费量最大。浓香型白酒具有窖香浓郁,香味协调,入口甜,落口绵,尾净余长等特点,是用以高粱为主的多种作物原料,采用混蒸续渣的工艺发酵而成。
中国浓香型白酒工艺是一种典型的东方固态发酵工艺,白酒的发酵是一个在开放的环境中进行的,由多种微生物及酶共同作用的复杂的过程。其微生物主要来源于大曲、周围环境及窖泥和黄水。因此,在整个生产过程中,白酒的挥发性风味特征都受到来自原料和环境的微生物区系的影响。Pang等人在对清香型白酒原料预处理的微生物区系研究中发现,在浸泡结束时,毕赤酵母属、丝状念珠菌属和假丝酵母属与大多数风味有强正相关性,其中,拟威尔嗜杀酵母(Cyberlindnera)与大量酯类物质的形成密切相关,并且这些相关性的影响一直到白酒发酵后期还在发挥作用[1]。大曲是白酒固态发酵的液化剂和糖化剂,来自大曲的微生物区系是白酒发酵的重要驱动力,大曲生产温度的变化会促进微生物结构的演变[2]。沈毅等对酱香型大曲中的优势细菌属做了鉴定,发现泛菌属(Pantoea)、高温放线菌属(Thermoactinomyces)和克罗彭施泰特氏菌属(Kroppenstedtia),其中泛菌属是一种重要的代谢和发酵的化能异养菌,也是多种大曲制作中的主要菌群[3]。除了来自原料和大曲中的微生物区系会为发酵酒醅提供复杂的微生物菌群,在窖池发酵阶段,窖池窖泥也是丰富微生物结构的关键来源。目前对于窖泥微生物的研究已经较为完善,其中,Chen等人在对窖底窖泥和窖壁窖泥中的细菌区系进行比较研究时发现,无论是窖壁泥还是窖底泥,厚壁菌门(Firmicutes)都是优势菌群,其丰度大于70%,紧接着是广古菌门(Euryarchaeota),拟杆菌门(Bacteroidetes),互养菌门(Synergistetes),放线菌门(Actinobacteria)和放线菌门(Actinobacteria),另外,线性判别分析效应大小(LEfSe)分析表明,乳酸菌在窖底泥中的相对丰度显著高于窖壁泥,典型对应分析(CCA)也表明窖泥中的细菌群落与速效磷含量和pH显著相关[4];孟雅静等人对新老窖池的池壁泥和池底泥进行了真核菌群的结构分析,说明了老窖池底泥真菌含量非常少,新老池壁泥真菌组成较为相似[5]; Zhang等人也对浓香型白酒的老窖池和新窖池窖底泥的原核群落结构和理化性质进行了调查研究,认为无论新老窖池,窖底泥在垂直深度有组成差异,但水平位置无差异,并且冗余分析(RDA)阐明了乳酸(LA)、pH和可溶性Ca2+是最重要的环境因子,也是窖底泥微生物区系生长的最关键条件[6]。
尽管已有部分研究阐明了堆积酒醅发酵时期微生物的演替过程,指出目前浓香型酒醅中的优势菌群有乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)及片球菌属(Pediococcus)等[7],但因地理位置差异等原因,不同浓香型白酒的风味和微生物区系差异较大。本研究利用高通量测序手段,对山东百脉泉酒业有限公司浓香型白酒整个发酵过程中的酒醅微生物群落的α-多样性、β-多样性进行了探究,以期揭示造成白酒的风味物质丰富的微生物群落的演替关系,为浓香型酒醅发酵工艺的改进提供理论基础,促进工艺革新。
1 材料与方法
1.1 酒醅样本
选取连续正常生产20年左右的窖池,50 d发酵周期间隔取样(第0、5、10、20、30、40、45、50 d),在窖池的上层(距窖顶0.5 m)、中层(距窖底1.5 m)、下层(距窖底0.5 m)酒醅按对角线两点及中间点三点各取样300 g后混合作为代表样品,将代表样品平均分为两份,分别装入预先准备好的无菌袋,用于高通量测序。本实验总共选择酒醅代表样本24个,采样后迅速置于实验室-80 ℃冰箱中保存。
1.2 仪器与试剂
Miseq-PE-250高通量测序仪,Illumina公司(美国);高速冷冻离心机,赛多利斯公司(德国);-80 ℃冰箱,赛默飞世尔公司(中国)。
FastDNA Spin Kit for Soil,联立信生物技术有限公司(北京);引物,生工生物有限公司(上海);高通量测序试剂,Roche公司(美国);Buffer、Mgcl2、Taq酶、Marker及色谱标准品等试剂均购自索莱宝科技有限公司(北京)。
1.3 方法
1.3.1 样品总DNA提取和测序
参照提取说明书,用FastDNA Spin Kit for Soil试剂盒提取酒醅样品的总DNA;用分光光度计测量260 nm处的吸光度来定量DNA浓度,用琼脂糖凝胶电泳来鉴定纯度。
根据王艳丽等人对16SrRNA测序区V3-V4和V4测序对样本群落演替的影响[8],为了得到更多的OTUs,本研究选用通用引物520F(5’-AYT GG G YDT AAA GNG-3’)和802R(5’-TAC NVG GGT ATC TAA TCC-3’)扩增16SrRNA基因的V4区。PCR扩增、上机测序及测序文库的构建均委托广州基迪奥生物科技有限公司完成。
1.3.2 高通量测序数据处理
采用QIIME管道(1.8.0版)软件对原始数据进行处理。筛选出质量较差的序列,然后用UCHIME方法检测并剔除掉嵌合序列,得到有效序列;之后,将有效序列以97%的同源性聚类为可操作分类单元(OTUs),通过BLAST搜索Silva数据库V119提取并注释每个OTU的代表性序列。记录每个OTU的丰度和这些OTU的分类,丢弃样本中包含的总序列少于0.001%的OTU。利用QIIME计算群落的α-多样性,如Coverage指数,Chao1指数,Ace指数和Shannon指数等。样本的β-多样性分析用来比较不同酒醅样品的微生物群落组成。Graphpad 5被用来绘制门和属的含量条形图。
2 结果和讨论
2.1 样本序列的有效性分析
在经过QIIME管道筛选后,24个酒醅样本共得到1 735 298条有效序列,每个样品测序深度平均达到72 304条。稀疏曲线用来反映分类学的完成程度,说明样本的测序数据量是否合理[9]。由图1可见,当测序深度超过30 000条时,所有曲线趋于饱和状态,表明本次酒醅样品鉴定出的序列准确有效,基于有效序列的α-和β-多样性可以较好地反映酒醅微生物群落信息。
2.2 微生物群落的α-多样性分析
基于样本有效序列的α-多样性分析可以反映生态系统群落的物种多样性和丰富度,常以样本覆盖率(Coverage),Shannon,Ace,Chao1和Simpson等指数来评价数据结果[10]。其中,Coverage指示测序深度是否可以代表样本中所有微生物群落,其值越接近于1,则表示测得的有效序列越能反映整个微生物群落的真实情况;Shannon和Simpson指数都被用来估算样品中微生物群落的物种多样性,Shannon指数越大,代表群落多样性越高,Simpson指数则相反;Ace和Chao1指数则被用来反映样本的丰富度,估计物种的总数,值越大,说明样本的丰度越大。表1反映了随着酒醅发酵时长增加,α-多样性指数的变化情况。
如表1所示,在窖池酒醅上中下三层总共24个酒醅样本中,样本覆盖率均大于90.0%,表明所选样本的有效序列的测序深度较高,可以反应整个微生物群落的真实情况。从群落演替的角度来看,各层酒醅中的OTU数量整体上变化规律是一致的,即整体呈下降趋势,对不同层的酒醅而言,每个发酵阶段大体以下层酒醅OTU数量最高,中层酒醅略高于上层酒醅。对于群落的物种多样性来说,同层酒醅的Shannon指数随发酵时间大体呈现先升高再下降的趋势,这可能是因为随着发酵的进行,不断有微生物加入酒醅发酵,导致物种多样性升高,而当酒醅发酵进入中后期之后,乙醇和乳酸、乙酸等物质的含量上升,许多不耐酒精和酸的微生物随之消亡,导致多样性降低;而对于不同层酒醅,相同发酵天数的样本的Shannon指数以下层酒醅最高,其次是中层酒醅、上层酒醅,这是因为上层酒醅大多暴露于空气中,收集到的微生物多数来自裸露环境,而中层酒醅会有部分来自窖池壁泥的微生物参与发酵,下层酒醅的发酵微生物除了来自窖池壁泥和窖池底泥,黄水也是一大重要来源。物种多样性的变化趋势也可以从Simpson指数的变化大体读出,值得注意的是,因为算法的不同,Simpson指数最大值不会超过1,且值越小,代表物种多样性越高。对于群落的物种丰度来说,Ace指数和Chao1指数是衡量物种种类多少的重要指标。同层酒醅在发酵0~20 d时物种丰度呈现上升趋势,在30 d之后即下降,变化幅度较大,也暗示了发酵过程中微生物物种的变化较为明显;而在不同层酒醅中差异较小。
图1 样本稀释曲线
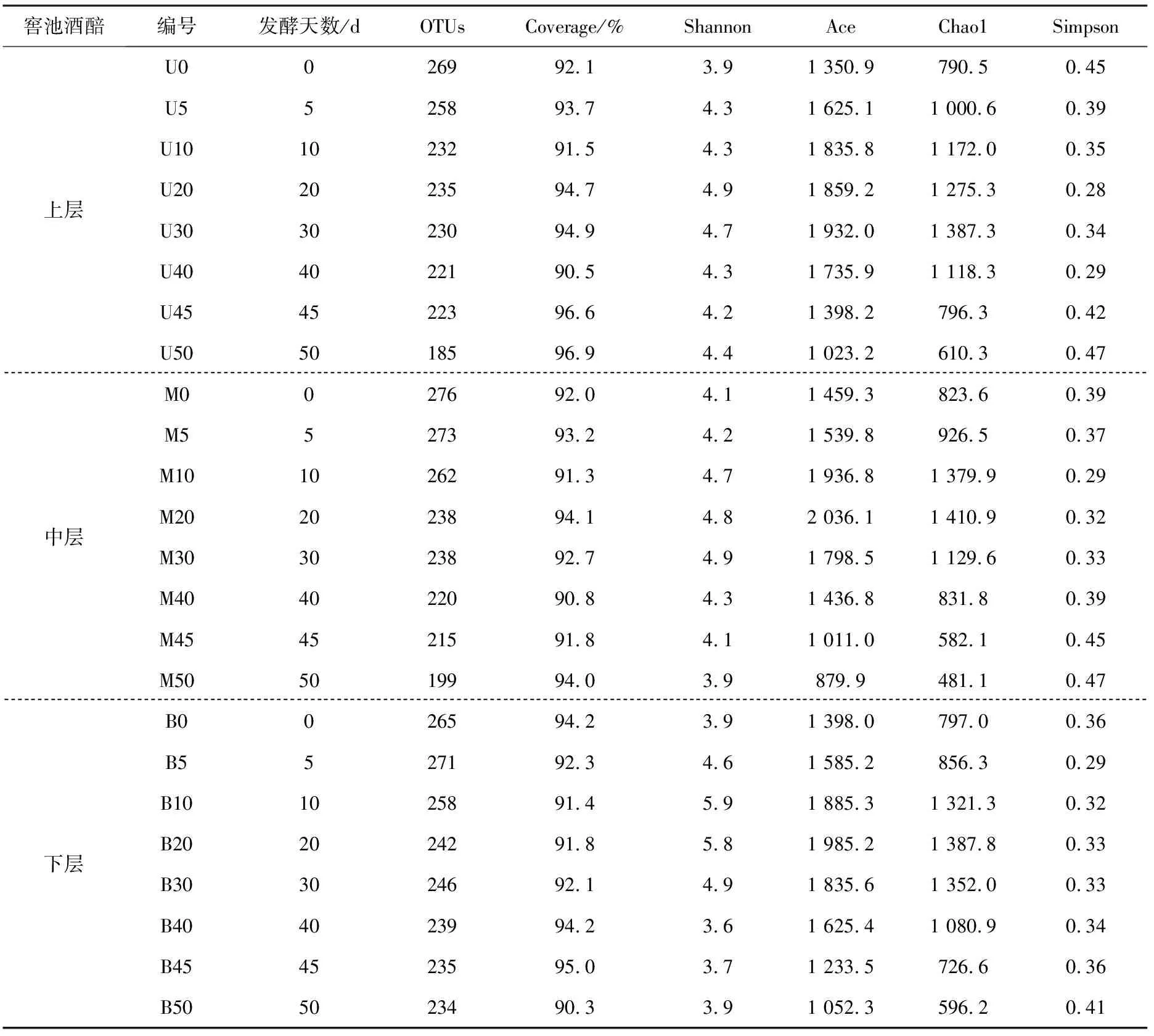
表1 酒醅样本α-多样性指数
因此,利用α-多样性分析手段对高通量测序的有效序列的OTUs进行研究,可以监测浓香型酒醅在窖池发酵过程中的微生物群落多样性和物种丰富度,掌握酒醅发酵的微生物群落演替规律。分析结果表明,对于同层酒醅,随发酵时间的变化,物种多样性和丰富度都呈现先上升再下降的趋势,而对不同层酒醅而言,发酵时间一定,物种多样性有较大差异,而物种丰富度差异不大。
2.3 微生物菌群结构组成
2.3.1 细菌菌群门水平结构组成
结合图2可以看到,在门水平上,共在24份样品中检测到5种相对丰度大于1%的菌门,包括厚壁菌门、变形菌门、拟杆菌门、放线菌门和蓝细菌门,另外如绿弯菌门,酸杆菌门,广古菌门等相对丰度小于1%的菌门,在图中被归类为其他菌门。从图中可以看出,在同层酒醅的发酵初期,厚壁菌门和变形菌门相对丰度较高,但随着发酵时间延长,厚壁菌门的比例迅速升高,并在中后期趋于稳定,成为绝对优势菌群;变形菌门、拟杆菌门、放线菌门和蓝细菌门相对丰度随发酵时间比例迅速下降,并在中后期丰度小于1%。相同发酵时间,不同酒醅中细菌菌群的相对丰度差异不大。
2.3.2 细菌菌群属水平结构组成
由图3可知,在24个样本中总共检测到被鉴定出的相对丰度大于1%的细菌菌属10个,另外相对丰度不足1%的和未被鉴定出的菌属被归类于其他菌属。10个优势菌属分别为乳杆菌属、芽孢杆菌属、魏斯氏菌属、梭菌属、醋杆菌属、链霉菌属、丛毛单胞菌属、片球菌属、瘤胃球菌属、克罗彭斯特菌属。在不同层酒醅中,各优势菌属所占比例有波动,但总体差距不大;在同层酒醅中,发酵前期以芽孢杆菌为主要优势菌群,中后期以乳杆菌为绝对优势菌群,未鉴定菌群及其他菌属也占据相当比例。乳酸菌是存在于酒醅发酵中后期的优势菌种,主要来自于片球菌属和乳杆菌属,其主要功能是发酵产生乳酸。作为白酒发酵中的一种重要风味物质,乳酸不仅可以减少白酒的刺激感,增加酒体的醇厚感,它还可以与乙醇反应生成乳酸乙酯[11]。乳酸乙酯能增加酒体的醇甜感,是浓香型白酒的主要香味物质。发酵前期的芽孢杆菌可以分泌多种水解酶,有效利用大曲和酒醅等原料的利用率,为提升白酒风味发挥重要作用。魏斯氏菌也是乳酸菌的一种,对于白酒中的多种有机酸、酯类及短链脂肪酸等风味物质的合成有重要作用,在前中期丰度较高,这可能是因为它来自大曲,在酒醅发酵过程中逐渐减少[12]。梭菌属中的微生物能够将淀粉、蛋白质和嘌呤等有机物分解为丁酸、己酸等有机酸,醇类、CO2/H2等物质,丰富浓香型白酒的风格[13]。醋杆菌属能够发酵产生己酸、乳酸、丁酸等风味物质的前体物质,链霉菌属能够产出淀粉酶、纤维素酶和蛋白酶等水解酶,有利于酒精度和出酒率的提高,两种菌属均为酒醅发酵过程中的重要微生物。丛毛单胞菌属和瘤胃球菌属中的微生物可以降解发酵谷物中的原料,为其他微生物的生长提供碳源,也可以参与有机酸的形成[14]。克罗彭斯特菌属也是浓香型酒醅发酵过程中的重要的产酯微生物[15]。
2.4 总结
作为世界六大蒸馏酒之一,中国白酒在世界上享誉盛名。中国浓香型白酒的酿造过程是由多种微生物共同推动的,这些微生物主要以细菌为主,细菌会产生多种代谢产物,这些风味物质组成浓香型白酒协调、醇厚的风味。本研究发现,在上、中、下三个方位的浓香型发酵酒醅中,优势菌属有乳杆菌属、芽孢杆菌属、魏斯氏菌属、梭菌属、醋杆菌属、链霉菌属、丛毛单胞菌属、片球菌属、瘤胃球菌属、克罗彭斯特菌属。来自各菌属的多种微生物如乳酸菌、芽孢杆菌、魏斯氏菌、醋杆菌可以产生乳酸、乙酸、丁酸等物质,可以与醇类物质生成多种酯类物质,极大地丰富浓香型白酒的风味风格。
