野生稻近等基因系应答低温胁迫的生理生化指标分析
2021-08-16曾智驰章司晨石小翠陈保善李文兰
曾智驰 章司晨 石小翠 陈保善 李文兰

摘 要: 為了解水稻耐冷的生理机制,该文以野生稻近等基因系耐冷水稻品种DC907和其不耐冷受体亲本9311为材料,通过对水稻幼苗低温胁迫处理,检测分析了丙二醛(MDA)、超氧阴离子(O2-)、可溶性糖以及抗氧化酶类[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)]等生理生化指标的变化,并采用隶属函数法综合评价两个品种的耐冷能力。结果表明:(1)O2-产生速率、MDA含量和可溶性糖含量都随着低温胁迫时间增加而逐渐升高,在低温胁迫过程中9311的MDA含量和O2-产生速率均高于DC907,在低温胁迫后期DC907的可溶性糖含量显著高于9311。(2)在低温胁迫过程中,DC907的抗氧化酶(CAT、POD、SOD和APX等)活性均高于9311,其中CAT、POD随低温胁迫时间增加酶活性增强,SOD和APX随低温胁迫时间增加呈现先降低后升高的趋势。(3)这些生理指标的隶属函数值排序与平均隶属函数值排序一致,说明这些指标与水稻的耐冷性密切相关。从隶属函数值综合评价的结果看出,DC907的耐冷能力比9311强,与大田观测结果相符。
关键词: 水稻, 低温胁迫, 生理指标, 丙二醛, 超氧阴离子, 抗氧化酶, 隶属函数
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2021)05-0813-10
Physiological and biochemical indexes of response to low temperature stress in near isogenic lines of wild rice
ZENG Zhichi, ZHANG Sichen, SHI Xiaocui, CHEN Baoshan, LI Wenlan*
( State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources, College of Life Science and Technology, Guangxi University, Nanning 530004, China )
Abstract: In order to understand the physiological mechanism of cold tolerance in rice, the cold stress treatment of rice seedlings was carried out in a cold-tolerant near-isogenic line DC907 and its cold-tolerant receptor parent 9311 under simulated low temperature environment at 8 ℃ for 1, 3, 5 d. The changes of physiological and biochemical indexes such as malondialdehyde (MDA), superoxide anion (O2-), soluble sugar and antioxidant enzymes [superoxide dismutase (SOD), peroxidase (POD), catalase (CAT) and ascorbic acid peroxidase (APX)] during cold stress were detected and analyzed. The cold tolerances of the two varieties were evaluated comprehensively by membership function method. The results were as follows: (1) The rate of O2- production, MDA content and soluble sugar content increased with the increase of low temperature stress time, and the contents of MDA and soluble sugar in the process of low temperature stress were significantly different from those in the control group. The content of MDA and O2- production rate of 9311 were higher than those of DC907 during low temperature stress, and there were significant differences in MDA contents between the two cultivars at the late stage of low temperature stress. The soluble sugar content of DC907 was significantly higher than that of 9311 at the late stage of low temperature stress. (2) During low temperature stress, the activities of antioxidant enzymes (CAT, POD, SOD and APX) of DC907 were higher than 9311, and the activities of CAT and POD increased with the increase of cold stress time. SOD and APX activities decreased first and then increased with the increase of cold stress time. The results of physiological indexes showed that the cold tolerance of varieties was different. Among them, soluble sugar content, SOD, POD, CAT and APX activities were positively correlated with plant cold tolerance; and the accumulation of MDA and O2- was negatively correlated with plant cold tolerance. (3) The order of membership function values of these physiological indicators is consistent with that of average membership function values, which indicates that these indicators are closely related to cold tolerance of rice. According to the result of comprehensive evaluation of membership function value, the cold resistance of DC907 is better than 9311, which is consistent with the field observation results.
Key words: rice, low temperature stress, physiological index, malondialdehyde, superoxide anion, antioxidant enzymes, membership function
野生稻是我国重要的作物资源,蕴藏着丰富的遗传多样性和许多栽培稻不具有的优良特性,可从中开发出具有重要利用价值的基因(陈成斌,2016)。广西境内分布的普通野生稻资源丰富,本重点实验室目前已经从优异的广西普通野生稻耐冷性资源中鉴定出一批苗期耐冷性QTLs,通过构建普通野生稻核心种质,从核心种质中抽取两份遗传差异性最大、耐寒性强的普通野生稻供体、以已测序的籼稻9311为受体,通过连续回交和SSR标记辅助选择进行普通野生稻全基因组DNA单片段代换系库构建,构建了两个完整覆盖全基因组的代换系库。利用耐冷QTLs代换系群体作图,已成功定位了多个耐冷QTLs。对产量性状和植物学性状的系统观察发现,源于野生稻的耐冷QTLs代换系与受体亲本9311没有显著差异(郑加兴等,2011)。其中,耐冷品种DC907是以强耐冷的野生稻DP30为供体亲本,籼稻9311为受体亲本,杂交后与轮回亲本9311连续回交,经筛选得到的农艺性状优良的耐冷性良好并稳定的近等基因系,遗传背景与轮回亲本9311基本一致(郑加兴等,2011;李容柏等,2013;覃宝祥等,2015)。耐冷性近等基因系的获得,为研究耐冷基因的生理机制和分子机理提供了适当的材料,为水稻耐冷育种利用提供了可靠的物质基础。
冷害是水稻生产中的一大限制因子。据报道,全世界有超1 500万hm2的稻作面积受到低温冷害,共有24个国家存在严重的水稻低温冷害问题,我国水稻种植地域广,从53°27′ N至18°90′ N间均有种植,但在生产稻谷的所有地区几乎都会受到不同程度的低温冷害,全国灾年每年要损失稻谷50亿~100亿kg(戴陆园等,2002)。目前,水稻耐冷的分子研究基本处于基因定位阶段(Fujino & Matsuda,2010;Ji et al.,2009;Iwata & Fujino,2010;Fujino & Sekiguchi,2011;Zhou et al.,2010;Yoshinobu,2001),低温胁迫下水稻体内生理生化的变化特征研究报道较少(邓久英等,2009)。因此,开展野生稻耐冷近等基因系的耐冷生理生化机理研究,可为进一步研究水稻耐冷分子机制奠定基础,也为改良水稻品种的耐冷性和培育耐冷水稻品种提供理论依据。单一的生理指标在反应植物抗逆性方面具有局限性,平均隶属函数值可用于多指标的综合评价,对于反映植物的抗逆性更为合理准确(魏永胜等,2005;韩瑞宏等,2006;张文娥等,2007;Park et al.,2010;Yang et al.,2012;Chen et al.,2014)。本研究比较了各项生理指标在低温胁迫下的变化差异,并通过隶属函数分析了各指标的隶属函数值与平均隶属函数值的相关性,合理评价了与水稻耐冷性相关的生理指标,旨在阐明水稻幼苗的耐冷生理基础。
1 材料与方法
1.1 材料
供试水稻品种:野生稻近等基因系耐冷DC907和其不耐冷亲本9311,由广西大学亚热带农业生物资源保护与利用国家重点实验室提供。
1.2 试验方法
供试水稻种子用1‰的多菌灵浸泡12 h,蒸馏水反复冲洗后置于28 ℃恒温培养箱中催芽。采用水培方式在阳光温室中进行幼苗的培养。每个品种设3个冷处理组(冷处理1、3、5 d)和一个对照组(常温培养),每组设3次重复。水稻进入三叶一心期后,把每个品种的3个处理组在特定的时间点(离实验结束点1、3、5 d)置于人工气候箱中进行冷处理培养(8±0.5) ℃,光照为3 000 lx(12 h·d-1)。冷处理1、3、5 d后,分别取处理组和对照组水稻幼苗最上部全展功能叶,测定其MDA含量、O2-产生速率、可溶性糖含量、SOD活性、POD活性、CAT活性、APX活性等生理指标。
1.3 生理指标的检测
用硫代巴比妥酸法测定丙二醛的含量,用蒽酮硫酸法测定可溶性糖的含量,用氮蓝四唑光还原法测定超氧化物歧化酶的活性,用愈创木酚法测定过氧化物酶的活性,用过氧化氢法测定过氧化氢酶活性。其中抗坏血酸过氧化物酶APX活性的测定参照Nakano & Asada(1981)的方法略加以改进,超氧阴离子的测定方法参照王爱国等(罗广华等,1990)的方法略加以改进,其他项目的测定方法参照李合生(2000)的方法略加以改进。
1.4 数据处理
采用Excel处理数据和制表,使用Origin 2019软件进行绘图,使用SPSS 19软件进行数据分析。隶属函数公式如下:
Uij=Xij-XminXmax-Xmin(1)
Uij=1-Xij-XminXmax-Xmin(2)
Ui=1nnj=1Uij(3)
式中:Ui是隶属函数值;Xij为不同测量生理指標在不同处理时间段下3个重复的均值;Xmin为3个重复中的最小值,Xmax为3个重复中的最大值。生理指标与耐冷性呈正相关,则使用隶属函数(1)进行计算;若生理指标与耐冷性呈现负相关,则使用反隶属函数(2)进行计算。
2 结果与分析
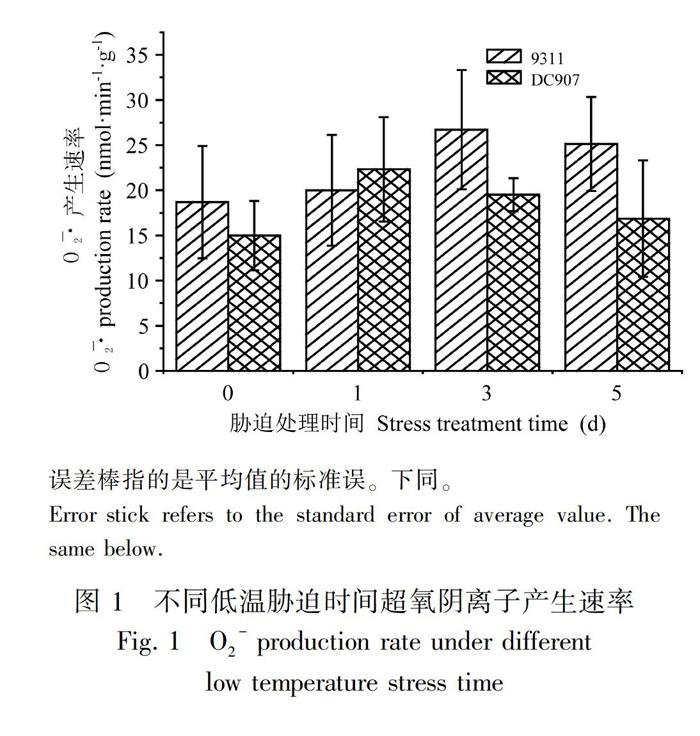
2.1 低温胁迫下超氧阴离子产生的速率变化
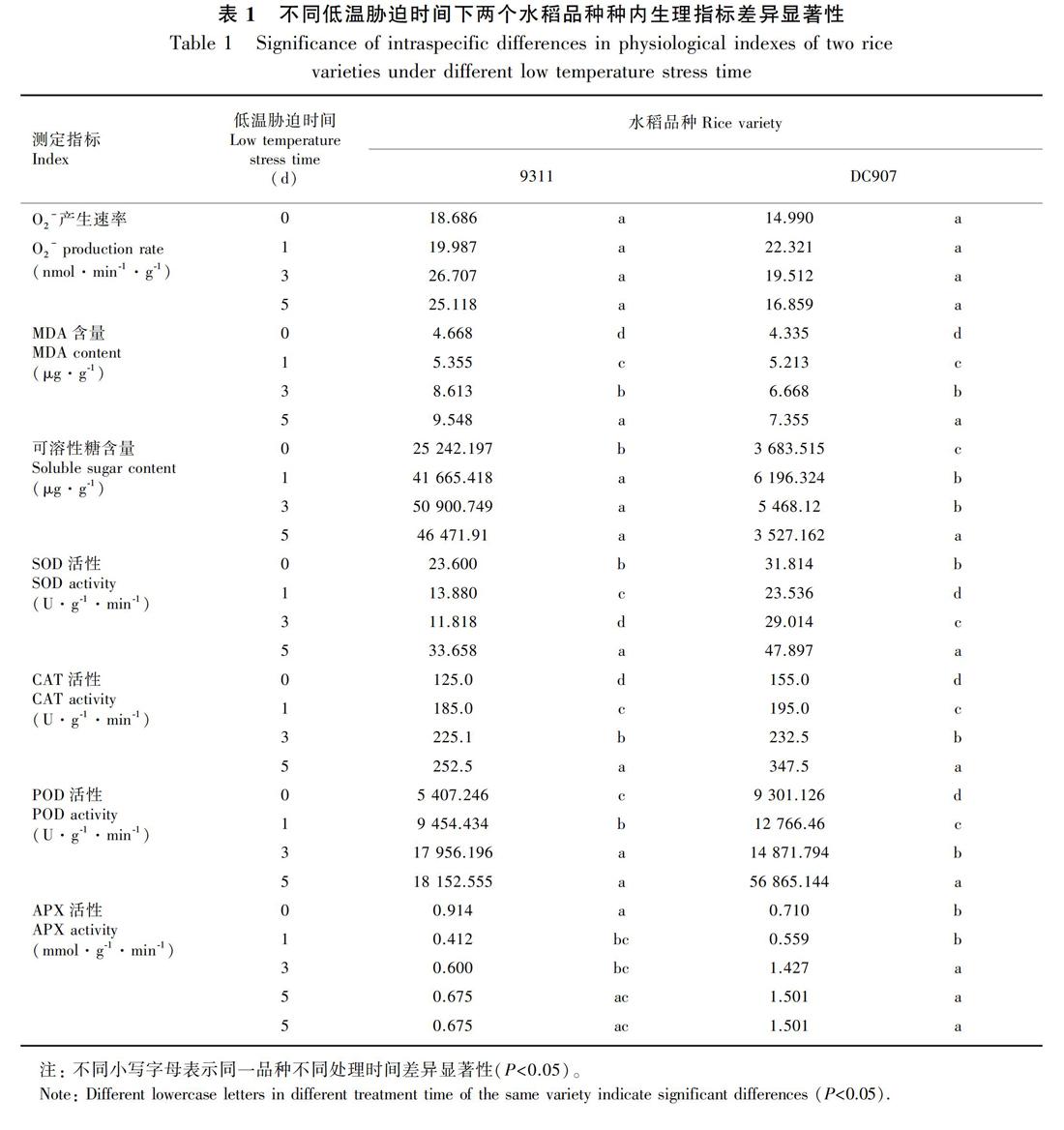
超氧阴离子能引起脂质的过氧化反应,破坏植物细胞的生物膜结构,并能与蛋白质、核酸等活性物质直接发生反应,使蛋白质交联,破坏核酸结构,从而改变细胞的功能。正常情况下,超氧阴离子的产生与清除处于平衡状况,只有在植物遭遇外界胁迫时,超氧阴离子才会处于失衡状态(Bolwell et al.,2002;Vranova et al.,2002)。因此,O2-的产生速率大小可以反映植物的受胁迫程度。从图1可以看出,随着低温处理时间的增加,DC907和9311的O2-的产生速率均呈先上升后下降的趋势,但两者O2-的产生速率发生变化的时间和变化的幅度有所不同。DC907在低温胁迫1 d后,O2-的产生速率达到最大值,随后开始下降。而在9311中,从低温胁迫开始,O2-的产生速率持续上升,在3 d时达到最大值,随后稍有下降。方差分析显示,在低温处理的各个时间段内,两个品种的种内、种间O2-产生速率不存在显著差异(图1、表1),但由于在低温胁迫后期9311的O2-产生速率高于DC907,因此可在一定程度上说明DC907在低温胁迫后期受O2-的伤害程度小于9311。
2.2 低温胁迫下MDA含量变化
MDA是膜质过氧化的最终产物,能与蛋白质结合引起蛋白质分子内和分子间的交联,改变这些蛋白质的空间结构(孙昌祖和刘家琪,1998;李海林等,2006;Pamplona,2011)。MDA含量的变化,不仅反映了生物膜的受损程度,也反映了细胞内功能的受损程度。低温胁迫会导致MDA的累积,因此MDA的含量也常常被作为一种压力标记(Bhattacharjee,2014)。从表1和图2可以看出,在整个低温胁迫过程中9311的MDA含量均高于DC907,随着低温胁迫时间的增加,DC907和9311的MDA含量变化趋势相同,为同步显著增加状态,但两者MDA含量的增幅和含量高低有所不同,从图2可以看出,从低温胁迫第3天开始,9311中的MDA含量要显著高于DC907。说明随着低温胁迫时间的增加水稻的氧化损伤程度增大,導致植物体的MDA含量增加,低温胁迫对9311的损伤程度要大于DC907。
2.3 低温胁迫下可溶性糖含量变化
可溶性糖是细胞的渗透调节物质,其含量的增加不仅可以提高细胞保水能力,而且还能保护细胞不耐冷性蛋白质(Park et al.,2010;李彦奇等,2012;宋吉轩等,2015)。其可能参与植物的损伤修复,在保护细胞完整性方面扮演重要角色(赵振宁和赵宝勰,2018)。因此,其含量的高低可以反映植物的抗低温胁迫的能力。从图3可以看出,随着低温胁迫时间的增加,两个水稻品种的可溶性糖含量都呈现上升趋势,在低温胁迫5 d中含量最高。值得关注的是,9311在低温胁迫5 d与胁迫3 d相比呈现下降趋势,而DC907随胁迫时间增加,可溶性糖含量一直呈现显著的升高。9311和DC907在对照组中的可溶性糖含量并无显著差异(9311略高于DC907),但在低温胁迫5 d后两者表现出了显著的差异,并且DC907中可溶性糖的含量要显著高于9311。因此,可推测可溶性糖含量上升与DC907的耐冷性有很大的关联,其在DC907的低温胁迫后期的耐冷方面发挥着重要的作用。
2.4 低温胁迫下抗氧化酶系活性的变化
活性氧是植物体内的一种重要的信号调节物质,在低温胁迫过程中会在植物体内大量累积,导致细胞氧化损伤最终植物死亡(You & Chan,2015)。在植物体内存在大量与活性氧清除相关的酶,其中包括SOD、CAT、POD和APX等几种酶,这些抗氧化酶可分别使O2-和H2O2等转变为活性较低的物质,降低或消除了其对膜脂的攻击能力,使膜脂不发生过氧化作用从而得到保护。它们协同作用能将活性氧维持在一个较低的水平,保护细胞免受氧化损伤,同时,也是植物细胞中防御外界氧化胁迫和植物本身活性氧代谢的重要抗氧化酶类(罗广华等,1990;王国骄等,2015)。SOD、POD、CAT、APX等抗氧化酶系活性水平的高低,可反映出细胞清除活性氧的能力,也可反映出细胞抵御外界胁迫的能力。其活性越高,清除活性氧的能力越强,对水稻幼苗的保护作用就越大,反之则越小(邓久英等,2009)。
2.4.1 低温胁迫下SOD活性变化 SOD是超氧自由基清除剂,被发现是植物体内唯一能把O2-还原为H2O2,同时将O2-氧化为O2的抗氧化酶(Noctor et al.,2014),在一定逆境条件下其活性升高以增强植物的抗逆能力。从图4:A中可以看出,随着低温胁迫时间的增加,9311和DC907中的SOD活性都呈现出先下降后上升的趋势,并且在低温胁迫5 d中活性最高。9311和DC907低温胁迫5 d与对照组相比,SOD活性都有明显的升高。并且从图4:A中还可以发现,在整个低温胁迫过程中DC907中的SOD活性显著高于9311。从低温胁迫后SOD的活性变化看,DC907的耐冷性要高于9311。
2.4.2 低温胁迫下CAT的活性变化 由表1和图4:B显著性分析结果可知,随着低温胁迫时间的增加无论种间还是种内DC907和9311的CAT活性均呈现显著上升。从图4:B中可以看出,随着低温胁迫时间的增加,DC907在低温胁迫5 d时CAT活性升高幅度较大,高于9311,并达到显著差异。由此可推测,CAT活性与低温胁迫后DC907的耐冷能力有一定的相关性。
2.4.3 低温胁迫下POD活性的变化 POD是一种含铁的蛋白酶,在植物耐冷中具有重要作用。有研究发现在低温胁迫过程中香蕉中表现出POD诱导表达,通过参与减少脂质过氧化保持叶细胞水势来增加耐冷性(Zhao et al.,2015)。从图4:C可以看出,随着低温胁迫时间的增加,DC907和9311的POD活性在3 d前均呈现缓慢上升的趋势,在低温胁迫5 d中DC907中POD活性大幅升高,显著高于9311,而9311中的POD活性没有明显变化。因此可推测,POD活性的大幅升高对DC907耐冷性方面起到重要的作用。
2.4.4 低温胁迫下APX活性的变化 逆境环境中植物会累积大量的氧化性物质包括过氧化氢(H2O2)在内的活性氧,抗坏血酸过氧化物酶(APX)能分解H2O2,认为其在植物抗逆过程中扮演重要角色。从图4:D中可以看出,在9311中,APX活性在低温胁迫过程中呈现先下降后恢复的趋势,并且在低温胁迫整个过程其APX活性都低于对照组。在DC907中,APX活性在低温胁迫1 d时下降,而随着胁迫时间增加,APX活性显著升高,低温胁迫3和5 d时APX活性均高于对照组。从图4中还可以得知,在低温胁迫后期(3和5 d时)DC907中APX的活性高于9311,且存在显著差异。APX主要存在于叶绿体基质和内囊体膜,DC907的APX活性高将有助在整个低温胁迫期间抵御外界冷害对叶绿体的损伤,对于维持其生理功能具有重要的意义,说明低温胁迫下DC907清除活性氧和抵抗叶绿体损伤的能力强于9311。
2.5 隶属函数值
由于MDA与O2-两个指标表征着生物膜的受损程度,与植物耐冷性呈负相关,因而采用反隶属函数进行分析。而其余5个指标(SOD、POD、CAT、APX和可溶性糖含量)均表征细胞抗损伤能力,与植物耐冷性呈正相关,采用隶属函数进行分析。单一的生理指标对于表达植物的抗逆性具有局限性(魏永胜等,2005;李彦奇等,2012;黄希莲等,2012),采用隶属函数分析方法在评价植物抗逆性方面更为准确(李贵全2006;张文娥等,2007),因此采用平均隶属函数值来综合评价水稻品种的耐冷性较为合理。由于DC907的平均隶属函数值较9311的高,根据隶属函数值综合评价两种水稻的耐冷能力强弱顺序为DC907 > 9311,与表型观测的实际情况相符(图5)。O2-产生速率、MDA含量、POD活性、APX活性等生理指标的隶属函数值排序与平均隶属函数值排序一致,说明这些指标与水稻的耐冷性密切相关(表2)。
3 讨论与结论
植物在它们的生命周期中可能面临各种非生物胁迫,例如低温、盐碱、干旱和重金属离子胁迫(Yang & Guo,2018)。这些非生物胁迫通常会导致渗透和氧化损伤,从而影响植物正常生长发育并且降低其产量(Liu et al.,2018)。低温胁迫能在水稻的种子萌发、形态发生、幼苗以及繁殖阶段对其造成不利影响,一般会使水稻代谢紊乱, 并且出现生长迟缓和繁殖能力降低现象,如果低温持续时间较长会导致植株最终死亡。可溶性糖是一种重要的渗透调节物质,其在水稻中的积累能缓解低温胁迫对植株造成的损伤。本研究中,在低温胁迫后水稻叶片可溶性糖含量增加,并且发现在低温胁迫5 d后,DC907中的含量显著高于9311,说明低温胁迫下水稻能通过增加可溶性糖含量来维持渗透压平衡。在低温胁迫过程中MDA和O2-的积累,能一定程度反映植物在胁迫过程中的损伤程度。本研究中,9311在随低温胁迫时间增加,其O2-产生速率要高于DC907,说明低温胁迫对9311造成的损伤要高于DC907。低温胁迫导致MDA含量显著增加,使膜受到损伤。其中在低温胁迫过程中水稻9311中的MDA含量要显著高于DC907,这在一定程度上反映DC907的耐冷性要高于9311。
在植物体内与抗氧化相关的酶系统通常位于不同部位,它们共同作用清除植物体内活性氧物质。SOD一般最早发挥作用,它能够将细胞内的超氧离子自由基还原为过氧化氢。低温会破坏CAT的动态平衡使得其酶活升高,其发挥了清除过量过氧化氢的作用(Noctor et al.,2014)。POD作为细胞内清除活性氧的重要酶,能催化H2O2与酚类的反应,起到清除过氧化物的作用,以抵御冷害对细胞的损伤。低温胁迫过程中POD活性始终处于上升趋势,有利于抵抗低温胁迫。DC907中APX则在低温胁迫的整个期间保持较高的活性,发挥清除H2O2的作用以减少膜脂的过氧化损伤,从而减少MDA的含量。作为参与细胞的渗透调节的可溶性糖,可能在维持蛋白质稳定方面起到重要作用,推测在低温胁迫过程中可溶性糖含量上升与DC907的耐冷性有很大的关联。本研究中,随着低温胁迫时间的增加,O2-产生速率与抗氧化酶系活性变化趋势相反,抗氧化酶活力低时,O2-产生速率就会增加,而当抗氧化酶系的活性增大时,清除植物体内的O2-,从而使O2-产生速率降低,这可能是抗氧化酶系中的SOD在发挥作用,因为SOD是防御超氧阴离子自由基对细胞伤害的抗氧化酶,其催化的歧化反应为2O2-+2H+→H2O2+O2,植物利用SOD以清除多余O2-。而H2O2活性较低,可进一步被CAT、POD、APX等分解。因此在受到低温胁迫时,水稻幼苗细胞中的抗氧化酶系通过提高活性而使所受到的氧化损伤程度降低。
互为近等基因系的这两个水稻品种在低温胁迫下上述几个生理指标的变化,可在一定程度上阐述了水稻幼苗的耐冷生理基础。根据隶属函数综合评价,DC907的耐冷能力要高于9311。
参考文献:
BHATTACHARJEE S, 2014. Membrane lipid peroxidation and its conflict of interest: The two faces of oxidative stress [J]. Curr Sci, 107(11): 1811-1823.
BOLWELL GP, BINDSCHEDLERLV, BLEE KA, et al., 2002. The apoplastic oxidative burst in response to biotic stress in plants: A three-component system [J]. J Exp Bot, 53: 1367-1376.
CHEN Y, JIANG JF, CHANG QS, et al., 2014. Cold acclimation induces freezing tolerance via antioxidative enzymes, proline metabolism and gene expression changes in two chrysanthemum species [J]. Mol Biol Rep, 41(2): 815-822.
CHEN CB, 2016. Wild rice resource and its utilization in breeding [J]. J Southern Agric, 35(4):274-278. [陳成斌, 2016. 野生稻资源在育种上的应用 [J]. 南方农业学报, 35(4): 274-278.]
DAI LY, YE CR, YU TQ, et al., 2002. Studies on cold tolerance of rice, Oryza sativa L. Ⅰ. Description on types of cold injury and classifications of evaluation methods on cold tolerance in rice [J]. SW Chin J Agric Sci, 1:41-45. [戴陆园, 叶昌荣, 余腾琼, 等, 2002. 水稻耐冷性研究Ⅰ. 稻冷害类型及耐冷性鉴定评价方法概述 [J]. 西南农业学报, 1: 41-45.]
DENG JY, CHEN GH, LIU B, et al., 2009. Progress on the studies of physiological and genetic mechanisms of cold tolerance in rice [J]. Guangdong Agric Sci, 5:25-28. [邓久英, 陈光辉, 刘斌, 等, 2009. 水稻耐冷生理和遗传机制研究进展 [J]. 广东农业科学, 5: 25-28.]
FUJINO K, MATSUDA Y, 2010. Genome-wide analysis of genes targeted by qLTG3-1 controlling low-temperature germinability in rice [J]. Plant Mol Biol, 72:137-152.
FUJINO K, SEKIGUCHI H, 2011. Origins of functional nucleotide polymorphisms in a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice [J]. Plant Mol Biol, 75:1-10.
HAN RH, LU XS, GAO GJ, et al., 2006. Analysis of the principal components and the subordinate function of alfalfa drought resistance [J]. Acta Agr Sin, 14(2):142-146. [韩瑞宏, 卢欣石, 高桂娟, 等, 2006. 紫花苜蓿抗旱性主成分及隶属函数分析 [J]. 草地学报, 14(2): 142-146.]
HUANG XL, LUO C, SONG LS, 2012. Influence of low temperature stress on the physiological and biochemical indices of cold-resistance on 9 hedge in Guiyang [J]. Guangdong Agric Sci, 2:47-50,59. [黄希莲, 罗充, 宋丽莎, 2012. 低溫胁迫对贵阳市9种绿篱植物抗寒性生理生化指标的影响 [J]. 广东农业科学, 2: 47-50, 59.]
JI SL, JIANG L, WU H, et al., 2009. Quantitative trait loci mapping and stability for low temperature germination ability of rice [J]. Plant Breed, 128:387-392.
LIU Y, XU C, ZHU Y, et al., 2018. The calcium-dependent kinase OsCPK24 functions in cold stress responses in rice [J]. J Integr Plant Biol, 60(2):173-188.
NAKANO Y, ASADA K, 1981. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant Cell Physiol, 22(5): 867-880.
IWATA N, FUJINO K, 2010. Genetic effects of major QTLs controlling low-temperature germinability in different genetic backgrounds in rice (Oryza sativa L.) [J]. Genome, 53:763-768.
LI GQ, ZHANG HY, JI L, et al., 2006. Comprehensive evaluation on drought resistance of different soybean varieties [J]. Chin J Appl Ecol, 17(12): 2408-2412. [李贵全, 张海燕, 季兰, 等, 2006. 不同大豆品种抗旱性综合评价 [J]. 应用生态学报, 17(12): 2408-2412.]
LI HL, YING XM, LONG XJ, 2006. Effects of chilling stress on physiological and biochemical indexes of chill-resistance in rice seedlings [J]. Anhui Agric Sci Bull, 11: 50-53. [李海林, 殷绪明, 龙小军, 2006. 低温胁迫对水稻幼苗抗寒性生理生化指标的影响 [J]. 安徽农学通报, 11: 50-53.]
LI HS, 2000. Principles and techniques of plant physiological and biochemical experiments [M].Beijing: Higher Education Press: 164-168, 195-196, 260. [李合生, 2000. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社:164-168, 195-196, 260.]
LI RB, ZHENG JX, CHEN BS, et al., 2013. Identification of major genes for cold tolerance and its special primers in rice (Oryza sativa L.) [P]. Application No: 201310164028.4 (China). [李容柏, 郑加兴, 陈保善, 等, 2013. 水稻耐冷主效基因鉴定方法及其专用引物[P]. 申请号: 201310164028.4(中国)]
LI YQ,YAO ZP, ZHANG H, et al., 2012. Effect of low temperature stress on physiological-biochemical indexes of three ephemeral species [J]. Xinjiang Agric Sci, 9:1608-1615. [李彦奇, 姚正培, 张桦, 等, 2012. 低温胁迫对三种早春短命植物生理生化指标的影响 [J]. 新疆农业科学, 9: 1608-1615.]
LUO GH, WANG AG, GUO JY, 1990. Effects of some exogenous factors on superoxide dismutase activity in soybean seedlings [J]. Plant Physiol J, 3(3): 239-244. [罗广华, 王爱国, 郭俊彦, 1990. 几种外源因子对大豆幼苗SOD活性的影响 [J]. 植物生理学报, 3(3): 239-244.]
NOCTOR G, MHAMDI A, FOYER CH, 2014. The roles of reactive oxygen metabolism in drought: not so cut and dried [J]. Plant Physiol, 164(4):1636-1648.
PAMPLONA R, 2011. Advanced lipoxidation end-products [J]. Chem Biol Interact, 192(1-2): 14-20.
PARK MR, YUN KY, MOHANTY B, et al., 2010. Supra-optimal expression of the cold-regulated OsMyb4 transcription factor in transgenic rice changes the complexity of transcriptional network with major effects on stress tolerance and panicle development [J]. Plant Cell Environ, 33(12): 2209-2230.
QIN BX, LIU LL, HAN FY, et al., 2015 Study on cold tolerance of chromosome segment substitution lines derived from wild rice (O. rufipogon) as donor at booting stage [J]. Genom Appl Biol, 6:1283-1289. [覃寶祥, 刘立龙, 韩飞怡, 等, 2015. 普通野生稻染色体片段代换系的孕穗期耐冷性研究 [J]. 基因组学与应用生物学, 6: 1283-1289.]
SONG JX, LI JH, LIU MR, et al., 2015. Effects of brassinosteroid application on osmotic adjustment and antioxidant enzymes in Leymus chinensis under drought stress [J]. Acta Pratac Sin, 24(8): 93-102. [宋吉轩, 李金还, 刘美茹, 等, 2015. 油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究 [J]. 草业学报, 24(8): 93-102.]
SUN CZ, LIU JQ, 1998. Effects of chilling stress on O2-, MDA membrane permeability, leaf water potential, protective enzyme of leaves in Populus cathayana Rehd [J]. J Inn Mongol For Coll, (3):32-36. [孙昌祖, 刘家琪, 1998. 低温胁迫对青杨叶片O2-,MDA,膜透性,叶水势及保护酶的影响 [J]. 内蒙古林学院学报, (3): 32-36.]
VRANOVA E, INZE D, VAN BREUSEGEM F, 2002. Signal transduction during oxidative stree [J]. J Exp Bot, 53: 1227-1236.
WANG GJ, WANG JY, MA DR, et al., 2015. Responses of antioxidant system to cold water stress in weedy and cultivated rice with different chilling sensitivity [J] Sci Agric Sin, 48(8): 1660-1668. [王国骄, 王嘉宇, 马殿荣, 等, 2015. 不同耐冷性杂草稻和栽培稻抗氧化系统对冷水胁迫的响应 [J]. 中国农业科学, 48(8): 1660-1668.]
WEI YS, LANG ZS, SHAN L, et al., 2005. Comprehensive evaluation on alfalfa drought-resistance traits by subordinate function values analysis [J]. Pratac Sci, 22(6):33-36. [魏永胜, 梁宗锁, 山仑, 等, 2005. 利用隶属函数值法评价苜蓿抗旱性 [J]. 草业科学, 22(6): 33-36.]
YANG A, DAI X, ZHANG WH, 2012. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice [J]. J Exp Bot, 63(7): 2541-2556.
YANG Y, GUO Y, 2018. Elucidating the molecular mechanisms mediating plant salt-stress responses [J]. New Phytol, 217(2):523-539.
YOSHINOBU T, 2001. Mapping quantitative trait loci controlling cool temperature tolerance at booting stage in temperate rice [J]. Breed Sci, 51(3):191-197.
YOU J, CHAN Z, 2015. ROS regulation during abiotic stress responses in crop plants [J]. Front Plant Sci, 6:1092.
ZHANG WE, WANG F, PAN XJ, 2007. Comprehensive evaluation on cold hardiness of vitis species by subordinate function (SF) [J]. J Fruit Sci, 24(6):849-853. [张文娥, 王飞, 潘学军, 2007. 应用隶属函数法综合评价葡萄种间抗寒性 [J]. 果树学报, 24(6): 849-853.]
ZHENG JX, MA ZF, SONG JD, et al, 2011. Identification andmapping of QTLs for cold tolerance at the seedling stage in common wild rice (Oryza rufipogon) [J]. Chin J Rice Sci, 1:52-58. [郑加兴,马增凤,宋建东,等, 2011. 普通野生稻苗期耐冷性QTLs的鉴定与分子定位 [J]. 中国水稻科学, 1: 52-58.]
ZHAO J, ZHANG S, YANG T, et al., 2015. Global transcriptional profiling of a cold-tolerant rice variety under moderate cold stress reveals different cold stress response mechanisms [J]. Physiol Plant, 154(3):381-394.
ZHAO ZY, ZHAO BX, 2018. Physiological response and drought resistance evaluation of different soybean varieties to drought stress at germination stage [J]. Agric Res Arid Areas, 36(2):131-136. [趙振宁, 赵宝勰, 2018. 不同大豆品种在萌发期对干旱胁迫的生理响应及抗旱性评价 [J]. 干旱地区农业研究, 36(2):131-136.]
ZHOU L, ZENG W, ZHENG WW, et al., 2010. Fine mapping a QTL qCTB7 for cold tolerance at the booting stage on rice chromosome 7 using a near-isogenic line [J]. Theor Appl Genet, 121:895-905.
(责任编辑 李 莉)
收稿日期: 2019-06-22
基金项目: 国家自然科学基金(31560247) [Supported by the National Natural Science Foundation of China(31560247)]。
作者简介: 曾智驰(1995-),硕士研究生,研究方向为植物分子生物学,(E-mail)474172656@qq.com。
通信作者: 李文兰,博士,教授,研究方向为植物逆境生理生化与分子生物学,(E-mail)liwenlan@whu.edu.cn。
