响应面优化榆黄蘑的液体发酵工艺
2021-08-16尚浩乐张少营杨宣宣冯蓉琴陈怀中包润泽谢朝晖
鲁 铁,尚浩乐,张少营,杨宣宣,冯蓉琴,陈怀中,包润泽,谢朝晖
(1.河南城建学院 生命科学与工程学院,河南 平顶山 467036; 2.平顶山健康食品协同创新中心,河南 平顶山 467036)
榆黄蘑(Pleurotuscitrinopileatus)隶属于伞菌目口蘑科侧耳属,又名金顶侧耳、金顶蘑、玉皇蘑,属木腐真菌,常生长于阔叶树的枯木之上,具有较强的分解木质素与纤维素的能力,是一种药食功能兼具的天然真菌[1]。其特点为菌盖呈草黄色至鲜黄色的光滑漏斗状,直径3~10 cm,菌肉白色,柄偏生,菌盖鲜黄、油亮[2]。该菌主要分布在东北、华北、华南、西藏等地。
榆黄蘑香味浓郁、味道鲜美,富含蛋白质、氨基酸、微量元素和矿物质,具有多种生理药理活性物质[3-4]。其中多糖是主要的活性成分之一[5],具有抗肿瘤、免疫调节、抗氧化、抗炎、抗衰老、降血糖[6]等生物活性,因此深受消费者青睐。研究发现榆黄蘑液体发酵菌球提取液能够明显增强小白鼠的体液免疫系统和细胞免疫功能[7],提取的胞外多糖能有效抑制体外S-180癌细胞[8],并能对CY有减毒作用,增强小鼠免疫功能[9]。榆黄蘑中含有8种必需氨基酸和12种微量元素且重金属含量较低,对人体危害较小[10]。
目前,榆黄蘑的人工栽培还处于起步阶段,榆黄蘑的报道主要集中在多糖的提取以及活性的测定方面。虽然可以通过人工栽培获得其子实体,但是人工栽培食用菌具有周期长、成本高的缺点。因此,研究榆黄蘑的液体发酵工艺能有效缩短培养周期,降低栽培成本。榆黄蘑液体发酵的研究较少,王伟曾对榆黄蘑的液体发酵条件进行了研究[11],对榆黄蘑碳源、氮源、无机盐的选择尚未见公开报道。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
试验所用菌种来源于平顶山健康食品协同创新中心,菌丝体通过长白山自然保护区二道白河镇野生子实体经组织分离获得。
1.1.2 试剂
木糖、酵母膏、葡萄糖、乳糖、无水乙醇、果糖、琼脂粉、蔗糖、过磷酸钙、麦芽糖、胰蛋白胨、可溶性淀粉、牛肉膏、硝酸铵、硝酸钾、氯化铵、磷酸二氢铵、磷酸二氢钾、磷酸氢二钾、氯化钾、硫酸钾、碳酸钙、维生素等。
1.2 仪器
Systec V-40型高压蒸汽灭菌锅;HWS-1000F型恒温培养箱;GZX-9023MBE型鼓风干燥箱;DLHR-D2802型恒温振荡器;SW-CJ-2F型洁净工作台。
1.3 试验方法
1.3.1 试剂和培养基的配制
PDA 斜面培养基(1 L):马铃薯200 g(煮汁)、葡萄糖20 g、琼脂粉20 g。
种子培养基(1 L):葡萄糖10 g、蔗糖10 g、酵母膏2 g、牛肉膏2 g、蛋白胨2 g、KH2PO42 g、MgSO41 g。
1.3.2 榆黄蘑菌丝干重的测定
将发酵得到的菌丝体经纯水冲洗后,使用100目筛绢过滤,置于鼓风干燥箱中55 ℃烘干至恒质量,精度0.01 g电子天平称质量[12]。
1.3.3 菌种活化和种子液的制备
菌种活化:将转接斜面保存的榆黄蘑接种到PDA培养基中,置于25 ℃的恒温培养箱中培养3~5 d,待其长满后接种。
种子液的制备:使用打孔器接入10块直径为1 cm的菌块,接入装液量100 mL于250 mL摇瓶种子培养基中,于25 ℃、150 r·min-1培养7 d[13]。
1.3.4 单因素试验
单因素液体发酵培养最佳单因素的筛选:按3个变量组合优化培养基,在基本培养基基础之上进行变量的考量,具体参考方案如下。
(1)在碳源单因素试验中,以碳源为变量,固定氮源和无机盐。碳源单因素分别为:C1葡萄糖、C2蔗糖、C3可溶性淀粉、C4木糖、C5乳糖、C6果糖、C7麦芽糖、C8不添加(对照组);每种碳源的质量浓度均为20 g·L-1。
(2)在氮源单因素试验中,以氮源为变量,固定碳源和无机盐。氮源的单因素分别为:N1胰蛋白胨、N2酵母膏、N3牛肉膏、N4硝酸铵、N5硝酸钾、N6氨化铵、N7磷酸二氢铵、N8不添加(对照组);每种氮源的质量浓度均为6 g·L-1。
(3)在无机盐单因素试验中,以无机盐为变量,固定碳源和氮源。无机盐的单因素分别为:W1磷酸氢二钾、W2磷酸二氢钾、W3氯化钾、W4硫酸钾、W5硫酸镁、W6碳酸钙、W7过磷酸钙、W8不添加(对照组);每种无机盐的质量浓度均为1 g·L-1。
单因素培养条件为25 ℃、150 r·min-1,培养6 d,生物学重复3次。以最大菌丝体产生量作为响应值对象筛选出三个因素的最优值[14]。
1.3.5 多因素试验
在单因素试验的基础上,筛选出对榆黄蘑生物量影响最为显著的碳源、氮源、无机盐,利用中心组合旋转设计(Box-Benhnken)法做响应面的研究,优化三个影响因素,拟合响应值方程,解得最佳配比,并预测最优结果。多因素试验结果使用Design-Expert 8.0程序进行分析。
试验过程中使用容量为250 mL的三角锥形瓶,装100 mL培养基,接种量5%的榆黄蘑菌种,摇床转速为150 r·min-1,培养一周,每组试验生物学重复3次。(注意试验前种子的制备)
1.3.6 出菇试验
使用多因素试验中的最佳培养配方对榆黄蘑菌种进行制备,将获得的发酵产物在无菌条件下接种至处理好的栽培袋中。栽培配方为棉籽壳75%、麦麸15%、玉米粉8%、石膏粉1%、蔗糖1%,培养料含水量为65%。培养料装袋121 ℃下高压灭菌2 h,制成培养袋,对其进行发菌、出菇试验[15]。
2 结果与分析
2.1 单因素试验结果
磷源、氮源、无机盐对菌丝体生物量的影响分别如图1~图3所示。
2.1.1 碳源对菌丝体生物量的影响
由图1可知,可溶性淀粉是榆黄蘑最佳的碳源,其菌丝体干重为3.83 g·L-1,可溶性淀粉对榆黄蘑菌丝体生长较有利(图中误差线均表示标准误差)。

图1 碳源单因素试验结果
2.1.2 氮源对菌丝体生物量的影响
由图2可知,牛肉膏是榆黄蘑最佳的氮源,其菌丝体干重为2.43 g·L-1,牛肉膏对榆黄蘑菌丝体生长较有利。
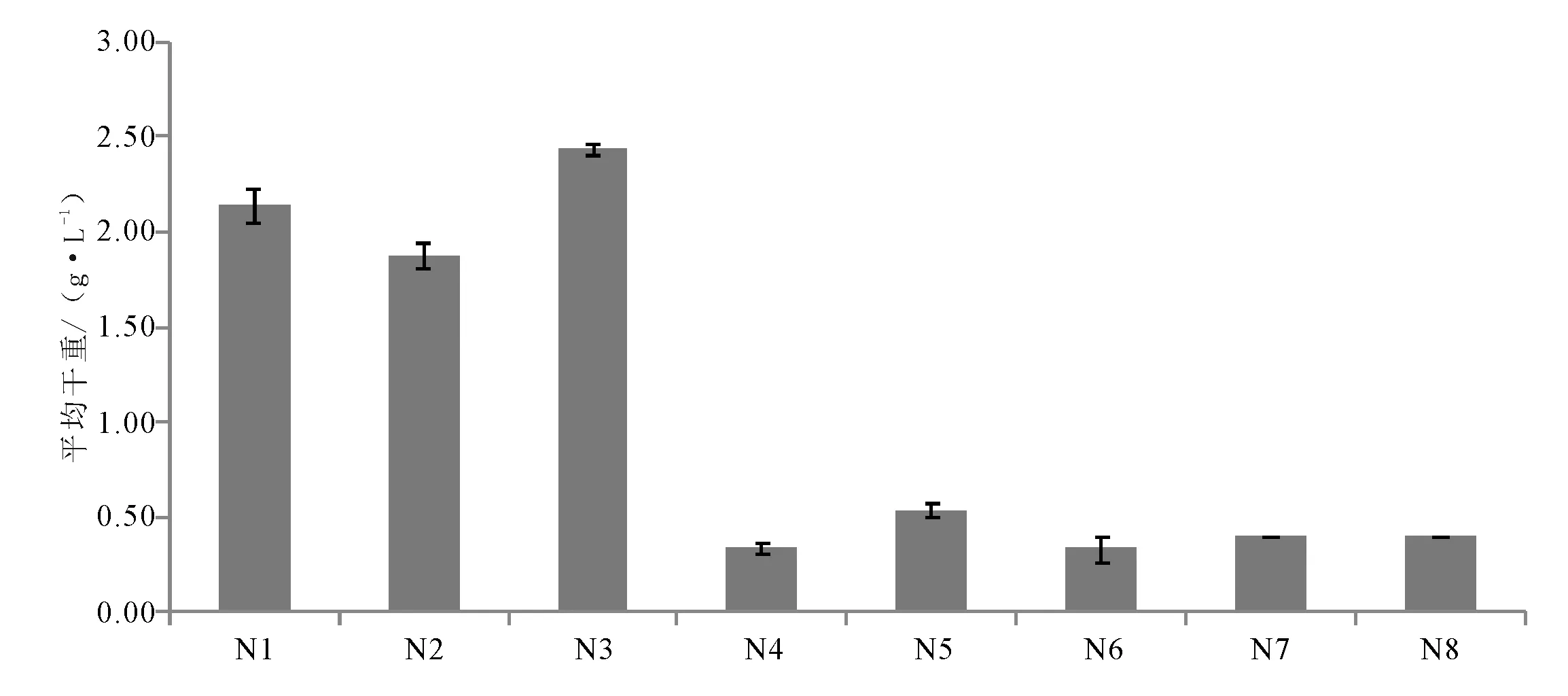
图2 氮源单因素试验结果
2.1.3 无机盐对菌丝体生物量的影响
由图3可知,碳酸钙是榆黄蘑最佳的无机盐,其菌丝体干重为2.80 g·L-1,碳酸钙对榆黄蘑菌丝体生长较有利。

图3 无机盐单因素试验结果
2.2 多因素响应面法优化培养基配方
根据单因素试验的结果,中心点设置为:碳源为可溶性淀粉、氮源为牛肉膏、无机盐为碳酸钙,响应面试验因素水平及编码如表1所示。依照此试验设计,进行3次水平试验,得到平均值,将数据导入Design-Expert 8.0软件,得到最终响应面结果如表2所示。

表1 响应面分析因素及水平

表2 响应面分析方案及试验结果
通过Design Expert 8.0 Trial软件对表3数据进行非线性回归的二次项拟合后,得到相应的回归方程:
Y=-6.185 31+0.285 82X1+4.936 94X2+3.144 0X3+4.444 44X1X2- 0.028 121 1X1X3-0.036 667X2X3-5.282 22X12-0.906 00X22-0.527 11X32
由模型中系数的显著性检验可知:碳源、氮源、无机盐的一次项对榆黄蘑菌丝体生长的影响达到极显著水平(P<0.01)[16];氮源与碳源、无机盐的交互作用均未达到显著水平;碳源与无机盐的交互作用达到极显著水平(P<0.01);三种因素的二次项均达到极显著水平(P<0.01)。由F值可知:各因素对榆黄蘑菌丝生长的影响依次为:氮源(B)>无机盐(C)>碳源(A);分析方差表明:此模型达到极显著水平(P<0.01),模型的失拟项不显著(P=0.889 5>0.05),说明该方程拟合良好。因此,各因素值和响应值之间的关系可以用此模型进行函数化,该回归方程可以对试验结果进行分析预测。
用Desing-Expert 8.0软件对二次多项式回归方程进行计算求解,得出适宜榆黄蘑生长的培养基的优化值为:可溶性淀粉22.09 g·L-1、牛肉膏2.73 g·L-1、碳酸钙2.30 g·L-1,菌丝体干重可达7.33 g·L-1。等高线和响应面图分别如图4~图6所示。
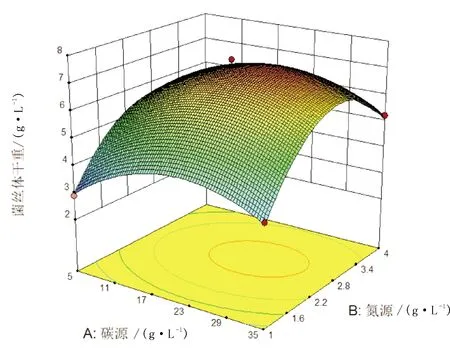
图4 可溶性淀粉和牛肉膏对榆黄蘑菌丝体产量影响的等高线和响应面图

图5 可溶性淀粉和碳酸钙对榆黄蘑菌丝体产量影响的等高线图和响应面图

图6 可溶性淀粉和碳酸钙对榆黄蘑菌丝体产量影响的等高线图和响应面图
2.3 验证试验
在最优条件下通过3次重复试验,测得实际榆黄蘑干重为7.20 g·L-1,其标准差为0.12,与理论偏差1.77%,计算得到RMSE为7.20,实际值与理论值基本相符,说明采用响应面法优化得到的培养基参数可靠,具有一定参考价值。
2.4 出菇试验结果
使用上述试验优化获取的液体菌种,接种量为每包10 mL,菌丝生长为白色、健壮,培养出的榆黄蘑如图7、图8所示。

图7 榆黄蘑子实体(正面)

图8 榆黄蘑子实体(背面)
3 结论
以榆黄蘑为研究对象,利用不同的培养基对其进行培养,并将菌丝干重作为响应值对其进行培养基优化。通过碳源、氮源、无机盐三个因素进行试验分析,最终得到榆黄蘑培养基最佳发酵条件。在此基础上选取每个单因素最佳的三个因子,基于响应面试验的中心组合法探索三者的交互效应,得到最佳培养基配方为:可溶性淀粉22.09 g·L-1、牛肉膏2.73 g·L-1、碳酸钙2.30 g·L-1,得到的菌丝体干重可达7.20 g·L-1。
以最佳的液体发酵培养条件制备出菌种进行榆黄蘑的栽培试验,栽培的榆黄蘑发菌速度快,且生长旺盛,适合进一步的推广应用。
