人羊膜间充质干细胞无血清培养方法的建立
2021-08-16刘晓玉潘伯臣庞希宁2
刘晓玉,施 萍,潘伯臣*,庞希宁2,*
(1.中国医科大学附属盛京医院 生殖医学中心,辽宁 沈阳 110004;2.中国医科大学 干细胞与再生医学研究室,辽宁 沈阳 110122;3.沈阳艾米奥生物工程技术研发中心有限公司,辽宁 沈阳 110015)
间充质干细胞具有自我更新,多向分化潜能及旁分泌作用,是组织工程重要的种子细胞[1]。人羊膜来源的间充质干细胞(human amnion mesenchymal stem cells,hAMSCs)取材于临床废弃的羊膜组织,同时具备易获得、可塑性强、低免疫原性、无伦理约束等优势,使其成为再生医学领域的研究热点[2],是临床上进行组织修复最理想的细胞选择,已有报道利用hAMSCs修复皮肤创伤,能够降低炎性反应,加速创伤愈合,同时减少瘢痕形成[3]。
hAMSCs大量培养扩增是其临床应用的前提条件。细胞培养环境是影响细胞增殖状态及临床应用效果的重要因素[4-5],体外细胞培养最常使用胎牛血清,而胎牛血清中含有大量未知的成分包括生长因子,免疫活性物质,等等,易引起免疫反应,具有一定的临床应用风险。因此,hAMSCs培养条件的安全性和标准化问题亟待解决[6-7]。本研究旨在建立一种hAMSCs的无动物源性成分培养方法,为其临床应用提供实验基础。
1 材料与方法
1.1 材料
人羊膜组织(中国医科大学附属盛京医院产科),该研究经中国医科大学伦理委员会批准(伦理审批号:AF-SOP-07-1.0-01),并且已经过患者知情同意。胎牛血清(FBS)和DMEM/F12培养基(Hyclone公司);两性霉素B、胶原酶、抗坏血酸(L-ascorbic acid)(Sigma-Aldrich公司)、碱性成纤维细胞生长因子(bFGF)(Peprotech公司);胰岛素(1 g/L)-转铁蛋白(0.55 g/L)-亚硒酸钠(0.000 67 g/L)(insulin-transferrin-selenium,ITS)和胰蛋白酶(Gibco公司);抗-CD90、-CD73、-CD34和-CD45抗体(Biolegend公司),WST-1细胞增殖及细胞毒性检测试剂盒(WST-1 Cell Proliferation and Cytotoxicity Assay Kit,上海碧云天生物公司);PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒和SYBR Premix Ex TaqTMⅡ试剂(TaKaRa公司)。
1.2 方法
1.2.1 hAMSCs的分离培养:取健康剖宫产羊膜,用冷0.9%氯化钠溶液清洗血迹,去除绒毛膜后剪切,取面积大小约25 cm2羊膜,置于含100 U/mL青链霉素及2.5 μg/mL两性霉素B的磷酸盐缓冲溶液(phosphate buffered solution,PBS)中浸泡20 min。取出剪碎后加入0.25%的胰蛋白酶,于37 ℃消化30 min;终止消化后清洗,1 mg/mL的Ⅳ型胶原酶37 ℃消化1 h;终止消化后细胞筛过滤,加入含有10% FBS,10 ng/mL bFGF,10 ng/mL EGF,100 U/mL青链霉素 及 2.5 μg/mL两性霉素B的 DMEM/F12培养基中[7],在37 ℃、5% CO2饱和湿度培养条件下常规培养。接种后24 h进行换液,倒置显微镜下观察细胞,达80%汇合时消化传代,加入DMEM/F12(含 1×ITS、0.5%人血清白蛋白、10 ng/mL bFGF、100 μg/mL L-ascorbic acid、100 U/mL青链霉素及2.5 μg/mL两性霉素B)的培养基中继续培养。
1.2.2 免疫荧光法检测鉴定hAMSCs:将处理好的盖片置入6孔板内,按2 × 105个/mL将ITS无血清培养的hAMSCs接种于盖片上。当hAMSCs达到70%~80%汇合时,利用4%多聚甲醛室温固定15 min,1 × PBS 洗涤后1% 牛血清白蛋白室温封闭30 min,一抗 (抗-CD90、-CD73、-CD34或-CD45抗体)孵育4 ℃ 过夜,1×PBS洗涤后二抗室温孵育1 h,DAPI染色,95%甘油封片,置于荧光显微镜下观察。
1.2.3 WST-1检测细胞增殖:将ITS无血清培养的hAMSCs胰蛋白酶消化后制备成单细胞悬液,以2 000个/孔浓度接种于96孔培养板中,第2天开始每天于同一时间点进行检测,检测方法:弃去培养液,PBS洗后更换新鲜培养液100 μL,然后每孔加入10 μL的WST-1,并在37 ℃,5% CO2的细胞培养箱中孵育1~3 h;取出细胞后,选择450 nm波长读取吸光度(A)值。然后以细胞的培养时间为横坐标,以450 nm波长吸光度值为纵坐标绘制连续检测7 d后的细胞增殖曲线。
1.2.4 细胞划痕伤口闭合试验:当6孔板接种的ITS无血清培养的hAMSCs达90%汇合时,用200 μL枪头垂直于细胞单层上划十字形划痕,力度以刚好能划落细胞而不在培养板上留下划痕为标准。PBS清洗后加入ITS培养液,于48 h后观察划痕的愈合情况。
1.2.5 RT-qPCR检测生长因子的表达:ITS培养液培养的hAMSCs达到90%汇合后按照Trizol的试剂说明书提取总RNA,NanoDrop2000超微量分光光度计检测RNA的A值及比值,以确定RNA的浓度及纯度。再按照PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒说明书将其反转录成cDNA。最后按照SYBR Premix Ex TaqTMⅡ试剂说明书混样,在ABI7500仪器上进行实时定量PCR,PCR反应体系为25 μL,PCR反应条件为:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。以GAPDH的表达量作为内参,计算目的基因的表达量,计算方法为2-ΔΔCt相对定量法。PCR引物见表1。

表1 实时定量PCR引物Table 1 Primers for qPCR
1.3 统计学分析

2 结果
2.1 形态学特征
原代分离培养的hAMSCs,加入ITS培养基,接种3 d后呈现短梭形,7 d后开始伸展,呈鱼群样排列,接种10 d达到 90% 汇合(图1)。
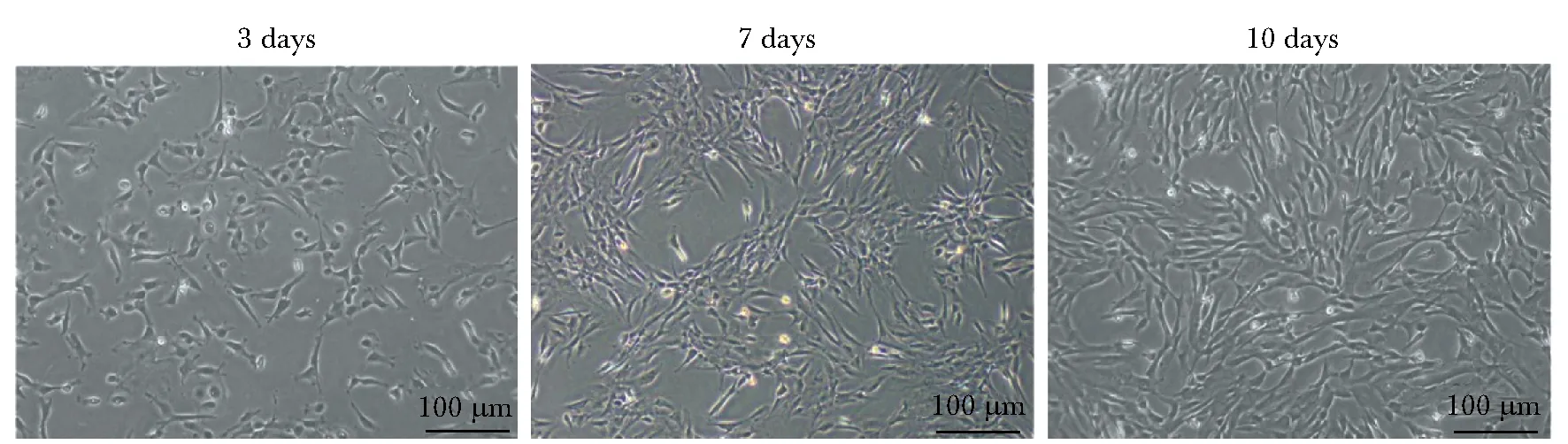
图1 倒置显微镜下观察无血清培养的hAMSCsFig 1 Observtion of hAMSCs culturing in serum free medium by inverted microscope(×40)
2.2 免疫荧光鉴定
免疫荧光可见大部分 hAMSCs 表达 CD90 和 CD73,不表达 CD45和CD34(图2)。

图2 免疫荧光实验检测无血清培养的hAMSCs细胞表面CD34、CD45、CD73和CD90的表达Fig 2 Immunofluorescence assay was used to detect the expression of CD34,CD45,CD73 and CD90 on the surface of hAMSCs cultured in serum free medium
2.3 细胞增殖曲线
绘制ITS无血清培养的P3-P6的hAMSCs细胞增殖曲线(图3)。第1~2天,细胞增殖速度缓慢,接种后培养第3~4 天处于细胞的快速增殖期,接种后培养第5天进入增殖平台期。
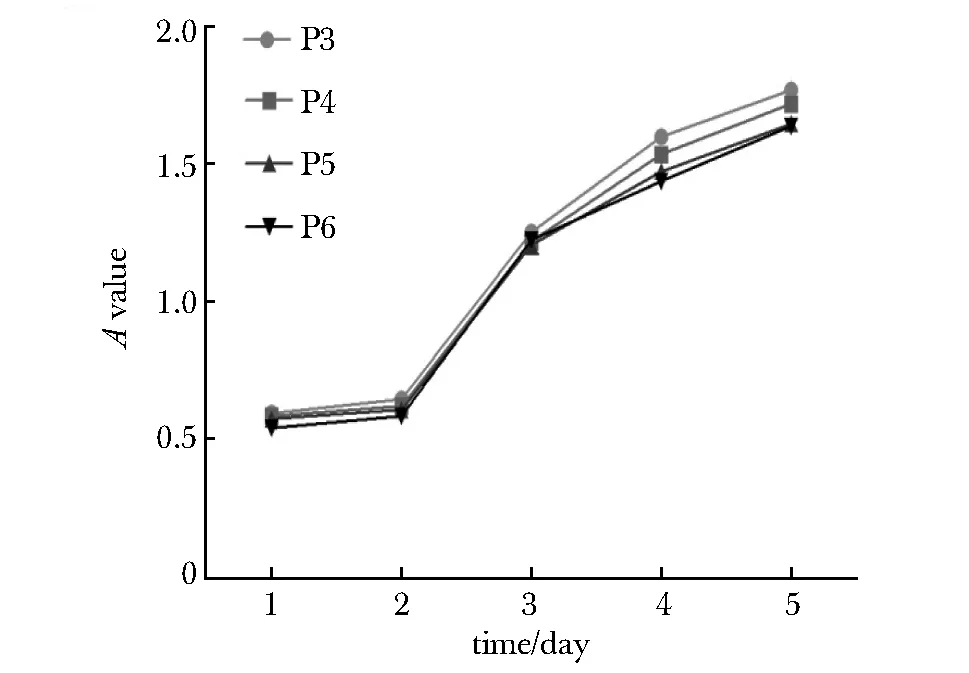
图3 hAMSCs细胞增殖曲线Fig 3 Cell growth curves of hAMSCs
2.4 细胞划痕伤口闭合试验
ITS培养液培养48 h后,与FBS培养条件下相比,hAMSCs的迁移能力增强,迁移速度加快(P<0.05)(图4)。
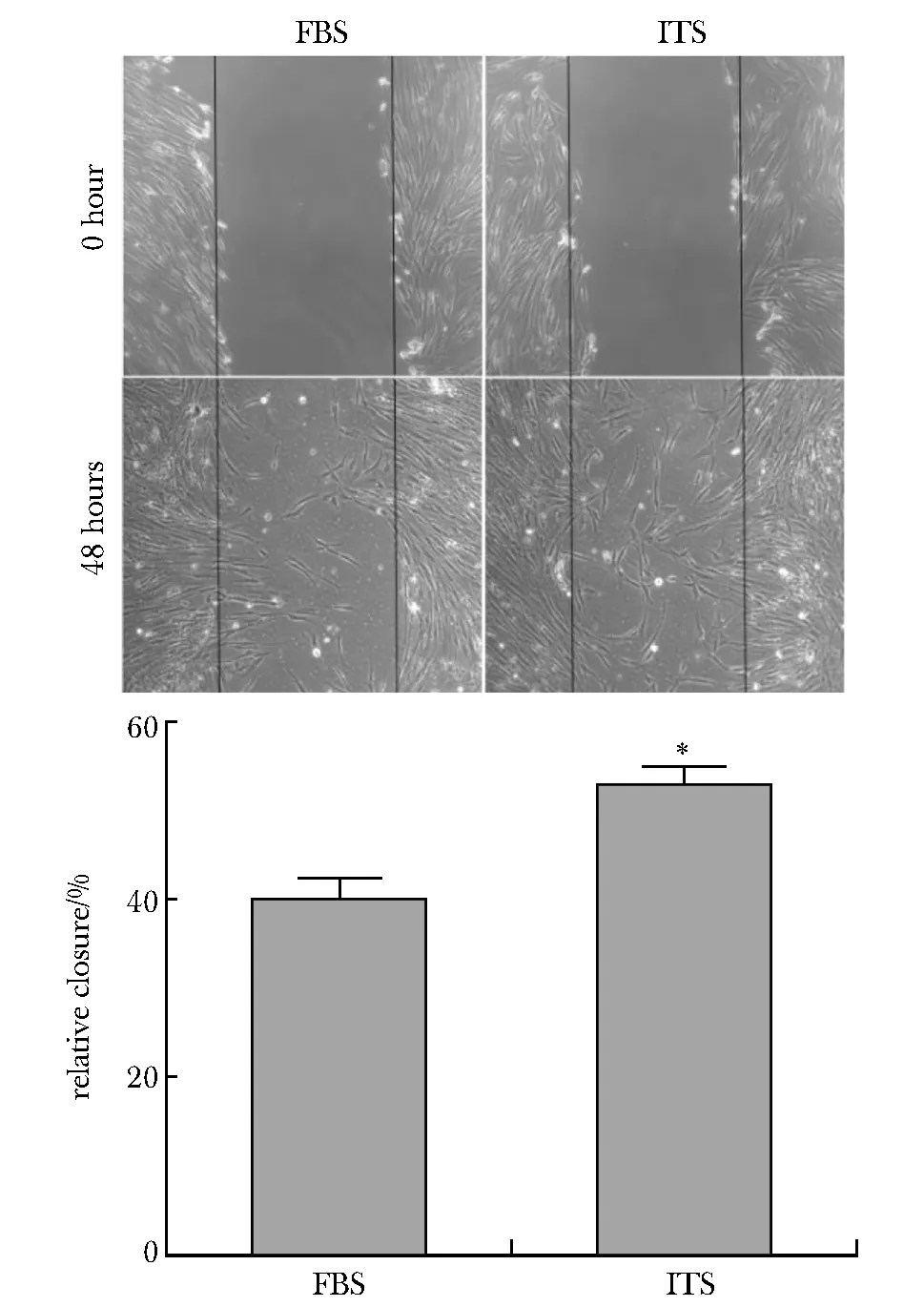
*P<0.05 compared with FBS group图4 ITS无血清培养基培养的hAMSCs迁移能力增强Fig 4 hAMSCs cultured in ITS serum free medium had a significant increase in cell migration ability compared with
2.5 生长因子的表达
VEGF、KGF、PDGF和IGF-1与FBS对照组相比,ITS组生长因子表达上调(P<0.05)(图5)。
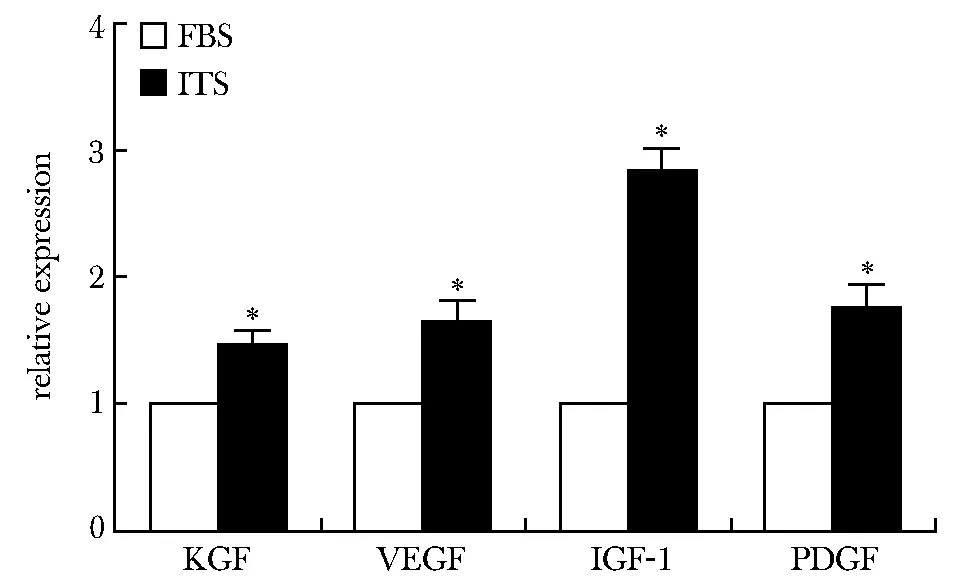
*P<0.05 compared with FBS group图5 RT-qPCR检测ITS无血清培养基培养的hAMSCs生长因子的表达Fig 5 RT-qPCR assay was used to detect the expression of growth factors of hAMSCs cultured in ITS serum-free medium compared with FBS
3 讨论
干细胞治疗是目前科学研究的热点,具有很大的临床应用潜能。但同时也涉及一些实际问题,如安全性,伦理道德问题,因而其应用受到限制。羊膜间充质干细胞的临床应用具有很多优势[8],羊膜的供给不受限制且与脂肪和骨髓相比获取更便利。羊膜来源细胞的增殖和分化潜能超过脂肪组织,比其他母体来源的细胞分化能力更强。而且胎儿来源的细胞能排除成体来源细胞因年龄引起的增殖分化能力下降的问题。根据需要羊膜间充质干细胞可以于胎儿出生后,分离并储存,以备将来需要自体移植时可以立刻提供。本实验研究,通过胰蛋白酶和胶原酶消化分离培养的hAMSCs,细胞得率高,增殖能力较强,P3代以后的细胞形态均一,呈典型的长梭形,鱼群样排列,表达间充质干细胞细胞表面标志物CD73和CD90,不表达CD34和CD45。
细胞为基础的再生治疗需要将细胞在体外培养之后移植到靶组织。随着越来越多的细胞治疗课题从实验室阶段发展到临床前或临床阶段,无异种蛋白的培养系统对于hAMSCs体外培养越来越重要。这种培养体系的重要性在于能避免免疫排斥,跨种系感染的风险以及对细胞功能的改变,避免与非人源细胞培养成分有关的基因表达。ITS混合成的混合物已经用于很多类细胞的增殖和分化,业已证实,胰岛素的促有丝分裂和代谢作用,并且胰岛素对于葡萄糖转运也是至关重要的。转铁蛋白是铁的载体,有助于降低非蛋白结合铁产生的氧毒性。硒是一种微量元素,通过其在硒蛋白中的结合形式(谷胱甘肽过氧化物酶,硫氧还蛋白还原酶及硒蛋白)而作为培养基中的抗氧化剂[6-7]。本研究利用ITS结合人血清白蛋白对hAMSCs进行大量培养扩增,通过观察ITS培养条件下hAMSCs增殖和迁移能力,以及生长因子的表达,评估其作为无血清培养添加剂的临床应用潜能[9-10]。结果证明,ITS培养环境不改变hAMSCs的表型,能够维持hAMSCs的增殖和迁移能力及生长因子的表达,可以作为hAMSCs临床应用前的无血清培养基。
