交流干扰下碱性环境中富锌环氧涂层失效机制研究
2021-08-16姜洁许甜刘婧杨超崔淦
姜洁,许甜,刘婧,杨超,崔淦
(1.中石油华东设计院有限公司,山东 青岛 266071;2.胜利石油管理局 博士后科研工作站,山东 东营 257000;3.中国石油化工股份有限公司 胜利油田分公司 技术检测中心,山东 东营 257000;4.中国石油大学(华东),山东 青岛 265800)
环氧涂层以其交联密度高、腐蚀防护效果好而广泛应用于金属腐蚀防护领域,但环氧涂层性能结构单一、寿命相对较低,无法满足现代工业的要求。因此,以环氧涂层为基体,添加填充物锌颗粒形成的环氧富锌涂层是常用的防腐涂层之一[1]。
与环氧涂层相比,环氧富锌涂层中锌的质量分数能够达到90%,甚至95%[2]。一方面,能够有效填充固化剂挥发后形成的自由空隙,堵塞腐蚀性介质的扩散路径;另一方面,高含量的锌粉形成电连接,能够与腐蚀性介质(如O2、水、CO2等)反应[3],提高涂层的腐蚀防护性能。同时与金属基体接触的锌颗粒能够形成铁为阴极、锌为阳极的阴极保护(Zn的标准电位为–0.764 V(vs.SHE),铁的标准电位–0.440 V(vs.SHE)),进一步减小受保护金属的腐蚀影响[4-5]。环氧富锌涂层的缺点也比较明显:一方面,锌颗粒的加入会降低环氧涂层的物理防护性能;另一方面,涂层中没有完全反应的锌颗粒容易造成环境污染等。因此,目前新型涂层(如石墨烯富锌涂层、碳纳米管富锌涂层等[6-7])的提出,为提高环氧富锌涂层中锌的利用率提供了新的思路和方法。
从目前的研究来看,国内外学者关注不同环境下的最佳锌含量、提高涂层内锌颗粒的利用率等问题,但是对于碱性环境下富锌涂层的失效过程,尤其是交流干扰下的富锌涂层的失效过程鲜有研究。因此,文中通过电化学实验测试交流干扰下碱性环境下富锌涂层的电化学阻抗特征,揭示交流电干扰下的腐蚀涂层失效过程。
1 实验
1.1 电化学实验试片处理
考虑到金属基体涂层试片需要开展电化学阻抗测试,因此在涂敷涂层前,在试片其中一个阔面焊接导线,并通过100%固化环氧树脂封装(常温下30 d内吸水可忽略不计),只留下25 mm×25 mm的金属面暴露面积。依次采用600#—1200#砂纸将暴露面打磨至镜面,清洗后干燥备用。
1.2 涂层制备
实验涂层采用70%富锌环氧涂层[8](安徽芜湖有限公司生产),基体采用X80钢,样品尺寸均为25 mm×25 mm。涂层通过手工刷涂敷在基体表面,常温下固化7 d,通过QNIX8500测厚仪来确定涂层样品的厚度。涂层厚度通过五点取样法测试,分别取涂层样品四角位置和中心位置进行测试,取其平均值作为实验计算厚度[9],最终确定实验样品厚度为(25±5) μm。
1.3 实验装置
采用去离子水和分析纯NaOH配置质量分数为3%的NaOH溶液作为实验溶液,在恒温恒湿箱内(设置实验温度为20 ℃),开展X80钢涂层样品的浸泡实验。通过电化学测试得到试样随浸泡时间变化的电化学阻抗曲线,分析腐蚀性介质扩散过程对涂层失效过程的影响规律。
在传统三电极测试系统外加交流干扰电源(如图1所示),其中工作电极(X80钢试样)和辅助电极(铂电极)分别作为交流电源的正负两极,通过电路中串联电压表显示系统施加的交流干扰电位,电化学测试时,断开交流干扰电源。电化学阻抗测试时间为5 min,对浸泡结果的影响可忽略不计[10]。
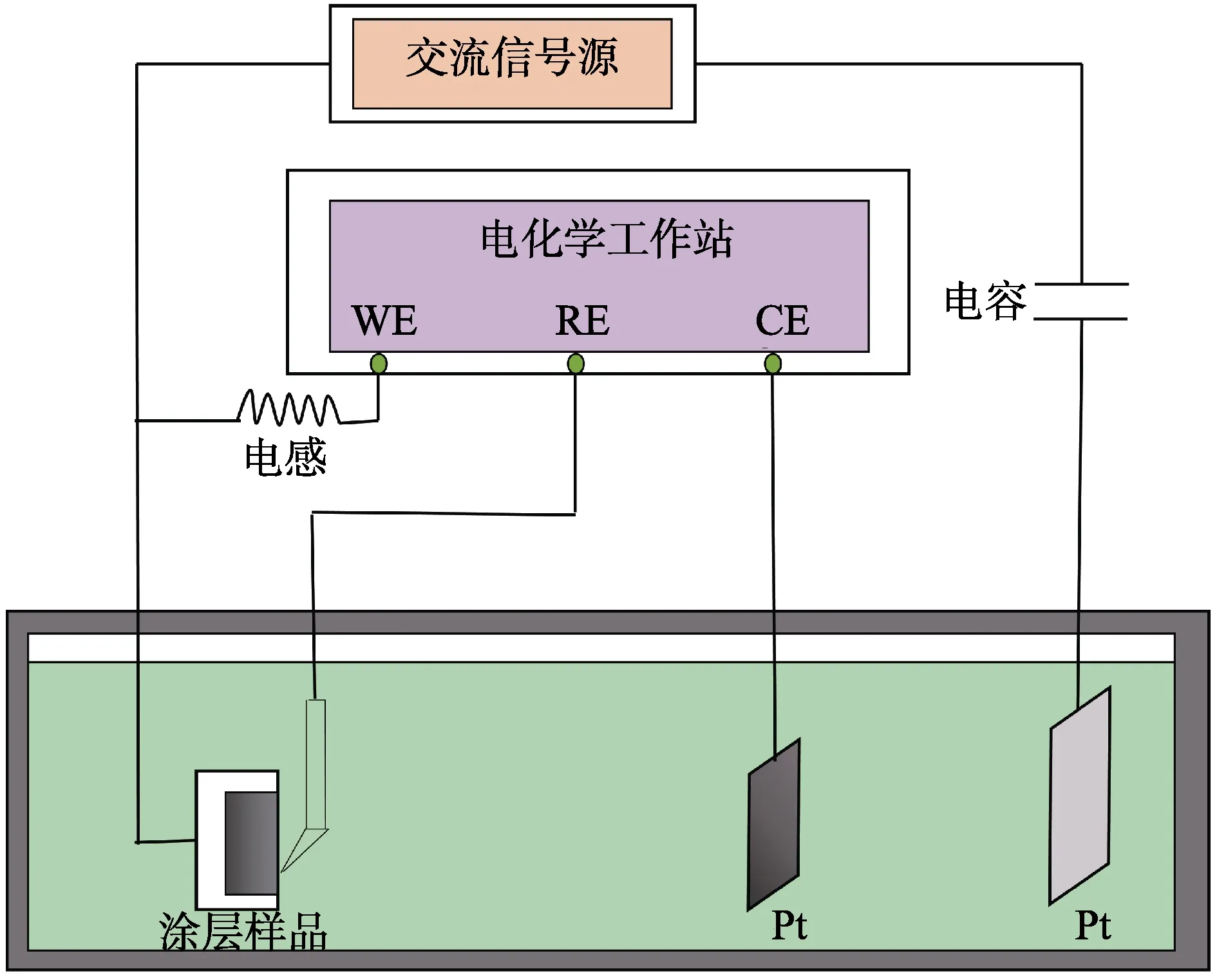
图1 交流干扰下的电化学测试装置Fig.1 Electrochemical measurement device under AC interference
在三电极电化学测试体系中,工作电极为X80钢涂层试样,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE,文中的电位均相对于饱和甘汞参比电极)。固定参比电极与工作电极的距离,以消除溶液电阻变化对测试结果的影响[11]。电化学工作站为PARSTAT 2273,电化学阻抗测试频率范围为105~10–2Hz,交流正弦信号振幅为±10 mV,数据处理采用系统自带的ZSimpWin软件。
2 结果与讨论
2.1 无交流干扰
无交流干扰条件下,富锌涂层在质量分数为3%NaOH溶液中的电化学阻抗测试曲线(选取10、20、50 min和3、13、50、155 h测试结果分析,总实验时长为196 h)如图2所示。在实验时间为0~50 min时,Nyquist图由2个容抗弧组成,Bode图中体现为高频(105Hz)峰值和中频(23.95 Hz)峰值。此时存在2个时间常数,分别表示锌颗粒与氢氧根的电化学反应过程和水分子的扩散过程。因此选择等效电路为Rs(QcRc)(CdlRct):Rs为溶液电阻,Qc为涂层电容,Rc为涂层电阻,Cdl为双电层电容,Rct为电荷转移电阻。当实验时间为1~155 h时,由于碱性环境下涂层中锌颗粒的活化和反应速率更快,大量腐蚀产物在涂层中发生扩散,Nyquist图中出现扩散阻抗特征。同时,溶液到达涂层/金属界面上发生电化学反应,高频段出现较小的电荷转移过程。因此选择等效电路为Rs(Qc(RcW))(CdlRct):Rs为溶液电阻;Qc为涂层电容;Rc为涂层电阻;W为韦伯扩散阻抗;Cdl为双电层电容;Rct为电荷转移电阻。等效电路如图3所示,拟合结果见表1。
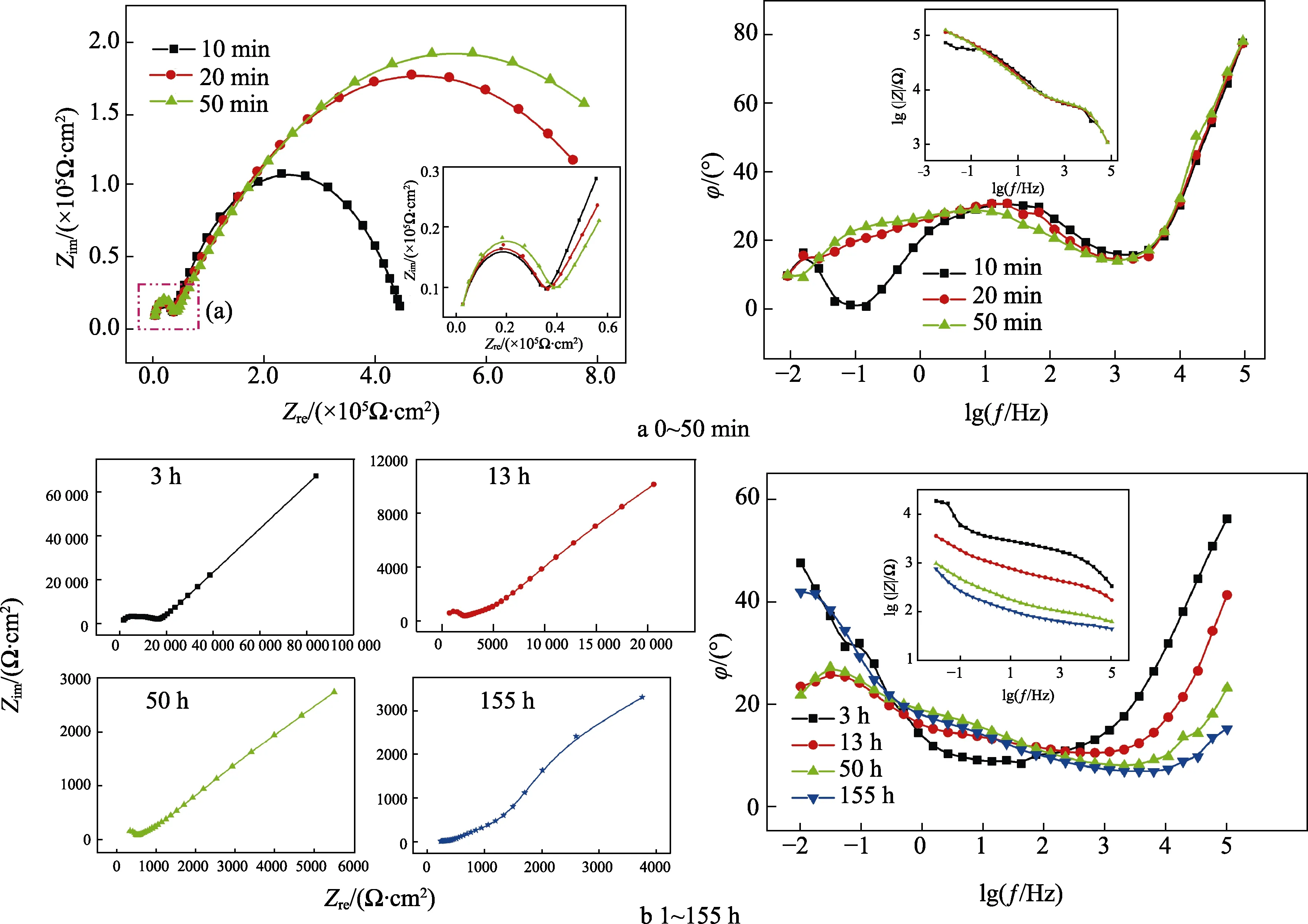
图2 富锌涂层在质量分数为3% NaOH溶液中的电化学阻抗测试曲线Fig.2 EIS curves of zinc-rich coating in 3% NaOH solution
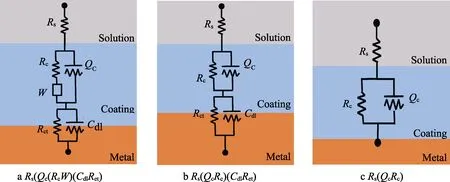
图3 等效电路物理模型Fig.3 Equivalent circuit physical model
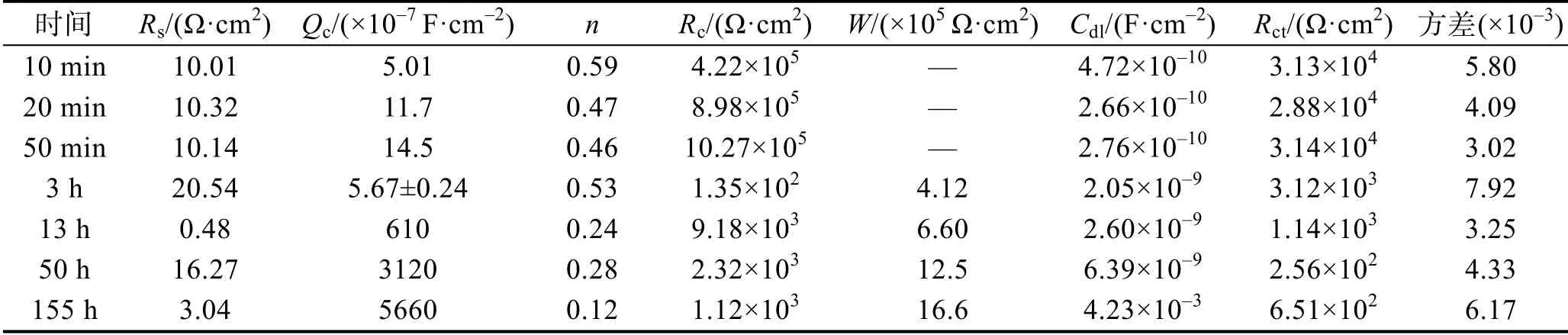
表1 富锌涂层在质量分数为3%的NaOH溶液中电化学阻抗拟合结果Tab.1 Fitted parameters of EIS curves of zinc-rich coating in NaOH solution
在实验的第一阶段(0~50 min),Nyquist图中,表示锌的反应过程的高频容抗特征基本保持不变,lgf-φ曲线在高频区(103~105Hz)基本重合,表示在初始阶段,锌颗粒的反应过程是影响涂层性质的关键因素。在碱性条件下,由于锌对OH–、O2以及H2O等的快速消耗,促进了腐蚀性介质在涂层中的扩散过程。因此,在中频区(102Hz)出现了表示“阻挡”特征的不明显峰值,而在中低频区(10-2~102Hz)相位角较小,且变化不大(10°~30°),表现为电阻特征,即涂层对介质扩散的物理屏蔽作用[12]。但是在碱性条件下,富锌涂层的防护效果远远低于环氧涂层,这主要是由于锌的反应过程明显增强造成的[13]。
当实验进入到第二阶段(3~155 h),在Bode图中,lgf-φ曲线在高频(105Hz)的相位角峰值随浸泡时间逐渐减小(56.3°→15.3°),即在Nyquist图中高频容抗弧特征频率范围减小。同时可以看出,实部阻抗与虚部阻抗范围也减小。事实上,该高频容抗特征包含锌的反应过程和界面上的电化学过程两个部分[14],但是由于单个锌颗粒在碱性溶液中活化和反应速率较快,在整个浸泡过程中,锌颗粒之间无法形成有效的电连接,各个锌颗粒之间相互独立,因此在整个测试时间段内(1~155 h),电化学阻抗特征均存在锌腐蚀产物的扩散特征。在3~50 h内,lgf-φ曲线低频(10–2Hz)相位角峰值逐渐减小(47.7°→23.3°),并且13、50 h的lgf-φ曲线在10–2~100Hz内重合,说明此时涂层内部锌颗粒的反应过程和扩散过程已经完成,物质扩散过程在13~50 h浸泡时间段内不再发生变化。在155 h时,低频(10–2Hz)相位角增大(23.3°→ 42.0°),说明此时涂层已经逐渐失去物理屏蔽作用,锌的腐蚀产物向溶液中扩散,导致电化学阻抗中韦伯扩散阻抗的出现。
相关电化学阻抗拟合参数随浸泡时间的变化规律(0~196 h)如图4所示。在第一阶段,涂层电容和涂层电阻均表现为先增大、后保持不变的趋势(Qc:5.0×10–7→14.5×10–7F/cm2,Rc:4.2×105→10.2×105Ω·cm2),而双电层电容表现为先减小、后保持不变的趋势(Cdl:4.7×10–10→2.8×10–10F/cm2),电荷转移电阻基本保持不变(Rct=3.0×104Ω·cm2)。这是因为当腐蚀性介质进入涂层,锌与氢氧根的反应迅速。一方面,锌的腐蚀产物与介质增大了涂层体系的介电常数,引起涂层电容增大;另一方面,腐蚀产物增大了涂层电阻。在碱性环境下,锌的活化过程加快,使得双电层电容和电荷转移电阻减小。当溶液持续进入涂层,锌不断活化和发生反应时,整个体系达到稳定状态,此时上述4个参数基本保持不变。
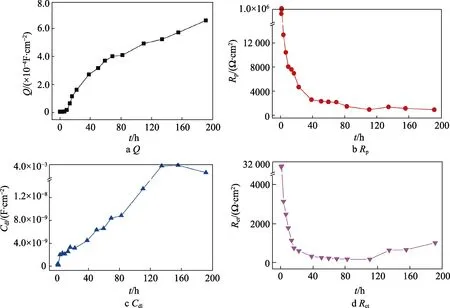
图4 相关参数随实验时间的变化规律Fig.4 Change of related fitted parameters over immersion time
当实验进行到第二阶段,涂层电阻和电荷转移电阻的变化趋势可以分为两个阶段:在3~40 h内,涂层电阻和电荷转移电阻均迅速下降(Rc=13.3×103~4.3×103Ω·cm2,Rct=31.2×102~5.9×102Ω·cm2),此时发生锌颗粒的持续活化和消耗;在40~196 h内,涂层电阻和电荷转移电阻略有减小,但基本保持不变,说明此时锌颗粒的反应过程和腐蚀产物扩散过程基本完成,因此涂层电阻保持不变,此时以界面上电化学反应过程为主。在碱性环境,金属基体容易形成Fe3O4钝化层,阻止反应的进一步发生[14],因此在40~196 h内,其电荷转移电阻基本保持不变。
在腐蚀性介质扩散后期,由于涂层已经失去物理屏蔽作用,此时溶液再次发生扩散,但由于金属基体表面的钝化,高频电荷转移过程逐渐消失(如155 h电化学阻抗特征)。当扩散时间达到191 h时,Nyquist图仅有单一容抗弧,表现为富锌涂层的降解过程。此时,体系电容Qc=6.5×103F/cm2和体系电阻Rc=9.0×102Ω·cm2,与金属在碱性环境中的钝化膜参数基本吻合。
碱性条件下活化锌颗粒在界面上提供的阴极保护强度远远小于近中性环境中。Zn作为两性金属,在碱性条件下锌颗粒更有利于活化,但是活化锌的消耗反应过程也更快,导致活化的锌颗粒表面能够迅速形成腐蚀产物Zn(OH)2和Zn(OH)42-[15-16],阻止活化锌颗粒之间的电连接。同时基体Fe在碱性环境中容易发生钝化,极大地减弱了涂层与金属基体的湿结合力[17]。
2.2 交流干扰
交流干扰电位为7 V时,富锌涂层在质量分数为3%NaOH溶液中的电化学阻抗测试曲线(选取30 min和1、2、3、5、7、21 h测试结果分析,总实验时长为200 h)如图5所示。等效电路如图3所示,拟合结果见表2。
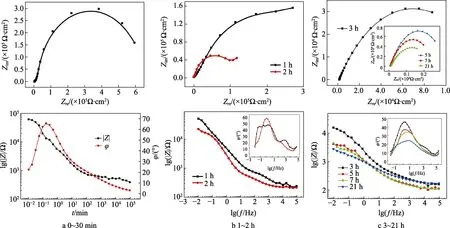
图5 交流干扰电压7 V条件下富锌涂层在3% NaOH溶液中电化学阻抗测试曲线Fig.5 EIS curves of zinc-rich coating in 3% NaOH solution under UAC=7 V
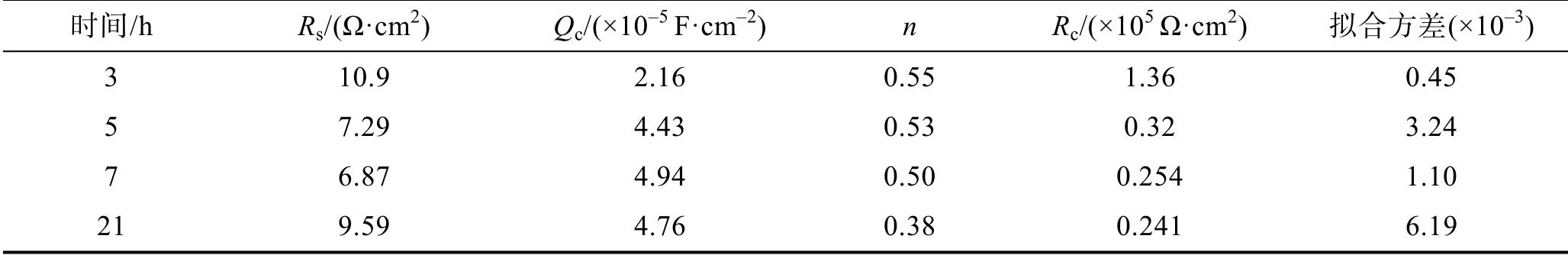
表2 交流干扰电压7 V条件下富锌涂层在NaOH溶液中电化学阻抗拟合结果Tab.2 Fitted parameters of EIS of zinc-rich coating in NaOH solution under UAC=7 V
在交流电作用,浸泡时间为30 min时,Nyquist图与无干扰时相似,均表现为双容抗特征,但是其高频容抗特征不明显,因此选择等效电路为Rs(QcRc)(CdlRct)。从图5的lgf-φ曲线上可以看出,表示物质扩散的相位角峰值远远大于高频电荷转移相位角峰值。这说明在交流电作用下,锌颗粒活化过程被抑制,锌颗粒的电化学反应过程十分微弱。当浸泡时间达到1 h时,高频相位角峰值向中频移动。当到达2 h时,其高频相位角峰值基本消失,此时Nyquist图出现较小的物质扩散阻抗特征,因此选择等效电路为Rs(Qc(RcW))(CdlRct)。当浸泡时间达到3 h后,在长时间的浸泡过程中,电化学阻抗特征仅仅表现描述物质扩散过程的单一容抗弧,因此选择等效电路为Rs(QcRc)。这主要是因为交流电和碱性环境的共同作用下,交流电抑制锌颗粒的活化,但是促进活化锌颗粒的电化学反应过程。若锌颗粒一旦活化,与OH–立即反应生成Zn(OH)2,阻断活化锌颗粒之间的电连接,因此活化锌颗粒的电化学反应过程非常迅速。当溶液到达涂层/金属界面,钝化膜的形成也抑制了电荷转移特征的出现。因此整个涂层体系表现为电阻特征[18-20],其物质扩散相位角峰值逐渐减小(46.2°→24.3°)。
3~200 h内相关拟合参数随浸泡时间的变化规律如图6所示。可以看出,随着浸泡实验的持续,涂层电容持续增大(Qc=2.2×10–5→8.3×10–5F/cm2),表示涂层内部锌腐蚀产物的生成和基体金属的钝化导致涂层的防护性能逐渐增强。而涂层电阻在3~109 h基本保持不变(Rc=3.0×104Ω·cm2),随后有所增大,这可能是由于环氧涂层在碱性环境中的再次交联导致的。
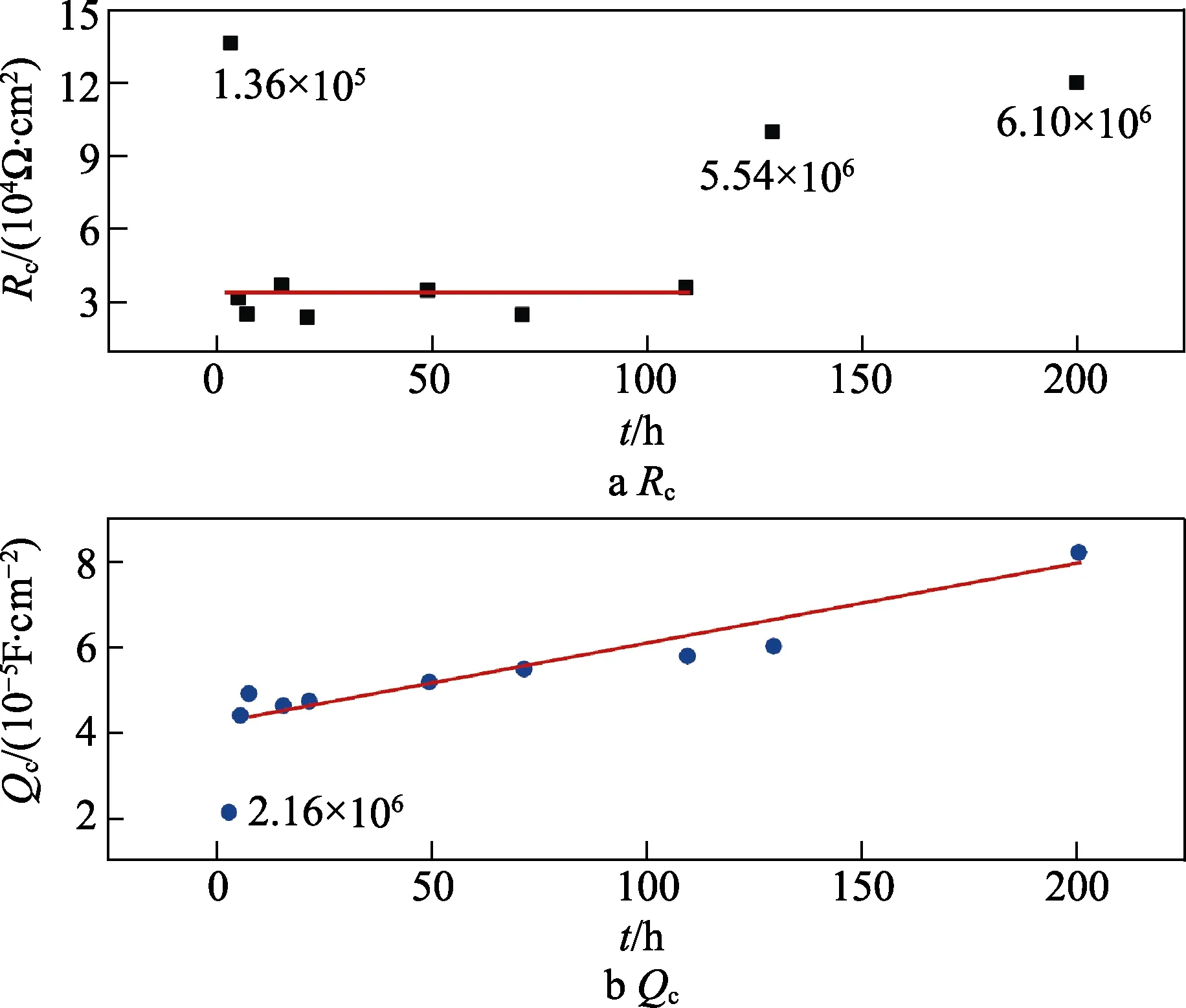
图6 相关拟合参数随浸泡时间的变化规律Fig.6 Change of related fitted parameters
2.3 失效机理分析
如上所述,涂层中锌的主要作用包括电化学反应消耗腐蚀性介质、腐蚀产物对扩散通道的阻塞和阴极保护作用,如图7所示。
在富锌涂层固化的过程中,涂层中的锌颗粒在氧气的作用下形成坚硬而致密的氧化锌:2Zn+O2→2ZnO。由于其不导电特性,阻断了锌颗粒之间的电连接。在近中性溶液中,由于H2O、O2和Cl–等的存在,ZnO逐渐变成疏松腐蚀产物ZnCl2和Zn(OH)2,锌基体暴露出来,即锌颗粒的活化过程,如图7a所示。锌基体之间通过溶液形成电连接,发生电化学反应,形成大量腐蚀产物。由于涂层内部腐蚀产物浓度分布不均匀,腐蚀产物发生扩散,堵塞扩散通道,如图7b所示。随着浸泡时间的推移,大量溶液进入到涂层中,锌的腐蚀产物析出。当溶液到达涂层/金属界面上时,形成锌为阳极、铁为阴极的阴极保护系统,如图7c所示。当界面上的活化锌颗粒完全反应,继而发生铁的电化学反应过程,此时富锌涂层完全失效。
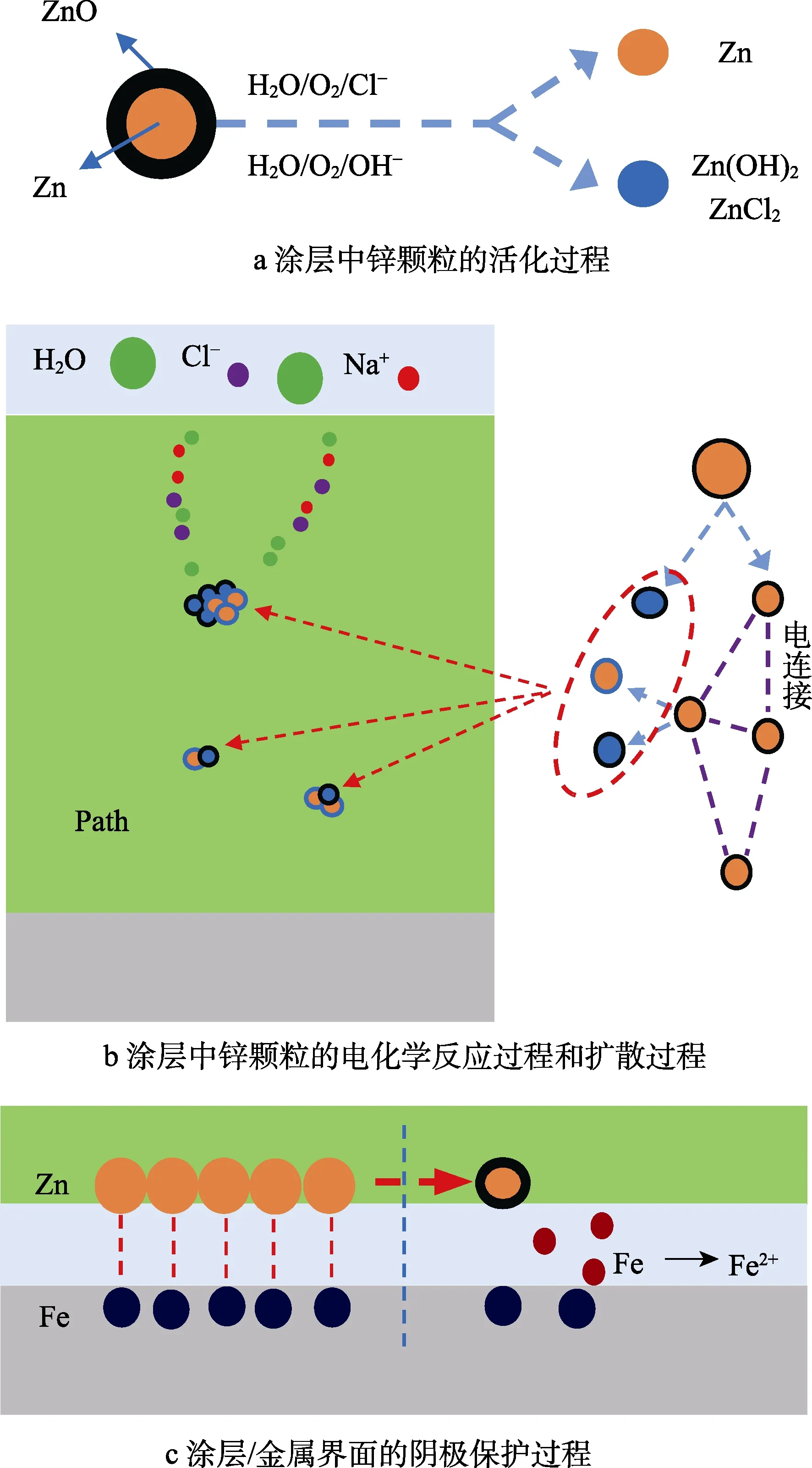
图7 涂层中锌粉的反应过程Fig.7 Electrochemical reaction of Zn in coatings: a) activation process of zinc particles in coatings; b) electrochemical reaction and diffusion process of zinc particles in coatings; c)cathodic protection process of coating / metal interface
在碱性溶液中,由于氧化锌为两性化合物,能够更快地在碱性环境中发生溶解:ZnO+2OH–+H2O→Zn(OH)42–。同时锌作为两性金属,能够很快地与氢氧根发生电化学反应,生成的Zn(OH)42–/Zn(OH)2包裹在锌的表面,使其失去了导电性和电化学特性,也阻断了活化锌粉之间彼此的电连接,因此溶液能够很快地到达涂层金属界面,发生钝化。
当施加交流干扰时,交流电位抑制锌颗粒的活化过程,降低了扩散溶液的消耗,因此溶液能够很快到达涂层/金属界面,形成阴极保护。随着锌粉的大量活化,在近中性溶液中能够形成有效的电连接,增强界面的阴极保护效应,但是交流干扰能够促进活化锌颗粒的电化学反应过程,使得阴极保护更快失去作用。而在碱性环境中,由于氢氧根和交流干扰均能够促进活化锌颗粒的反应过程,形成的腐蚀产物能够有效地阻止锌颗粒的电连接,此时富锌涂层会迅速失去其电化学防护性能。
3 结论
文中通过电化学方法,分析了碱性条件下锌颗粒在环氧涂层中的电化学行为和对涂层失效的影响,并考虑了交流电作用对锌颗粒反应过程的影响。主要得到以下结论:
1)富锌涂层的防护作用依次体现在涂层中锌颗粒的电化学反应过程、涂层中腐蚀产物的阻挡过程和界面阴极保护过程3个方面。在碱性环境下,涂层中的锌粉更加迅速地活化,而活化锌颗粒迅速发生反应,形成腐蚀产物,覆盖在锌颗粒表面,阻断了锌颗粒之间的电连接,使得锌颗粒更快地失去其电化学防护作用。同时碱性溶液到达金属界面,发生钝化。
2)在交流电的作用下,锌颗粒的活化过程被抑制,但是活化锌颗粒的反应过程被促进。因此在交流电作用的碱性环境中,富锌涂层更容易失去其防护作用。
