沉默内源性RNF4 通过激活p53 通路诱导乳腺癌细胞凋亡
2021-08-14余思茗张玥王婷婷
余思茗 张玥 王婷婷
乳腺癌(Breast Cancer)居全世界女性癌症发病率首位,是危害女性生命和健康的最严重的恶性肿瘤之一[1]。大多数乳腺癌是一种激素依赖性的高度异质性实体瘤,预后较差,利用免疫组化进行分子分型,根据不同分型给予个性化治疗方案对于治疗乳腺癌尤为重要[2]。因此深入探究乳腺癌发生发展的机理,给患者有效的治疗手段,仍是医学研究的重要课题之一。蛋白质翻译后的修饰(post-translational modifications),如磷酸化修饰、泛素化修饰、SUMO 化修饰等,可调控相关致癌因子的降解和活性,因此对于肿瘤的发生、发展至关重要[3]。RNF4 作为一种靶向SUMO 链的泛素连接酶,可通过与多种致癌因子的磷酸化形式结合,增强c-Myc、c-Jun 等致癌因子的稳定性和活性,促进肿瘤生长[4,5]。同时,RNF4 的活性也与多种癌症高度相关。在30%的结肠腺癌患者样本中,RNF4 蛋白水平显著升高,并且高水平的RNF4 mRNA 与乳腺癌患者的低生存率也密切相关[5]。故本研究旨在探讨沉默内源性RNF4 对乳腺癌细胞生长的抑制作用及相关的分子机制,并且利用在体裸小鼠乳腺癌模型印证RNF4 作为治疗乳腺癌的潜在药物靶点的可能性。现报告如下。
1 资料与方法
1.1 实验细胞和动物 人乳腺癌 MCF-7 细胞株购自北京中国医学科学院基础医学研究所;实验动物来源:成年Nu/Nu 裸鼠,体重18~20 g,雌性,通过本院实验中心外购,并寄养。
1.2 构建RNF4 沉默的稳转细胞株 ①选择靶序列:RNF4 shRNA 干扰序 列:5'-GatccGGAAACTGTTGGA GATGAATTCAAGAGATTCATCTCCAACAGTTTCCTT TTTTg-3',3'-AattcAAAAAAGGAAACTGTTGGAGATG AATCTCTTGAATTCATCTCCAACAGTTTCCg-5';②包装慢病毒:插入RNF4 shRNA 干扰序列的慢病毒载体LV-3(pGLVH1/GFP+Puro)由上海吉玛基因公司制备。取对数生长期人乳腺癌细胞MCF-7 种于6 孔板中,5×105个/孔,每孔加2 ml 含10%牛血清DMEM培养基,置于37℃、5% CO2培养箱进行培养,待细胞贴壁后进行实验。细胞融合度约达到80%时,按照 Lipofectamine2000 转染试剂说明书进行转染操作,将 shRNA RNF4 阴性对照质粒和 shRNA RNF4 包装质粒分别转染到 MCF-7 细胞中,6 h 后换用完全培养基,继续48 h 后,检测 RNF4 表达情况,鉴定转染结果;③感染慢病毒:6 孔板中,5×105个/孔,生长至约60%~80%时弃DMEM,每孔加入不同慢病毒[包括空白和目的表达载体,感染复数(MOI)=30]再加入含凝聚胺(6~8 μg/ml)的培养基,继续培养24 h;吸弃含有慢病毒培养液,加入DMEM 继续培养,并在感染后每隔一定时间观察细胞状态。④筛选稳转细胞株:慢病毒感染48 h 后,将 DMEM 更换为2 μg/ml 嘌呤霉素培养液;2 d 更换一次培养液,待细胞生长稳定后传代;超过两代后无需再加嘌呤霉素培养;经RNF4 表达验证后,得到RNF4 沉默的稳转细胞株。
1.3 裸鼠皮下移植瘤模型 将对数生长期的、慢病毒转染建立的稳定沉默RNF4 的MCF-7 细胞系与阴性空载质粒转染的细胞系用胰酶消化收集,并用氯化钠注射液洗涤重悬,悬液浓度5×107个细胞/ml,将0.2 ml 的肿瘤细胞悬液于异氟烷吸入麻醉下注射于裸鼠右腋皮下。裸鼠苏醒后送入鼠房,自由饮食。每3 天测量一次皮下移植瘤体积,连续观察26 d 后,脱臼法处死裸鼠,提取肿瘤组织,拍照、称重并提取肿瘤组织总蛋白,备用。
1.4 Western blot 检测RNF4 和p53 表达水平 取小鼠瘤组织或离体培养的细胞,提取样品总蛋白,依据BCA 蛋白浓度检测试剂盒中的说明书,测定蛋白浓度。将处理好的蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)实验,之后将蛋白条带印迹到PVDF 膜上,脱脂牛奶室温封闭2 h 后,孵育一抗:RNF4、GAPDH 和p53,4℃过夜。次日PBST 缓冲液 洗涤后,加入羊抗兔或鼠二抗室温避光孵育 1 h。
1.5 CCK-8 检测细胞活性 取对数期MCF-7 细胞种于96 孔板,3000 个/孔,置于37℃、5% CO2培养箱培养24 h。培养结束后加入10 μl 的CCK-8 反应液,避光在培养箱中孵育1 h。用酶标仪在 460 nm 波长下检测吸光度值。
1.6 主要试剂和仪器 DMEM 细胞培养基和胎牛血清购自美国 Gibco 公司;shRNA RNF4 干扰质粒及其阴性对照质粒购自广州锐博生物科技公司;Lipofectamine 2000 试剂购自美国ThermoFisher 公司;CCK-8 试剂盒购于上海碧云天生物技术有限公司;RNF4 一抗、GAPDH 一抗、p53 一抗购于美国Proteintech 公司;二抗羊抗鼠、二抗羊抗兔购自美国ThermoFisher 公司。
1.7 统计学方法 采用GraphPad Prism 8.0 软件进行图表制作与数据统计分析。计量资料以均数±标准差()表示,肿瘤体积=1/2ab2(a=肿瘤长径,b=肿瘤短径)。多组比较应用单因素方差分析法(One-way ANOVA)并用Turkey 法验证;两组比较应用t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 LV3(H1/GFP&Puro)慢病毒稳定沉默RNF4 的乳腺癌细胞系 通过0.5、1.0、1.5、2.0 和 2.5 μg/ml 的嘌呤霉素培养基进行筛选出稳定沉默的细胞系,与对照组(shCtl)相比,RNF4 沉默组(shRNF4)中RNF4 表达明显降低,说明稳转细胞系建立成功。见图1。
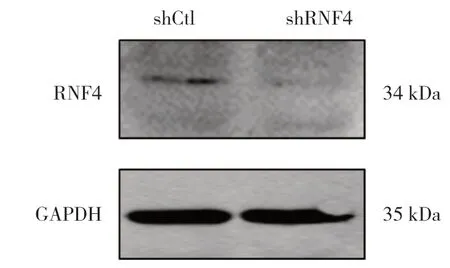
图1
2.2 沉默内源性RNF4 对于肿瘤细胞活性影响 CCK8实验结果显示,与shCtl 组相比,shRNF4 组癌细胞的增殖活性被显著抑制,表明沉默内源性RNF4 可抑制乳腺癌细胞增殖。见图2。

图2
2.3 沉默内源性RNF4 对于乳腺癌细胞中促凋亡蛋白p53 的影响 与shCtl 组相比,shRNF4 组中p53 表达显著升高,表明沉默RNF4 是通过激活p53 凋亡通路起到抑制乳腺癌细胞生长的作用。见图3。
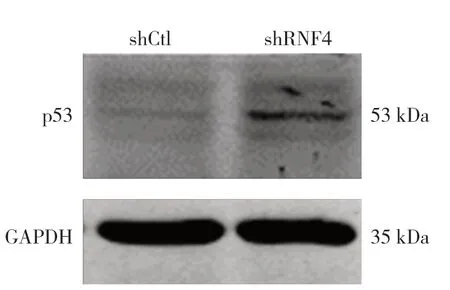
图3
2.4 沉默内源性RNF4 对于荷乳腺癌裸小鼠模型生长的影响 连续观测裸鼠皮下肿瘤生长26 d,各组均未出现动物死亡。与shCtl 组相比,shRNF4 组肿瘤生长缓慢,沉默内源性RNF4对肿瘤体积和重量有明显的抑制作用,肿瘤体积抑制率为55.3%,瘤重抑制率为60.9%。见图4。
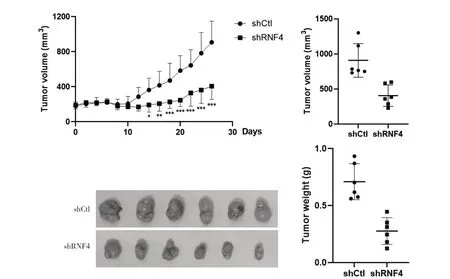
图4
2.5 沉默内源性RNF4 对于乳腺癌组织中促凋亡蛋白p53 的影响 与shCtl 组比较,沉默RNF4 后,瘤组织中的p53 表达增加,与离体实验结果一致,说明沉默RNF4 是通过上调促凋亡蛋白p53 的表达,激活相关凋亡通路,从而抑制体乳腺癌的生长。见图5。
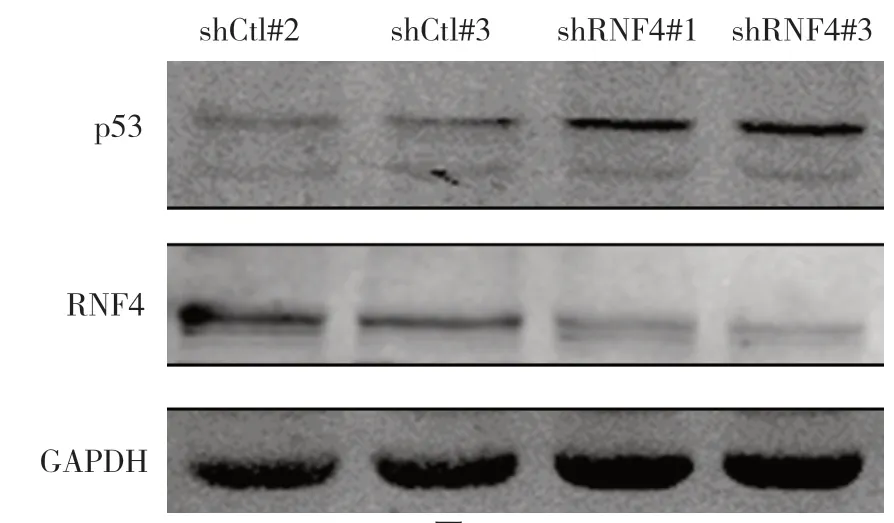
图5
3 讨论
乳腺癌作为危害女性健康的“第一杀手”,在临床中的治疗尚缺乏有效的措施且患者预后差[6]。已有研究表明高水平的RNF4 mRNA 与乳腺癌患者的预后差、低生存率密切相关[5]。因而,本实验通过沉默乳腺癌细胞内源性RNF4 发现,促凋亡蛋白p53 表达升高,在体模型中肿瘤生长缓慢,肿瘤体积和重量均显著减少,肿瘤细胞活性被显著抑制,提示RNF4 可能作为治疗乳腺癌的潜在靶点。
p53 是关键的抑癌基因,其编码的蛋白质调控着细胞生长、发育、新陈代谢、凋亡、氧化应激、DNA损伤修复等过程,同时也作为转录激活因子促进下游基因表达,从而达到抑制肿瘤进程的作用[7]。p53 基因突变常见于肿瘤患者中,可导致DNA 损伤修复途径的失灵、细胞周期阻滞等,增强肿瘤细胞的侵袭、转移和耐药性,加速肿瘤进程[8]。
RNF4 作为靶向SUMO 链的泛素连接酶,可调控底物蛋白发生降解,参与核酸的代谢、胚胎发育、转录、DNA 修复及稳定性等重要细胞活动[9]。研究表明,RNF4 是促癌因子c-Myc 的重要靶点。当Wnt 或Notch通路激活时,RNF4 的表达也随之升高[10]。与此同时,RNF4 不仅没有促进相关致癌蛋白发生降解,反而稳定了多种存活周期较短的致癌蛋白,如β-Catenin、c-Myc、c-Jun 等的表达,并且增强它们的转录活性[5]。因此,抑制RNF4 的活性和表达可能会成为癌症治疗的有利手段。故本研究通过探讨RNF4 沉默是否通过抑制p53 通路发挥促进乳腺癌细胞凋亡的作用,为临床靶向治疗乳腺癌提供更多理论基础。
综上所述,本实验通过沉默RNF4,从而激活p53通路,诱导乳腺癌细胞凋亡并且抑制在体乳腺癌的生长,揭示RNF4 可作为潜在的治疗靶点。
