基于LC-MS技术研究氟氯苯氰菊酯对西方蜜蜂工蜂幼虫代谢的影响
2021-08-12虞龙涛杨何妍苏宇晨颜伟玉吴小波
虞龙涛,杨何妍,苏宇晨,颜伟玉,吴小波✉
1江西农业大学蜜蜂研究所/江西省蜜蜂生物学与饲养重点实验室,南昌 330045;2江西农业大学动物科学技术学院,南昌 330045
0 引言
【研究意义】蜜蜂是一种非常重要的授粉昆虫,许多农作物都依赖蜜蜂授粉,蜜蜂给全世界农业创造了巨大的经济价值[1]。然而蜜蜂也受到许多危害,如病毒、寄生虫、螨虫等,其中蜂螨作为主要危害,给全球蜜蜂产业造成严重的损失,目前治理蜂螨最为简便的方法是使用杀螨剂。氟氯苯氰菊酯(flumethrin)属于第二代拟除虫菊酯类杀虫、杀螨剂,使用时将其挂入蜂箱巢脾中,通过蜜蜂活动时接触药条并互相传递,使药发挥作用[2],由于杀螨剂具有一定的毒性,在杀死螨虫的同时也会威胁到蜜蜂的健康。目前,许多研究表明杀螨剂会给蜜蜂生理和行为带来不可逆转的影响[3-6],但是关于氟氯苯氰菊酯影响蜜蜂的健康状况机制研究则相对滞后。因此,测定氟氯苯氰菊酯影响下工蜂幼虫代谢物的变化,并探讨涉及的代谢通路,可为进一步阐释杀螨剂影响蜜蜂发育的机制提供参考。【前人研究进展】氟氯苯氰菊酯作为一种毒性药物,直接暴露于氟氯苯氰菊酯下的蜜蜂健康状况会受到其明显的影响。有研究表明,亚致死剂量的氟氯苯氰菊酯会引起西方蜜蜂(Apismellifera)机体紊乱[3-5],QI等用 1、10、100 µg·L-1氟氯苯氰菊酯处理西方蜜蜂后发现,氟氯苯氰菊酯在幼虫变态和成虫羽化过程中都有明显的致死作用。在幼虫期连续暴露后,幼虫的抗氧化酶(SOD和CAT)、脂质过氧化(MDA、LPO和POD)和解毒酶(GSH、GST和GR)发生了显著变化[3]。而且经0.01、0.1和1.0 mg·L-1氟氯苯氰菊酯慢性染毒14 d后,蜜蜂中肠出现明显的抗氧化反应、解毒作用、免疫反应和细胞凋亡[4]。此外,牛新月[5]研究发现,给西方蜜蜂幼虫饲喂含氟氯苯氰菊酯的糖水,蜜蜂幼虫的发育受到影响,并且刚出房的蜜蜂出现畸形,蜜蜂解毒关键酶的含量以及活性也有明显差异。氟氯苯氰菊酯还会影响中华蜜蜂(Apiscernana)的寿命以及死亡率,TAN等[6]研究发现,摄入亚致死剂量含氟氯苯氰菊酯的糖水会显著影响中华蜜蜂的寿命并影响到蜜蜂的采集行为。江武军等[7]采用10、100 mg·kg-1的氟氯苯氰菊酯糖水饲喂中华蜜蜂,发现氟氯苯氰菊酯处理组蜜蜂中肠组织AcCYP9E2表达量显著高于对照组,CYP9E2参与了外源物质代谢解毒过程,表明氟氯苯氰菊酯会影响蜜蜂解毒功能。【本研究切入点】多数研究表明,氟氯苯氰菊酯对蜜蜂幼虫以及成虫带来不可逆转的影响,但蜜蜂对氟氯苯氰菊酯代谢的研究相对滞后,有关氟氯苯氰菊酯对蜜蜂血淋巴代谢物影响的研究未见报道,蜜蜂代谢氟氯苯氰菊酯的机理尚不明确。【拟解决的关键问题】采用液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)检测氟氯苯氰菊酯处理后蜜蜂幼虫代谢物,并筛选差异代谢物,分析涉及到的代谢通路,结合代谢通道数据库(Kyoto encyclopedia of genes and genomes,KEGG),探究氟氯苯氰菊酯影响下蜜蜂代谢物的变化规律,为进一步阐明蜜蜂代谢氟氯苯氰菊酯的机制提供理论依据。
1 材料与方法
1.1 供试蜜蜂
利用群势相近的3群西方蜜蜂,饲养于江西农业大学蜜蜂研究所内,试验开展时间为2019年。
1.2 药物配置
根据氟氯苯氰菊酯在蜂产品中的残留情况[8-11],结合氟氯苯氰菊酯对蜜蜂的亚致死剂量浓度[6,12],氟氯苯氰菊酯处理浓度为0.5、5、50 mg·kg-1。用50%糖水稀释氟氯苯氰菊酯至 0.5、5、50 mg·kg-1,以饲喂50%糖水作为对照组。
1.3 限王产卵及淋巴液的采集
将蜂王限制在巢脾上产卵12 h,随后将蜂王产卵区域分为4组,并将产卵的巢脾放在继箱上孵化,第5天开始,在巢脾不同区域每天用移液枪分别给小幼虫饲喂含有氟氯苯氰菊酯的糖水,饲喂量从第5天至第8天逐日递增(1.5、2、2.5、3 µL),第9天将幼虫从脾中挑出,置于经高温灭菌的培养皿内,用高压双蒸水冲洗3遍直到其体表被冲洗干净,之后用滤纸吸干幼虫体表水分。将幼虫置于 PE手套上,用剪刀在幼虫的头部剪一个小口,用移液枪吸取流出的血淋巴,转移至1.5 mL的EP管。每个EP管收集的蜜蜂幼虫血淋巴体积为200 µL。然后14 000×g、4℃离心15 min。离心后,取120—150 µL上清于新的1.5 mL EP管中为1个样品,并快速置于液氮中冻存,每组6个重复。
1.4 代谢物的提取
将样本在4℃条件下缓慢解冻后,取100 µL置于96孔板中,加入300 µL提取液(甲醇﹕乙腈=2﹕1,-20℃预冷)、10 μL内标1、10 μL内标2,涡旋混匀1 min,-20℃静置2 h后,4℃,4 000×g离心20 min。离心后取300 μL上清,置于冷冻真空浓缩仪抽干后,加入150 μL复溶液(甲醇﹕水=1﹕1)进行复溶,涡旋振荡1 min,4℃,7 000×g离心30 min,取上清置于上样瓶中。每个样本的上清液各取 10 μL混合成QC质控样本,用于评估 LC-MS分析过程的重复性和稳定性,通过QC样本检测的重复性对数据质量进行评估,内容包括 QC样本的基峰离子流图(base peak chromatogram,BPC)、主成分分析(principle component analysis,PCA)、提取到的峰数量和峰相应强度差异。
1.5 色谱条件
本研究期望在正、负离子模式下寻找3种剂量氟氯苯氰菊酯处理组与对照组共同的差异代谢物,但负离子模式下未检测出共同的差异代谢物,因此只分析正离子模式下的结果。所使用的色谱柱为 BEH C18色谱柱(1.7 µm,2.1×100 mm,Waters,USA)。流动相为含0.1%甲酸的水溶液(A液)和含0.1%甲酸的100%甲醇(B液)。采用以下梯度进行洗脱:0—1 min,2% B液;1—9 min,2%—98% B液;9—12 min,98% B液;12—12.1 min,98% B液—2% B液;12.1—15 min,2% B液。流速为0.35 mL·min-1,柱温45℃,进样量为5 µL。
1.6 质谱条件
利用Q Exactive质谱仪(Thermo Fisher Scientific,USA)进行一级、二级质谱数据采集。质谱扫描质核比范围为70—1 050,一级分辨率为70 000,AGC为3e6,最大注入时间为100 ms。按照母离子强度,选择Top3进行碎裂,采集二级信息,二级分辨率为17 500,AGC为1e5,最大注入时间为50 ms,碎裂能量设置为20、40、60 eV。
离子源参数设置:鞘气流速为40 L·min-1,辅助气流速为10 arb,喷雾电压正离子模式为3 800 V,负离子模式为3 200 V,离子传输管温度为320℃,辅助气加热温度为350℃。
1.7 数据分析
采用LC-MS/MS技术进行非靶向代谢组学分析,使用 Compound Discoverer 3.0(Thermo Fisher Scientific,USA)软件进行 LC-MS/MS数据处理,完成峰提取、峰对齐和化合物鉴定。利用代谢组信息分析流程进行数据预处理、统计分析及代谢物分类注释和功能注释。通过主成分分析(PCA)对检测到的代谢物的原始数据进行降维,以此分析该数据集中所观测变量的分组、趋势(样本组内和组间相似性和差异性)及离群值(是否存在异常样本)。使用偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)分析模型前两个主成分的VIP值,结合单变量分析获得的差异变化倍数(fold change,FC)和T检验(Student’sttest)的结果来筛选差异代谢物。
差异代谢物筛选条件:PLS-DA模型前两个主成分的 VIP≥1;FC≥1.2或≤0.83;q-value<0.05。筛选得到的所有代谢物的 VIP值均>1,表明该变量对样本类别的区分有显著作用;FC为该差异代谢物在两组中的平均含量的比值,本研究中的 FC为处理组平均含量/对照组平均含量。对数据进行 T检验得到P-value,P-value进行错误发现率(false discovery rate,FDR)校正得到q-value。
筛选出氟氯苯氰菊酯处理组与对照组之间差异代谢物,并根据差异代谢物中性质量数以及化学式等信息筛选处理组间的共同差异代谢物。
基于 HMDB人类代谢组学数据库(The Human Metabolome Database)和KEGG京都基因与基因组百科全书,对差异代谢物进行分类注释。根据差异代谢物的富集情况确定差异代谢物代谢通路。
2 结果
2.1 样本总离子流图
如图 1,BPC(基峰离子流图)是将每个时间点质谱图中最强的离子连续描绘得到的图谱,将处理组与对照组总离子流图进行重叠,谱图重叠良好,保留时间和峰响应强度均波动小,表明仪器在整个样本检测分析过程中状态良好,信号稳定,数据可信,可进行下一步分析。
2.2 主成分分析(PCA)
不同剂量氟氯苯氰菊酯处理组与对照组 PCA分析得分图如图2所示,图中每个点代表一个样本,点与点的距离代表样本之间的相似性,椭圆为95%的置信区间。由图2可知,对照组与低剂量组样本分布在PC2的上下两侧,对照组与中剂量组样本主要分布在PC1左右两侧,对照组与高剂量组样本主要分布在PC2的上下两侧,说明对照组与氟氯苯氰菊酯处理组存在组间差异。
2.3 偏最小二乘判别分析(PLS-DA)
处理组与对照组之间的PLS-DA 得分图见图3。从第一主成分看,处理组分布在负轴位置,对照组主要分布正轴位置;从第二主成分看,处理组主要分布在负轴位置上,对照组主要分布于正负轴两侧。表明处理组与对照组的代谢物分离较好,处理组的每个样品的代谢物均与对照组有明显差异。
2.4 PLS-DA分析模型响应排序检验
PLS-DA模型的响应排序检验图验证结果如图4所示。结果表明,对照组与试验组代谢物R2和Q2均>0.5且其比值接近 1,说明 PLS-DA 模型能够较好地预测处理组与试验组代谢物的差异。Q2回归线始终在R2的下方,且Q2回归线的斜率较大,其与纵坐标的交点均在负半轴,说明模型质量较好,没有出现过于拟合的状况,结果稳定可靠。
2.5 差异代谢物鉴定
利用代谢物的分子质量和二级质谱信息在KEGG、HMDB数据库搜索比对,0.5 mg·kg-1组与对照组相比,共有差异代谢物190种,共鉴定87种;5 mg·kg-1组与对照组相比,共有差异代谢物275种,共鉴定97种;50 mg·kg-1组与对照组相比,共有差异代谢物275种,共鉴定131种(表1)。从鉴定的差异代谢物中筛选到29种共同的差异代谢物(表2),其中16种代谢物上调,12种代谢物下调,而1种代谢物在 50 mg·kg-1组和 0.5 mg·kg-1组中均下调,在 5 mg·kg-1组中表达上调。差异代谢物包括甲苯、核糖、氨基酸及其类似物、脂肪酸及其偶联物、嘌呤及其衍生物等。

表1 差异代谢物及鉴定结果Table 1 Differential metabolites and identification results
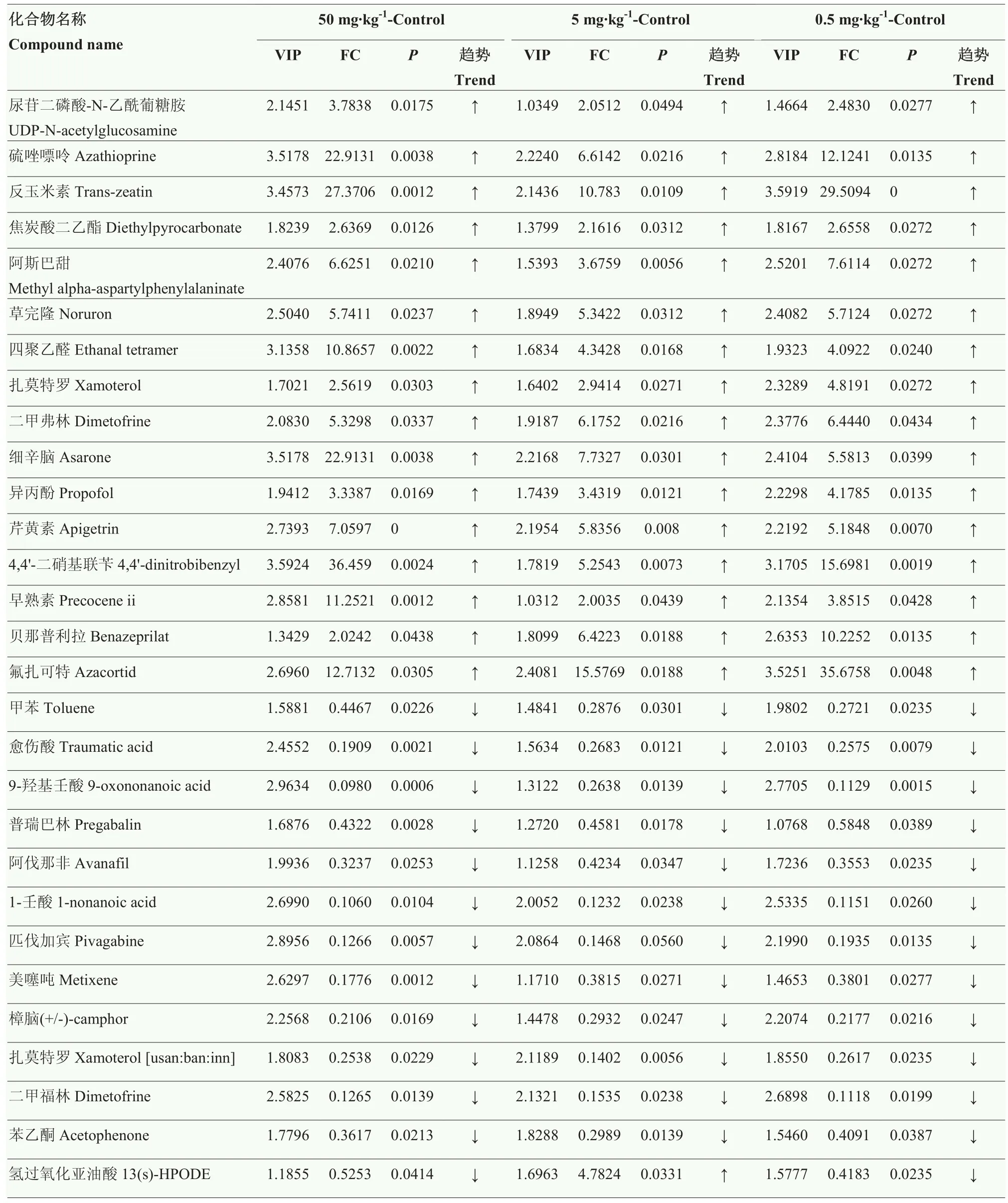
表2 对照组与氟氯苯氰菊酯处理组之间差异代谢物Table 2 Differential metabolites between the control group and flumethrin-treated groups
将共同差异代谢物进行富集分析,最终确定到氨基糖与核糖代谢、药物代谢-其他酶类代谢、α-亚麻酸代谢、其他代谢途径4条代谢通路(表3),其中尿苷二磷酸-N-乙酰葡糖胺、硫唑嘌呤、反玉米素表达上调,其对应的氨基糖与核糖代谢和药物代谢-其他酶类代谢等代谢通路加强;甲苯、愈伤酸、9-羟基壬酸表达下调,α-亚麻酸代谢通路减弱;氢过氧化亚油酸在50 mg·kg-1组和0.5 mg·kg-1组表达下调,在5 mg·kg-1组中表达上调,因此氢过氧化亚油酸在50 mg·kg-1组和0.5 mg·kg-1组中代谢通路减弱,在 5 mg·kg-1组中代谢通路加强。

表3 差异代谢物聚集的代谢通路Table 3 Metabolic pathways of differential metabolite aggregation
3 讨论
氟氯苯氰菊酯作为第二代拟除虫菊酯类杀虫、杀螨剂,已被广泛应用到养蜂生产中,用于杀死蜂群中的螨虫。然而,氟氯苯氰菊酯在杀螨虫的过程中,对非靶标生物——蜜蜂也产生一定的危害,甚至污染蜂产品以及蜜蜂的食物,间接地影响着蜜蜂的健康[3-6]。本研究利用代谢组学的方法,探究了亚致死剂量的氟氯苯氰菊酯对西方蜜蜂工蜂幼虫代谢物的影响。研究发现 LC-MS技术能够分析蜜蜂幼虫的代谢物,谱图重叠良好;主成分分析和偏最小二乘判别显示各组平行样聚在一起,与对照组分开,说明氟氯苯氰菊酯影响着蜜蜂幼虫的代谢。图2-C中对照组样品中有一个未落在95%的置信区间内,可能是由于样品衍生化过程中的试验误差。PLS-DA分析模型显示结果稳定可靠。经过对代谢物进行检测发现,随着氟氯苯氰菊酯浓度的增加,差异代谢物也明显增加,鉴定到的差异代谢物也逐渐增加,说明氟氯苯氰菊酯浓度越高,对蜜蜂幼虫代谢影响越大。根据氟氯苯氰菊酯处理组与对照组之间差异代谢物的分子质量和二级质谱信息,筛选到 29种氟氯苯氰菊酯处理组与对照组间共同的差异代谢物,其中,尿苷二磷酸-N-乙酰葡糖胺、硫唑嘌呤、愈伤酸、9-羟基壬酸、氢过氧化亚油酸等代谢物变化较为明显,可能是由于氟氯苯氰菊酯对蜜蜂幼虫体内这些物质富集的代谢通路影响较大,表现为差异代谢物含量异常。
尿苷二磷酸-N-乙酰葡糖胺是蜜蜂脂多糖合成的重要前体。蜜蜂翅翼由双层体壁组成,每层体壁含有多层几丁质[13]。而在昆虫中,几丁质的合成对于其生长发育至关重要。蜜蜂幼虫生长发育到一定时期就要脱去旧表皮的束缚,躯体才会显著长大[14]。几丁质合成酶利用尿苷二磷酸-N-乙酰葡糖胺合成几丁质[15],经氟氯苯氰菊酯处理,造成尿苷二磷酸-N-乙酰葡糖胺合成系统紊乱,几丁质合成异常,蜜蜂蜕皮羽化过程失调,因而蜜蜂出现残翅现象,这从另一方面解释了牛新月[5]的研究结果中蜜蜂出现的残翅现象。
硫唑嘌呤与还原性谷胱甘肽反应最终转变为硫唑嘌呤活性代谢物6-硫鸟嘌呤核苷酸,其整合到细胞,影响DNA的复制及RNA的表达而发挥免疫抑制作用[16]。硫唑嘌呤在50 mg·kg-1组中的FC值高达22.9131,而0.5 mg·kg-1组仅为12.1241,表明随着氟氯苯氰菊酯剂量增加,硫唑嘌呤相对含量显著增加,具有明显的剂量依赖性。HERNANDEZ等[17]研究表明,谷胱甘肽S-转移酶(GST)是昆虫降解氟氯苯氰菊酯等杀螨剂的一种机制,亚致死剂量的氟氯苯氰菊酯会使得GST基因表达上调。除此之外,蜜蜂代谢氟氯苯氰菊酯引起硫唑嘌呤表达上调,硫唑嘌呤代谢需要大量的还原性谷胱甘肽参与反应,引起还原性谷胱甘肽表达上调,这从另一方面解释了蜜蜂的解毒机制。
愈伤酸、9-羟基壬酸为卵磷脂的代谢产物,有研究表明,卵磷脂有分解油脂、清除过氧化物的作用[18]。在蜜蜂体内,卵磷脂代谢为愈伤酸和9-羟基壬酸受到多种酶的调节,其中一个酶是过氧化物裂解酶(hydroperoxide lyase,HPL),HPL属于细胞色素P450(CYP450)类蛋白质家族中的一种[19]。CYP450在外来化合物,如农药、环境污染物和致癌物质的新陈代谢中起着至关重要的作用[20]。此外,CYP450在维生素代谢、不饱和脂肪酸的氧化和胆固醇的生物合成中起主要作用[21]。CYP450酶可以通过受体依赖机制被各种外源物质和内源底物转录激活[20]。药物在蜜蜂体内通过两个步骤:经CYP450酶的氧化还原反应及水解,再经GST的乙酰化、甲基化反应或毒物及其代谢物与内源性物质结合,加速毒物代谢或外排[22]。CYP450酶系具有降低过氧化水平的作用,而 9-羟基壬酸是脂肪酸过氧化的主要产物之一[23]。9-羟基壬酸是脂肪酸代谢产生的主要醛类物质,口服9-羟基壬酸可显著提高脂质过氧化水平,同时显著降低大鼠肝脏中脂肪的生成[24]。50 mg·kg-1组9-羟基壬酸FC值仅为 0.098,表明对照组 9-羟基壬酸的相对含量是 50 mg·kg-1组的 10倍。并且随着剂量的增加,FC值明显下降,表明 9-羟基壬酸和愈伤酸具有明显的剂量依赖性。而氟氯苯氰菊酯处理会使 9-羟基壬酸和愈伤酸含量下降,这可能是GST和CYP450酶共同作用的结果。
亚油酸是蜜蜂体内极为重要的不饱和脂肪酸之一,当蜜蜂缺乏亚油酸时,会出现蜕皮困难、发育不良、生长缓慢等症状[25]。亚油酸在脂肪氧合酶和CYP450的作用下容易被氧化[26],在脂肪氧合酶作用下,亚油酸主要形成氢过氧化十八碳二烯酸,而在CYP450作用下,亚油酸则经环氧化形成环氧化物[27]。GST是蜜蜂体内极为重要的解毒酶之一,其可以催化谷胱甘肽和有毒化合物的轭合,增加其水溶性,降低产物毒性,同时还能缓解氟氯苯氰菊酯等杀螨剂导致的氧化应激并减少脂质过氧化物的产生[28]。有研究表明,谷胱甘肽能抑制亚油酸的氧化[29]。除此之外,谷胱甘肽过氧化物酶可以分解机体产生的异常过氧化物,可催化还原型谷胱甘肽转化为氧化型谷胱甘肽,将毒性过氧化物转化为羟基化合物,以保护细胞膜免受氧化应激损伤[30]。而氢过氧化亚油酸是亚油酸过氧化的产物之一,氢过氧化亚油酸相对含量表明了氟氯苯氰菊酯对蜜蜂的氧化应激水平。氢过氧化亚油酸在0.5、50 mg·kg-1组的 FC 值分别为 0.4183、0.5253,但是5 mg·kg-1组FC值高达4.7824,表明氢过氧化亚油酸在低、高剂量组相对含量远低于对照组,中剂量组相对含量远高于对照组,可能是谷胱甘肽在发挥作用,阻止了亚油酸氧化,从而造成3组间氢过氧化亚油酸含量存在差异。氢过氧化亚油酸在不同剂量氟氯苯氰菊酯处理组中的相对含量与氧化型谷胱甘肽相对含量的趋势相似,这一结果表明谷胱甘肽在缓解脂质氧化应激中的作用,进一步表明在蜜蜂体内氟氯苯氰菊酯引起的氧化应激可能主要是由还原性谷胱甘肽参与消除的。
4 结论
运用液相色谱-质谱联用技术对氟氯苯氰菊酯处理后的蜜蜂工蜂幼虫的差异代谢物进行分析,筛选到29种对照组与处理组间共同的差异代谢物,其中有7种差异代谢物显著聚集于氨基糖和核苷酸糖代谢、药物代谢-其他酶类、α-亚麻酸代谢等途径,对这些结果进一步分析发现氟氯苯氰菊酯对蜜蜂幼虫的健康存在一定的威胁,研究结果可为进一步阐释蜜蜂的解毒机制提供参考。
