感染乙脑病毒小鼠脑组织的转录组变化分析
2021-08-10高明星张金花刘泽霖周静静胡薛英张万坡程国富谷长勤
高明星,张金花,刘泽霖,周静静,胡薛英,张万坡,程国富,谷长勤
(华中农业大学 动物医学院,湖北 武汉 430070)
日本乙型脑炎病毒(Japanese encephalitis virus,JEV)是由库蚊传播的黄病毒属的正链单链RNA病毒。JEV是一种神经入侵性病毒,会导致血脑屏障通透性发生改变[1]。JEV进入中枢神经系统后,在脑内复制和增殖,引起许多动物的脑炎和神经系统疾病,严重威胁人类和其他动物的生命安全[2]。在临床脑炎病例中,有20%~30%的病例是致命的,有30%~50%的恢复病例会有严重的神经系统症状[3]。虽然有商品化的疫苗,但JEV仍是亚洲病毒性脑炎的主要原因[4],可能与各国免疫制度有关。
RNA-Seq技术,又被称为转录组测序技术,已成为研究动物病毒传染病与宿主相互作用的重要技术之一[5]。探索JEV的致病机理,可以为更好的预防和治愈乙型脑炎提供科学依据。已有研究用转录组技术分析JEV感染巨噬细胞、敲除RIPK3基因小鼠和人神经母细胞瘤细胞后细胞因子和通路的变化[6-8]。然而至今很少有体内乙脑病毒感染在基因转录水平上较全面的调控机制分析。
本研究以105PFU的P3株乙脑病毒感染6周龄BALB/c雌鼠,感染6 d后分别取对照组和感染组脑组织,进行转录组分析,分析体内参与抗病毒过程的相关基因和途径,为乙脑的发病机制及防控提供理论依据。
1 材料与方法
1.1 毒株和试验动物乙型脑炎病毒P3株由华中农业大学微生物国家重点实验室曹胜波教授馈赠。病毒采取乳鼠脑内扩增,空斑试验测定病毒毒价。6周龄BALB/c雌鼠购自华中农业大学动物实验中心。
1.2 主要试剂和仪器JEV E蛋白单克隆抗体,由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠;HRP标记的羊抗鼠/兔IgG购于基因科技有限公司;固体DAB购于武汉博士德生物公司;TRIzol购自南京诺维赞有限公司;反转录试剂盒和荧光定量PCR试剂盒均购于TaKaRa公司。Nikon 80i生物光学显微镜购于日本Nikon公司;荧光定量PCR仪购于美国ABI公司。
1.3 试验设计及采样将30只6周龄BALB/c雌鼠随机分为2组,感染组(20只)腹腔注射105PFU JEV P3毒株0.5 mL,对照组(10只)腹腔注射同体积的DMEM。注射后5 d小鼠出现典型的神经症状。注射后6 d对照组小鼠随机处死9只,感染组选取神经症状明显的9只小鼠剖杀。随机3只小鼠脑组织混为1个样本,每组3个样本,共6个样本。剩余小鼠处死。对照组样本编号为CK-1、CK-2和CK-3,感染组样本编号为T1-1、T1-2和T1-3,送广州基迪奥生物科技有限公司进行测序。剩余的脑组织固定于10%中性福尔马林溶液中,用于组织学观察。
1.4 组织病理学观察和病毒抗原定位分析将上述固定完全的组织经脱水、透明、浸蜡、包埋后制作石蜡切片,切片厚度4~5 μm,HE染色,光学显微镜下观察小鼠脑组织的组织病理学变化。
抗原定位采用免疫组化(IHC)的方法,具体步骤简述如下:石蜡切片脱蜡至水;3%过氧化氢处理30 min,0.01 mol/L PBS洗涤2次;将玻片放入枸橼酸盐缓冲液中,蒸汽热修复,于95~100℃保持30 min,取出自然冷却;PBS洗涤后,5%BSA封闭30 min,滴加JEV E 蛋白单克隆抗体(1∶100),4℃过夜;PBS洗涤后滴加HRP标记的二抗室温作用30 min,PBS洗涤后DAB显色,苏木素衬染,中性树胶封片。利用光学显微镜与图像采集系统观察并采集图像。
1.5 转录组分析
1.5.1脑组织RNA提取 采用TRIzol法对脑组织样品进行RNA的提取,经检测确定合格后得到转录组测序使用的总RNA。
1.5.2cDNA文库构建及测序 样品提取总RNA后,对于真核生物,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入fragmentation Buffer使其成为短片段,再以短片段的mRNA为模板,用六碱基随机引物(random hexamers)合成cDNA第1链,并加入缓冲液、dNTPs、RNase H和DNA polymerase I合成cDNA第2链。经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱经末端修复、加碱基A及测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行PCR扩增,从而完成整个文库制备工作,构建好的文库用Illumina HiSeqTM进行测序。
1.5.3差异基因的筛选 使用edgeR软件对样本间基因表达量进行差异分析,利用FDR与log2(FC)来筛选差异基因,筛选条件为FDR<0.01且|log2FC|>1。
1.5.4DEGs GO与KEGG注释及富集分析 根据GO和KEGG注释结果以及官方分类,对筛选出的差异基因(DEG)与GO数据库中的分子功能(MF)、细胞组分(CC)、生物学过程(BP)以及KEGG Pathway数据库进行注释,同时进行富集GO条目筛选和Pathway显著性筛选。
1.5.5实时荧光定量PCR(qRT-PCR)验证 根据1.5.4分析结果,选择8个与JEV进入机体和复制有关的差异基因,进行RT-qPCR定量验证。其中与免疫相关的Trim25显著上调,Hes5、P2ry12、Bpifa1和Cd4显著下调;与炎症相关的基因TNF-α、SOCS1和SOCS3显著上调。反应的引物序列如表1。应用TaKaRa荧光定量PCR试剂盒进行Q-PCR反应。扩增条件:预变性95℃ 30 s;进入循环,95℃ 5 s,56℃ 30 s,共40个循环;溶解曲线分析,95℃ 15 s,60℃ 30 s,95℃ 15 s。计算出的Ct采用2-ΔΔCt法计算基因的mRNA转录水平。

表1 差异基因 Q-PCR引物序列
2 结果
2.1 JEV感染小鼠的脑组织病理变化及病毒抗原的定位镜下观察脑组织,对照组小鼠脑组织无明显病理变化(图1A),而JEV感染后小鼠脑内发现单核样细胞大量浸润、神经元变性坏死,小胶质细胞增生明显,同时脑内血管周炎性细胞渗出明显(图1B),部分区域可形成明显的管套现象。
IHC结果显示:对照组小鼠脑组织切片背景清晰(图1C),JEV抗原的阳性信号呈棕黄色,主要定位在神经元的胞质。感染组小鼠脑组织的不同区域内均可见大量的抗原阳性的细胞(图1D)。
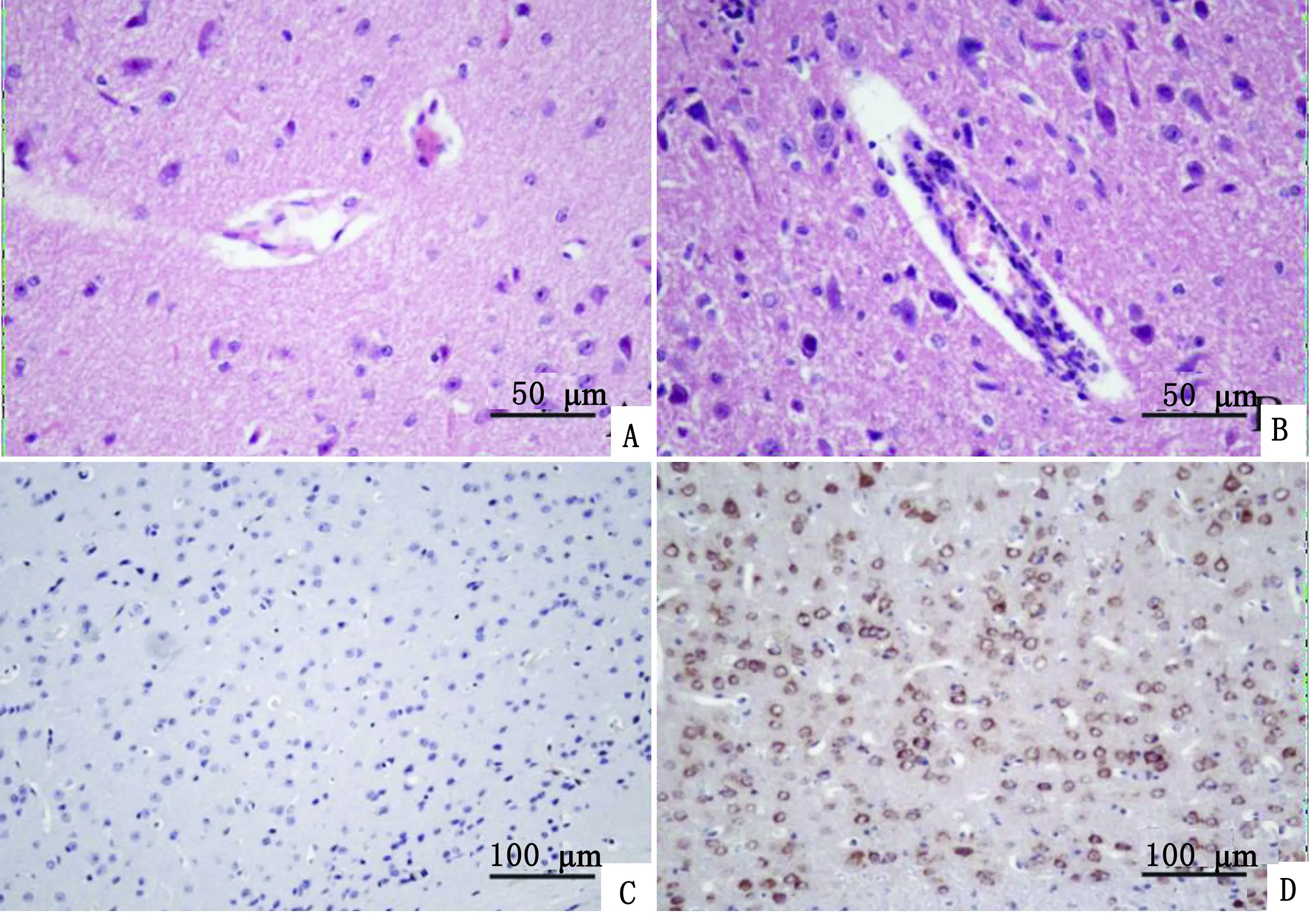
A.对照组小鼠脑组织,HE;B.JEV组小鼠脑组织血管周淋巴细胞浸润,HE;C.对照组小鼠脑组织,IHC;D.JEV组小鼠脑组织(棕黄色指示细胞质中的JEV抗原),IHC
2.2 测序数据及质量情况使用Illumina HiSeqTM平台一共测了6个样本,下机后对经过初步过滤得到的Clean Reads进行进一步更严格的过滤,得到High Quality Clean Reads,比对到物种的参考基因组上,Clean Reads Q30(%)都在95%以上,满足Q30标准;不确定碱基(N)比例均小于0.01%(表2);从测序结果分析可以看出数据质量较高,可用于后续分析。
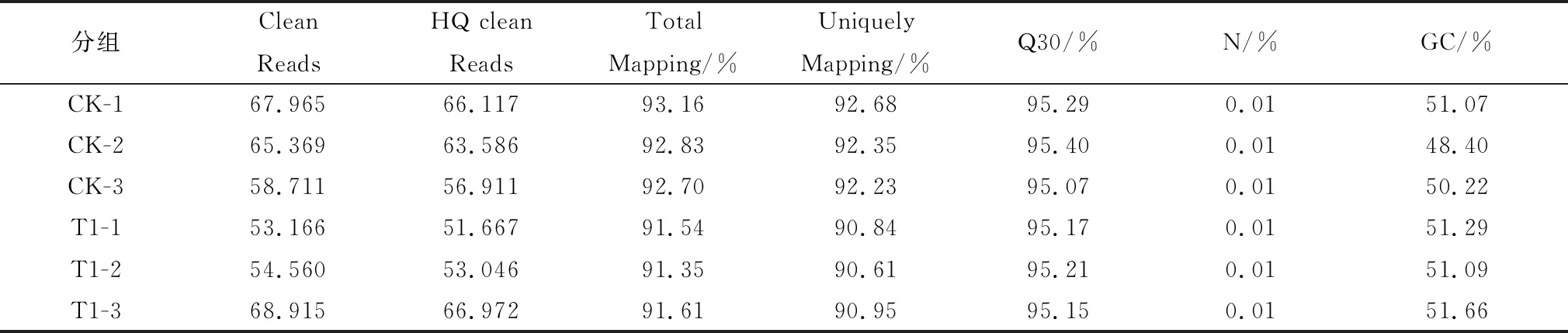
表2 转录组测序数据产出情况汇总表
2.3 差异基因的筛选以FDR<0.01且|log2FC|>1,作为筛选标准,筛选对照组(CK组)与感染组(T1组)之间的差异表达基因,差异表达基因有1 940 个,其中有1 813个基因上调表达,127个基因下调表达(图2),大部分都与炎症、免疫、防御反应相关。对T1组参与免疫系统过程的相关差异基因进行功能注释见表3。

表3 免疫相关差异基因
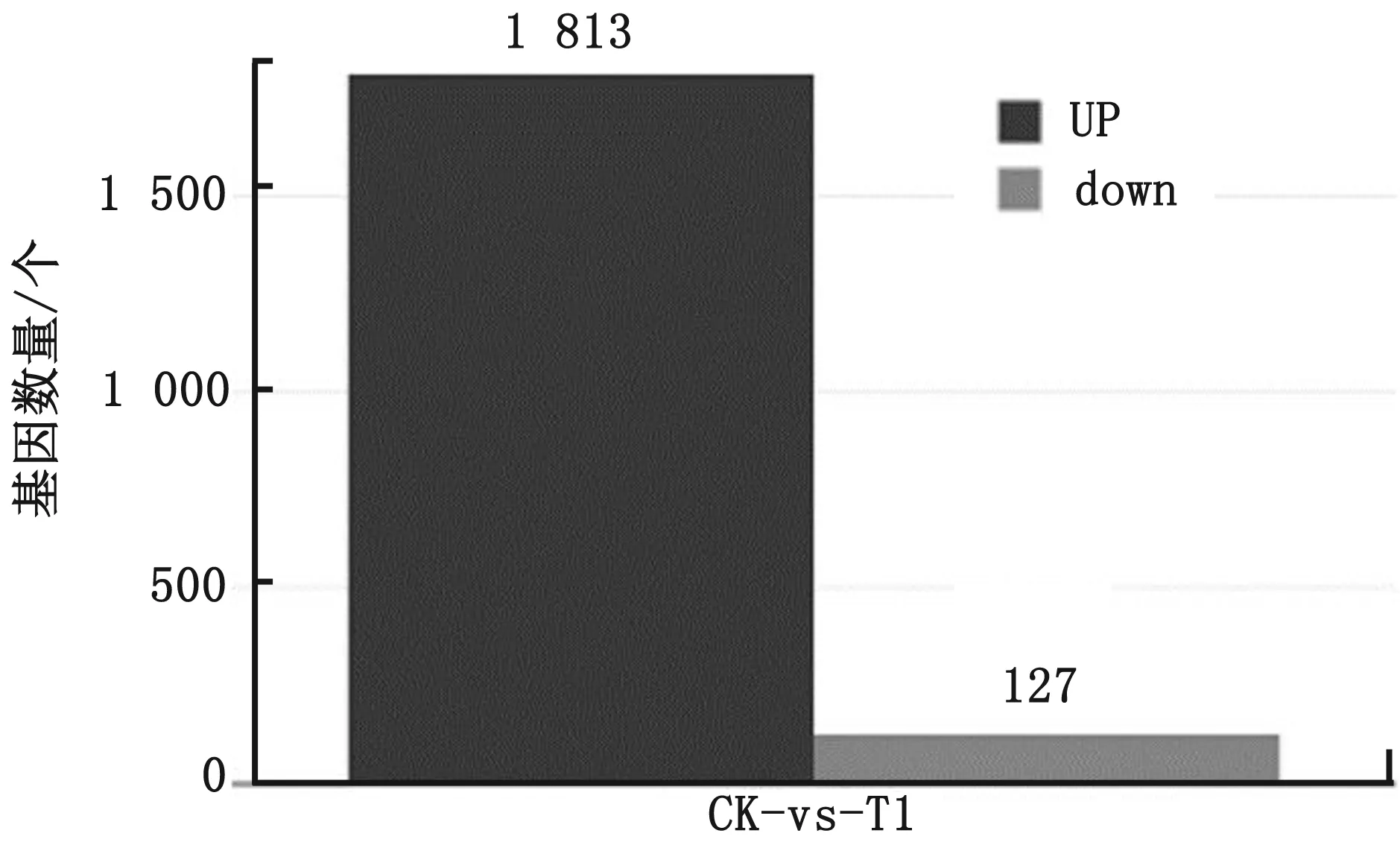
图2 差异表达基因数量统计表
2.4 差异基因的GO分析将T1筛选到的差异基因进行GO聚类功能分析,总共涉及41种生物功能(图3)。T1组生物学过程中涉及到细胞过程、单一生物过程、对刺激的反应注释量较多。涉及免疫系统过程的有651个差异基因,其中637个上调表达,14个下调表达。并且免疫系统过程是最显著富集的GO Term(图4)。在细胞组分中细胞、细胞部分、细胞器注释量较多;在分子功能中结合、催化活性注释量较多。

图3 差异基因GO注释
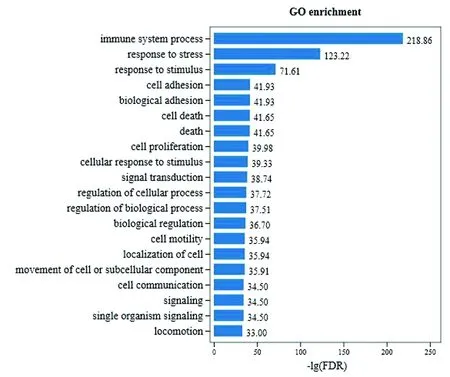
图4 BP中显著性柱状图
2.5 差异基因的KEGG分析T1组共筛选到820个差异基因,富集到KEGG数据库中,被注释到具体的代谢通路268条。筛选出差异基因显著性富集最多的前几条代谢通路(图5),分别是细胞因子与细胞因子受体的相互作用(Ko04060)、单纯疱疹感染(Ko05168)、TNF信号通路(Ko04668)、NF-κB信号通路(Ko04064)、破骨细胞分化(Ko04380)。Pathway数目统计图可以展示基因在KEGG Pathway中的基因数量,参与到免疫系统这个通路的差异基因有302个,是参与基因数量最多的(图6)。
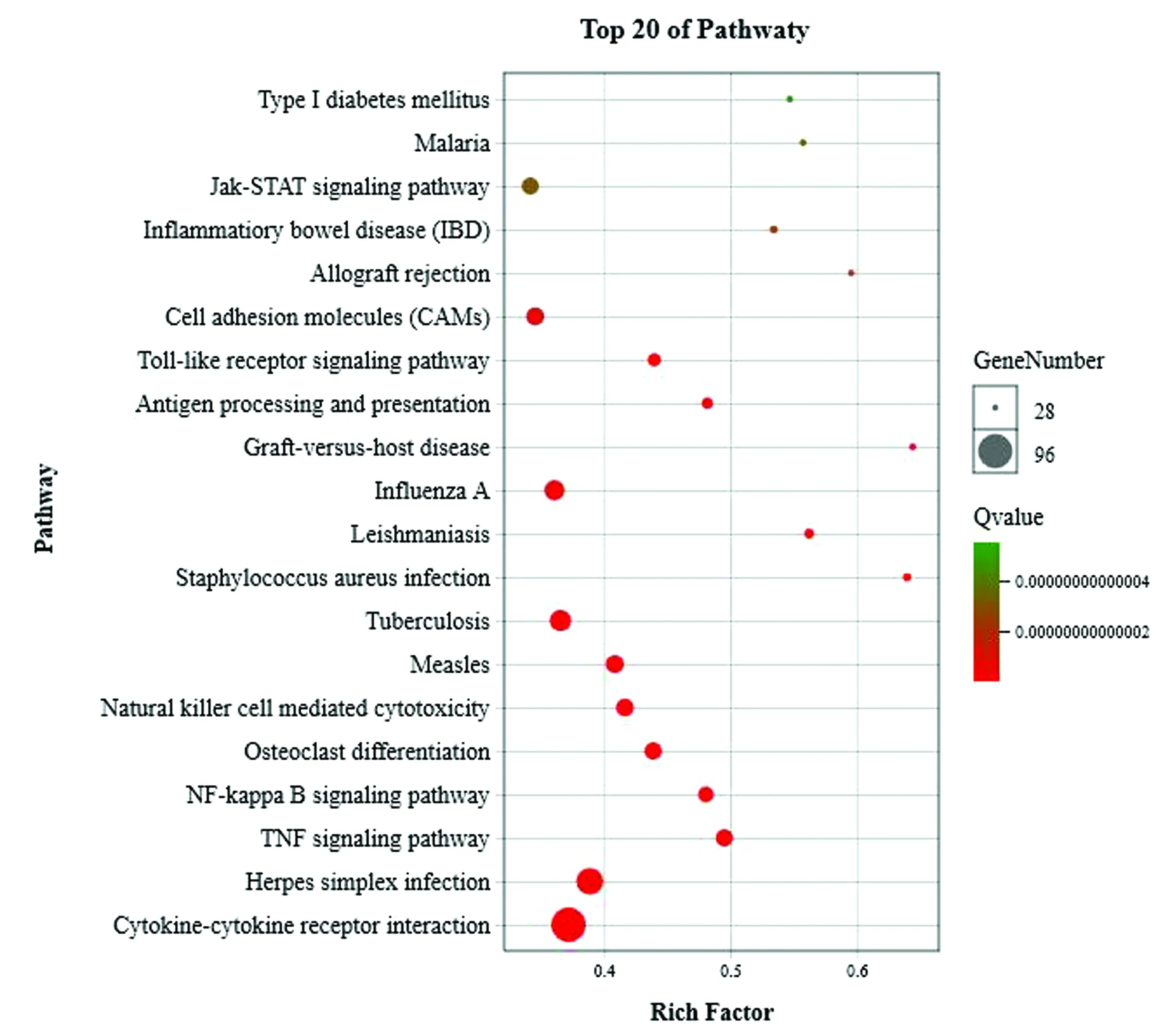
图5 差异基因KEGG Pathway富集气泡图
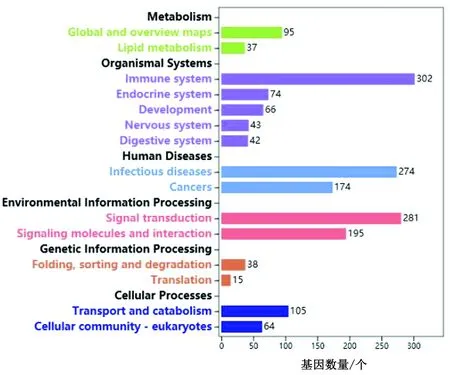
图6 Pathway数量统计图
2.6 荧光定量RT-PCR验证qPCR验证结果显示:Trim25、Hes5、P2ry12、Bpifa1、Cd4、TNF-α、SOCS1和SOCS3这8个基因的差异倍数与RNA-Seq结果表达趋势基本一致(图7)。

差异基因
3 讨论
目前对大部分黄病毒致病机理的研究都建立了小鼠疾病模型。本试验接毒后5~6 d的发病小鼠呈现典型的神经症状,部分小鼠出现立毛、弓背及运动功能障碍的表型症状。JEV感染小鼠后5~10 d,张金花等[9]病理学观察发现大脑灰质神经元变形坏死,胶质细胞增生及血管周围炎性细胞聚集等显著的炎性反应。这与本研究组织病理学结果一致。结合大部分神经元细胞JEV抗原阳性反应,证明成功建立了小鼠的乙脑模型。
本试验对JEV感染小鼠脑组织进行高通量测序分析,共筛选到1 913个差异表达基因,大都与炎症、免疫反应相关。GO功能富集分析中,免疫系统过程是最显著富集的GO Term。JEV感染人神经上皮瘤细胞的转录组也证实了许多与免疫有关的基因发生变化,差异基因主要涉及抗微生物反应、细胞信号传导、细胞功能和维持等[10]。JEV感染人神经母细胞瘤细胞差异基因转录本的GO term分析发现2个主要功能的mRNA显著富集:内质网核信号和内质网的未折叠反应。并且内质网中的蛋白质加工是最显著富集的生物学通路[8]。前几个显著富集功能不同可能由于本研究中使用的小鼠和人源细胞之间的物种差异导致。
在KEGG富集分析中,参与到免疫系统的差异基因数目最多,富集的通路直接或间接都与抗病毒反应有关,分别是细胞因子-细胞因子受体相互作用、JAK-STAT信号通路、Toll样受体信号通路、NF-κB信号通路和TNF信号通路。JAKs激活后磷酸化受体及胞内转录因子STAT及STAT蛋白转运到细胞核中,激活一系列细胞因子的转录[11]。内质网应激反应的相互作用网络的一部分包含组成免疫信号通路的部分,比如STAT、JNK和NF-κB。本研究中JEV感染导致小鼠内质网应激蛋白PERK、ATF4、CHOP的表达增加,WANG等[12]研究表明体内和体外JEV感染可以通过二聚化激活PERK,并通过PERK-ATF4-CHOP途径导致细胞凋亡。CARR等[8]研究发现JEV感染后抗氧化剂Sestrin 2上调,并且内质网应激途径转录本显著上调。这与以上的研究结果一致。表明JEV在体内与体外神经元细胞内复制,刺激机体发出趋化信号,进而激活适应性免疫反应,从而引起机体基因变化,整个过程是一个多基因参与表达且调控的复杂网络系统。同时,视黄酸诱导型基因1样受体(RIG-1)、Toll样受体3(TLR3)等模式识别受体可以识别病毒成分,经过一系列信号转导激活AP-1和NF-κB介导的炎症反应,诱导各种ISGs的表达,防止病毒入侵[13]。这与JE的神经病理学一致,其特征是严重的神经炎症和以巨噬细胞和活化T细胞为主的炎性细胞浸润[14]。
本研究中SOCS1和SOCS3转录本均显著上调,并且共同在JAK-STAT信号通路中发挥关键作用。KUNDU等[15]研究发现随着感染时间延长,JEV会上调细胞因子信号传导抑制剂SOCS1和SOCS3的表达,改变JAK-STAT信号传导级联,抑制炎性细胞趋化因子的释放,从而破坏宿主的先天性免疫反应,有助于病毒的复制。另外YE等[16]证明JEV NS5蛋白通过与核转运蛋白KPNA2、KPNA3和KPNA4相互作用,抑制干扰素调节因子3(IRF3)和NF-κB的表达。JEV感染也诱导RIPK3的表达,抑制IFI44L等ISGs的表达[7],这表明JEV会通过某种机制阻止细胞信号传导,抑制I型干扰素(IFN)反应和抗病毒反应,逃避宿主先天免疫反应。
在JEV感染过程中,宿主的先天性免疫应答对于限制病毒复制和清除宿主体内的病毒是非常重要的。本研究中,采用RNA-Seq得到JEV感染小鼠后脑组织的详细转录组学,系统性分析了JEV感染机体后免疫相关基因参与的代谢途径与信号转导途径,为研究机体的抗病毒反应提供了理论依据。
