腹腔镜超声下左半肝切除术治疗原发性肝癌的近期预后及对肝功能的影响
2021-08-10华小斌卢正磊夏云连刘小虎徐永建
华小斌,卢正磊,夏云连,刘小虎,徐永建
(1.安徽省亳州市人民医院肝胆胰外科,安徽亳州236800;2.安徽医科大学第一附属医院普通外科,安徽合肥230022)
原发性肝癌(primary liver cancer,PLC)是全球高发恶性肿瘤,也是我国四大常见恶性肿瘤之一,居恶性肿瘤相关致死率第3 位[1]。外科治疗是PLC 患者获得长期生存的重要手段之一,其中,又以肝切除术为主。但中晚期肝癌切除后残余肝体积不足或创伤过大而受限。随着腹腔镜技术的不断发展,腹腔镜下肝癌切除术已获得广泛认可,相较于传统开腹手术,具有痛苦小、康复快等优势,逐步成为PLC 治疗的首选术式[2]。但由于腹腔镜手术中术者无法触诊腹腔内重要脏器或结构,加之腹腔镜显示器所提供的“二维平面”视野存在立体感缺失,难以对重要脏器进行触诊而“触觉丧失”,因而大大增加了腹腔镜手术的风险[3]。术中超声在手术中的应用表现出较大优势,不仅可帮助术者观察到难以经肉眼或手触及发现的内部病灶,且更有利于发现微小病灶,术中还可实时引导术者操作,避免误伤重要结构或脏器,这促进了腹腔镜超声(laparoscopic ultrasound,LUS)的诞生[4]。LUS 是一种腹腔镜与腹腔内超声探头组合的技术,弥补了单纯腹腔镜手术的缺陷,且已有研究[5]表明LUS 在恶性肿瘤的腹腔镜手术中应用优势明显。但LUS 的临床应用时间尚短,目前仍缺乏充分研究报道,尤其是对PLC 的治疗效果仍需进一步分析[6]。本研究对左肝PLC 患者采用LUS下左半肝切除术治疗,观察其近期预后及对肝功能的影响,并与常规腹腔镜术式进行比较,以期为临床决策提供参考。
1 资料与方法
1.1 一般资料
选取2017年1月─2020年1月期间,在安徽省亳州市人民医院就诊并接受外科治疗的左半肝PLC患者64 例作为研究对象。根据术式分为两组:30 例行LUS 下左半肝切除术为LUS 组,34 例行常规腹腔镜下左半肝切除为常规组。两组患者的一般资料[性别、年龄、体质量指数(body mass index,BMI)、肿瘤直径、病灶数目、Child-Pugh 分级、TNM 分期、中国肝癌分期(Chinese liver cancer staging,CNLC)等]经检验,差异均无统计学意义(均P>0.05)(表1)。
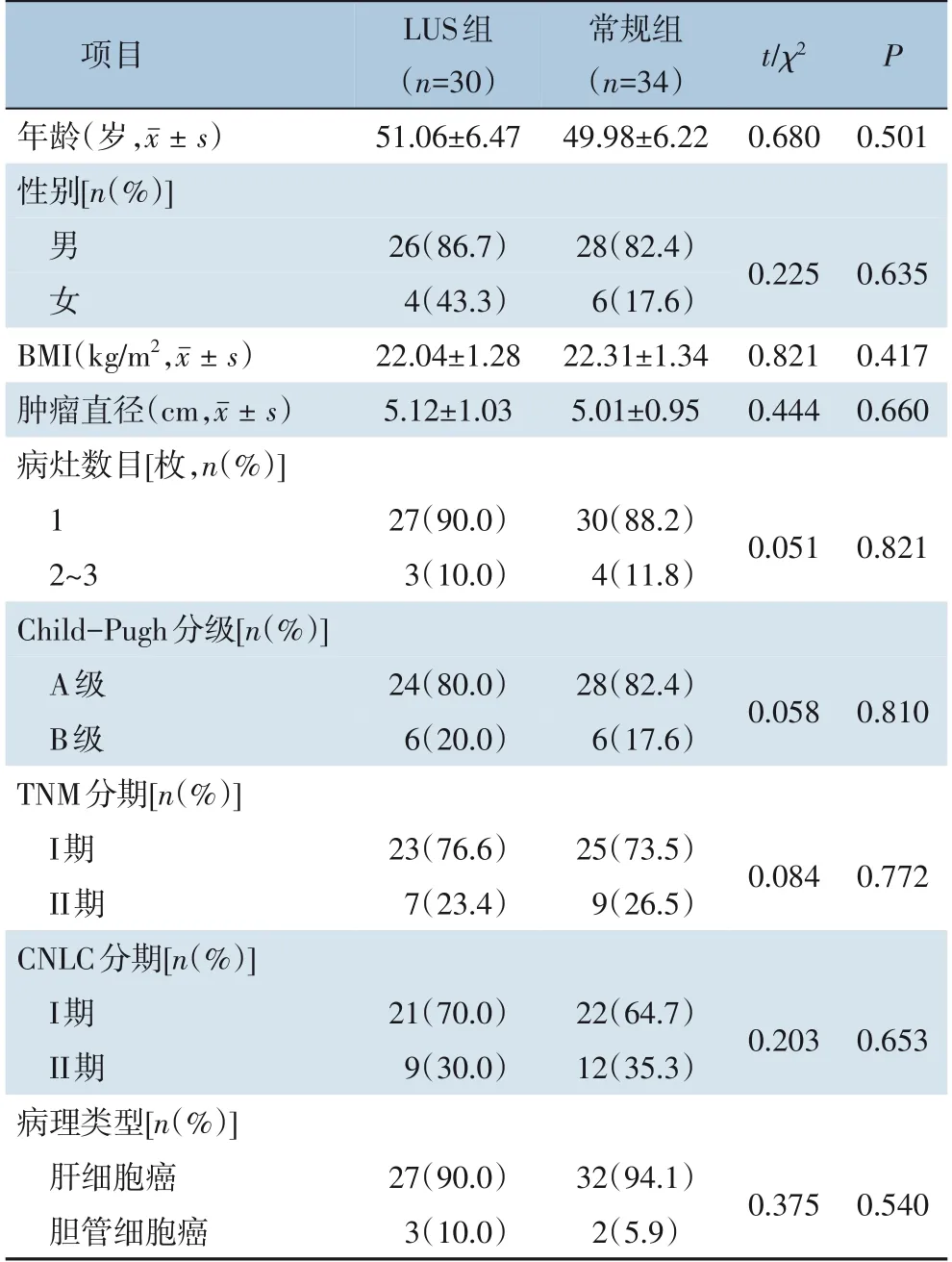
表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups of patients
纳入标准:⑴术前经CT、MRI、活检组织病理学检查等诊断为PLC,且经术中或术后病理证实;⑵具有外科手术指征[7],且病灶局限于左半肝,最大肿瘤直径<8 cm;⑶单发肿瘤或多发但病灶均位于同一肝段或同侧半肝;⑷肿瘤内缘与肝中静脉距离≥3 cm;⑸Child-Pugh 分级为A 级或B 级;⑹TNM 分期为Ia 期、Ib 期或IIa 期;⑺术前未接受放疗、化疗等相关治疗;⑻患者能够耐受腹腔镜手术,临床资料完整并坚持随访≥12 个月。排除标准:⑴肿瘤侵犯相邻脏器或发生远处转移者;⑵严重腹腔内粘连,预计术中分离困难者;⑶具有凝血功能障碍、心肾功能衰竭者;⑷合并其他原发性恶性肿瘤者;⑸精神状态异常、妊娠或哺乳期妇女等特殊人群患者。
1.2 治疗方法
LUS 组:采用日本日立HITACHI ALOKA Noblus型LUS 及L44LA 型软质探头,探头频率7.5 MHz。麻醉医生为同一名高年资副主任医师,主刀医生为同一名主任医师。完善术前B 超、CT、MRI 等常规检查,除外肝内及远处转移者。均为择期手术。患者取平卧位,气管插管全身麻醉,经脐下1 cm左右建立弧形切口,置入10 mm Trocar,建立CO2气腹,压力12~14 mmHg(1 mmHg=0.133 kPa),置入LUS。根据术者习惯、病灶位置等,经脐平面左、右腹直肌外缘,或左、右上腹肋缘下等检查通道。逐次进行肝脏膈面、脏面扫描,先行需保留的非病灶区扫描,再行病灶所在区域扫描,如病灶位置较深,则可将圆韧带、镰状韧带、左冠状韧带等周围韧带切开后,将LUS 探头伸入、移动扫描。怀疑病灶周围分布有重要血管或肝内重大血管者,启用LUS 的彩色多普勒功能进行扫描。在镜下游离并离断肝左动脉,如有肝中动脉亦予以游离和离断处理。显露门静脉左支,探查门静脉右支及其主干,夹闭并切断门静脉左支,以控制左半肝供血。游离并切断肝圆韧带、镰状韧带、左冠状韧带及三角韧带等,使左半肝处于游离状态。LUS 检查后进行第二肝门解剖,谨慎分离、夹闭后切断肝左静脉,如解剖困难不必强行游离,以免伤及重要静脉,可采用LUS 定位肝中静脉,于其左侧1 cm 左右标记作为断肝切除线。采用直线切割闭合期或者Hemo-Lock 等进行血管及胆管结扎后,以超声刀结合CUSA 沿缺血线将肝实质离断,遇管道均用Hemo-Lock 或者可吸收生物夹夹闭,以直线切割闭合器离断左肝静脉根部,经耻骨上切口取出病灶标本(图1)。出血点以电凝止血,确认无活动性出血及胆汁漏后,留置引流管,缝合切口,术毕。
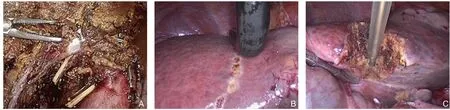
图1 LUS下左半肝切除术A:术中显露肝中静脉;B:LUS定位肝中静脉;C:CUSA沿缺血线断肝Figure 1 LUS left hemihepatectomyA:Exposure of the middle hepatic vein during operation;B:Positioning of the middle hepatic vein with LUS;C:Liver parenchymal transection along the ischemic demarcation line with CUSA
常规组:术前常规行超声、CT 和(或)MRI等影像学检查,定位病灶并明确病灶数量、大小等,确定切除范围并预估手术风险。气管插管全身麻醉,根据肿瘤位置、大小实施常规“五孔法”,入腹探查,游离肝周韧带并充分显露肿瘤灶,先行第一肝门血管处理,离断肝左动脉和门脉左支后,根据肝缺血线或解剖学Cantilie 线标记作为切除线,结扎、断肝等操作同LUS组(图2)。

图2 常规腹腔镜下左半肝切除术A:常规超声定位后标记肝预切线;B-C:未显露肝中静脉后肝断面Figure 2 Conventional laparoscopic left hemihepatectomyA:Marking of the line of resection after conventional untrasound positioning;B-C:The cut surface of liver without exposure of the middle hepatice vein
1.3 观察指标
记录两组围手术期指标,包括中转开腹术情况、手术时间、术中出血量、病灶切缘距离、引流管置管时间、术后首次肛门排气时间、住院时间;统计并发症发生情况,包括术中肝中静脉损伤、术后感染、术后出血、胆汁漏等;分别于术前、术后3 d、术后1 个月,晨取空腹静脉血3.0 mL,采用肝脏储备功能定量分析仪检测白蛋白(albumin,ALB)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBIL)、甲胎蛋白(AFP)、凝血活酶时间(APTT)、纤维蛋白原(FIB)、凝血酶原时间(PT);术后采用电话随访结合定期门诊复查的方式进行随访,门诊复查内容包括腹部超声、CT 和(或)MRI 检查等。
1.4 统计学处理
研究数据的统计学处理采用SPSS 24.0 统计软件。计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验或Fisher 检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验或方差分析;P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者围手术期指标比较
两组患者均顺利完成手术,无中转开腹术者。LUS 组术中无肝中静脉损伤,常规组5 例肝中静脉损伤,经Fisher 确切概率检验组间差异有统计学意义(P=0.036)。两组的手术时间、病灶切缘距离、术后引流管置管时间、肛门排气时间、住院时间比较,差异均无统计学意义(均P>0.05);LUS 组的术中出血量低于常规组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者围手术期指标比较(±s)Table2 Comparison of the perioperative variables between the two groups of patients(±s)
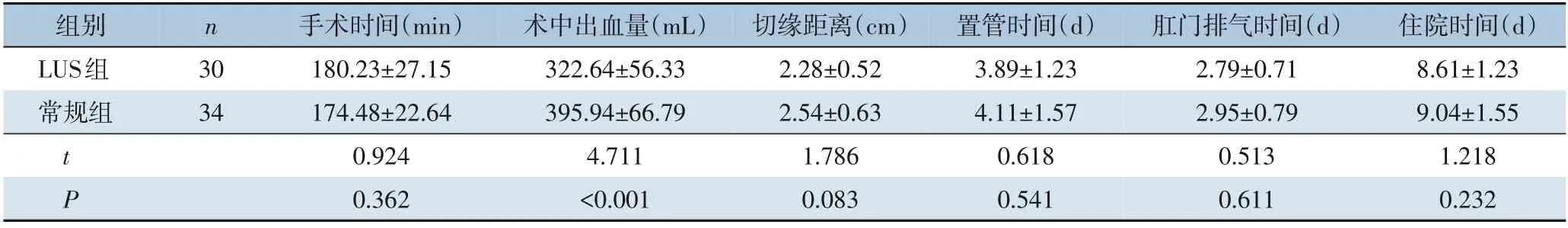
表2 两组患者围手术期指标比较(±s)Table2 Comparison of the perioperative variables between the two groups of patients(±s)
组别LUS组常规组n 30 34 t P手术时间(min)180.23±27.15 174.48±22.64 0.924 0.362术中出血量(mL)322.64±56.33 395.94±66.79 4.711<0.001切缘距离(cm)2.28±0.52 2.54±0.63 1.786 0.083置管时间(d)3.89±1.23 4.11±1.57 0.618 0.541肛门排气时间(d)2.79±0.71 2.95±0.79 0.513 0.611住院时间(d)8.61±1.23 9.04±1.55 1.218 0.232
2.2 两组患者术后并发症发生情况比较
切口感染者经换药处理后愈合,肺部感染者经抗生素治疗等痊愈,胸腔结业者未经特殊处理自行吸收,胆汁漏者经留置引流管通畅引流后治愈,腹腔出血者经抗感染、止血药物治疗后控制。两组并发症发生率经检验差异无统计学意义(P>0.05)(表3)。
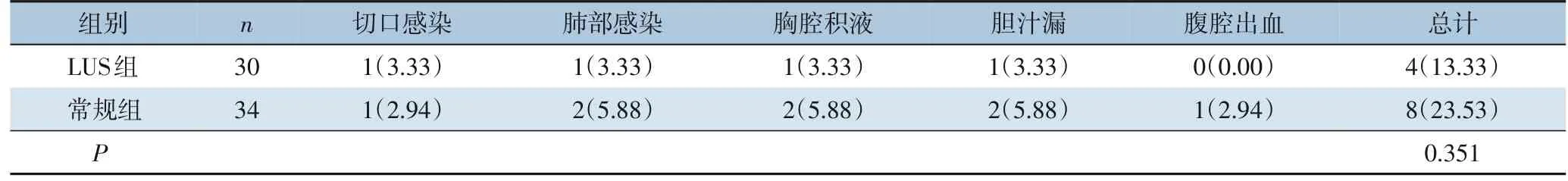
表3 两组患者术后并发症发生情况比较[n(%)]Table3 Comparison of the postoperative complications between the two groups of patients[n(%)]
2.3 两组患者肝功能指标及AFP水平比较
两组患者术前ALB、ALT、AST、TBIL 及AFP水平比较,差异均无统计学意义(均P>0.05);两组患者术前、术后3 d、1 个月APTT、FIB 和PT 比较,差异均无统计学意义(均P>0.05);术后3 d,两组ALB、ALT 及AST 水平均急增,且LUS 组低于常规组(均P<0.05);术后1 个月,两组ALB、ALT及AST 水平均较术后3 d 下降,但两组间比较差异无统计学意义(均P>0.05);术后3 d、1 个月,两组AFP、TBIL 均明显降低(均P<0.05),术后3 d 时LUS 组的TBIL 低于常规组(P<0.05),但两组间AFP 比较差异无统计学意义(P>0.05)(表4)。
表4 两组患者肝功能指标及AFP水平比较(±s)Table 4 Comparison of the liver function indexes and AFP levels between the two groups of patients(±s)
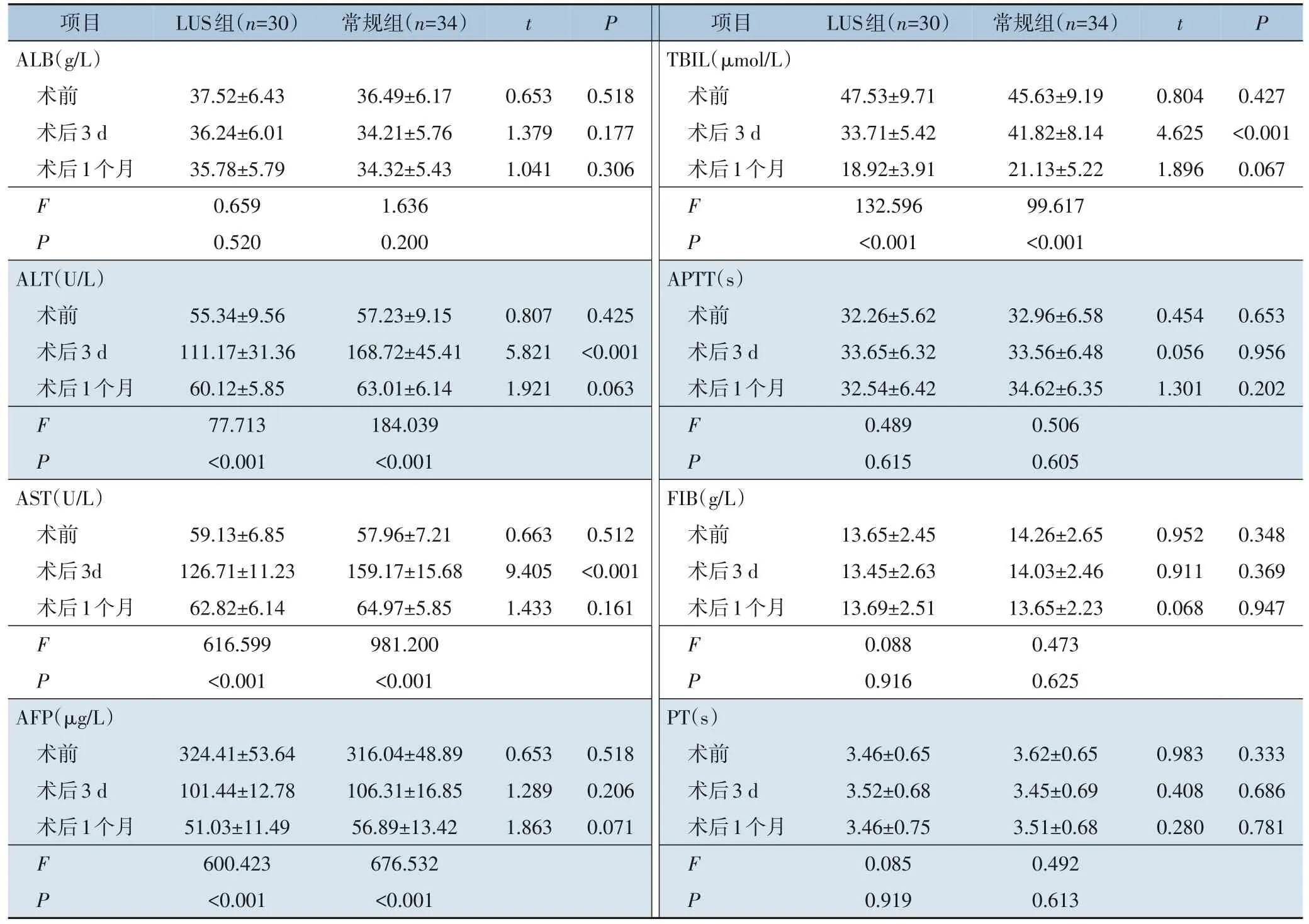
表4 两组患者肝功能指标及AFP水平比较(±s)Table 4 Comparison of the liver function indexes and AFP levels between the two groups of patients(±s)
项目ALB(g/L)术前术后3 d术后1个月LUS组(n=30)常规组(n=34)t P 项目TBIL(μmol/L)术前术后3 d术后1个月常规组(n=34)37.52±6.43 36.24±6.01 35.78±5.79 0.659 0.520 t P 0.518 0.177 0.306 36.49±6.17 34.21±5.76 34.32±5.43 1.636 0.200 0.804 4.625 1.896 0.653 1.379 1.041 0.427<0.001 0.067 F P F P 45.63±9.19 41.82±8.14 21.13±5.22 99.617<0.001 47.53±9.71 33.71±5.42 18.92±3.91 132.596<0.001 ALT(U/L)术前术后3 d术后1个月APTT(s)术前术后3 d术后1个月57.23±9.15 168.72±45.41 63.01±6.14 184.039<0.001 0.807 5.821 1.921 0.653 0.956 0.202 55.34±9.56 111.17±31.36 60.12±5.85 77.713<0.001 0.425<0.001 0.063 F P F P 32.26±5.62 33.65±6.32 32.54±6.42 0.489 0.615 32.96±6.58 33.56±6.48 34.62±6.35 0.506 0.605 0.454 0.056 1.301 57.96±7.21 159.17±15.68 64.97±5.85 981.200<0.001 0.663 9.405 1.433 AST(U/L)术前术后3d术后1个月0.512<0.001 0.161 13.65±2.45 13.45±2.63 13.69±2.51 0.088 0.916 FIB(g/L)术前术后3 d术后1个月0.348 0.369 0.947 59.13±6.85 126.71±11.23 62.82±6.14 616.599<0.001 14.26±2.65 14.03±2.46 13.65±2.23 0.473 0.625 F P F P 0.952 0.911 0.068 316.04±48.89 106.31±16.85 56.89±13.42 676.532<0.001 324.41±53.64 101.44±12.78 51.03±11.49 600.423<0.001 AFP(μg/L)术前术后3 d术后1个月0.518 0.206 0.071 PT(s)术前术后3 d术后1个月0.653 1.289 1.863 0.333 0.686 0.781 LUS组(n=30)3.46±0.65 3.52±0.68 3.46±0.75 0.085 0.919 3.62±0.65 3.45±0.69 3.51±0.68 0.492 0.613 0.983 0.408 0.280 F P F P
2.4 两组患者近期随访结果比较
所有患者均获得随访,术后随访时间9~18 个月,中位随访时间13.5 个月。随访期间,LUS 组3 例(10.00%)分别于术后第10、12、15 个月复发,均为肝内复发,1 例死亡,生存率为96.67%;常规组6 例(17.65%)复发,复发时间为术后9~14 个月,其中5 例肝内复发,1 例肺转移,2 例死亡,生存率为94.12%。两组的复发率、病死率比较,差异均无统计学意义(P=0.483、0.999)。
3 讨论
外科手术是当前治疗PLC 的首选治疗方案,大量研究表明外科手术切除能够有效延长患者的生存期,目前以腹腔镜切除术应用较多[8]。常规腹腔镜手术仅借助术前影像学检查,在腹腔镜视野下判断病灶情况并确定肝切除范围,二维成像效果有限,术中可能观察到的肝缺血线不够清晰,加之肝动脉与门静脉多具有交通支及侧支血管,往往难以形成缺血线或缺血线不明显,术中定位及切除困难,容易造成肝中静脉损伤,导致术中出血量增加[9-10]。常规半肝阻断法主要阻断第一肝门入肝血供,并未兼顾参与肝叶的静脉回流,但肝静脉多存在变异,尤其是门静脉变异或在肝内炎症、病灶挤压或牵拉等情况下,容易发生肝中静脉偏移,增加术中肝中静脉损伤风险[11]。还有部分患者具有肝中动脉,切除左半肝时需要切除肝中动脉,进一步影响残余肝脏血供,增加手术创伤及出血。
LUS 下腹腔镜肝切除术则融合了超声与腹腔镜微创的优势,可利用屈曲软质探头获取全面的肝脏信息,可避免腹壁组织、肠内气体等的干扰,LUS 能够准定位肿瘤解剖位置、大小及形态等,并能够精准界定病灶浸润范围,还可发现微小卫星灶以及转移病灶,并可标记重要管道结构等,弥补了常规腹腔镜手术辨别重要解剖结构的“盲区”及缺乏深部组织碳核查能力的缺陷[11-13]。本研究结果显示,LUS 组与常规组的手术时间差异无统计学意义,提示在经过一定的学习曲线,熟练掌握和运用LUS 的情况下,不会增加左半肝切除的手术时间。同时,LUS 组的术中出血量较常规组明显降低,术中无肝中静脉损伤,而常规组有5 例(14.71%)肝中静脉损伤,组间差异有统计学意义。姚本来等[14]研究亦显示,相比于常规腹腔镜手术,LUS 下肝切除术更有利于降低肝中静脉发生风险,且在技术熟练的情况下并不增加手术时间,这与本研究结论基本一致。LUS 的探头频率高于常规二维超声,加之彩色多普勒技术的应用,更有利于获取清晰的超声图像,精确定位病灶与周围组织、血管的立体解剖关系,便于术者判断肝门部管道结构是否存在变异,验证肝门部解剖的正确性,并可更为精准地确定和标记肝中静脉,便于术中标记切除线和调整断肝平面,指导术者操作,提高操作的精准性,降低大血管及其分支的损伤风险,不仅有利于减少出血,还可减少缺血再灌注损伤[15-17]。但两组在术后引流管置管时间、肛门排气时间、住院时间方面,差异并无统计学意义,提示LUS 技术的应用不足以显著提高手术操作水平,故对术后拔管、住院等的影响并不明显。术后感染、出血、胸腔积液等均是肝切除术后常见并发症,多因拔管过早或置管不当引起[18]。本研究中,两组整体并发症发生率差异并不显著,但LUS 的发生率略有下降,尤其是胸腔积液、胆汁漏、腹腔出血等有所减少,考虑为LUS 引导下操作更为精准,可减少肝中静脉等损伤,故可减少术后出血等发生风险,即便发生肝创面渗血也可采用超声刀等进行精准止血[19]。
完整切除肿瘤的同时,保留充足的残余肝脏体积(future liver remnant,FLR)以确保术后肝功能代偿能力充足,这也是改善临床预后的关键[20]。本研究中,两组的病灶切缘均为阴性,获得了良好的根治效果,两组间病灶切缘距离差异无统计学意义,但LUS 组仍有所降低,提示LUS 下半肝切除能够在确保肿瘤阴性切缘的同时,保留充足的FLR 并保护肝中静脉。肝功能检测亦显示,两组术后3 d 均存在一过性肝功能指标升高,术后1 个月回降并接近术前水平,但术后3 d 时LUS 组ALT、AST 水平均低于常规组,提示LUS 腹腔镜左半肝切除术可能更有利于保护术后早期肝功能代偿,这可能与LUS 引导下操作更有利于保护重要功能性管道,保护残余肝脏的有效血流灌注,更有利于术后早期残肝功能的恢复。AFP 与PLC 的发生及发展关系密切,是诊断PLC 的敏感指标,且被证实是影响PLC 术后生存的危险因素[21-24]。本研究中,两组术后3 d、1 个月时AFP 水平均较术前明显降低,但组间差异并无统计学意义,两组围术期凝血指标差异并无统计学意义,推测两种术式的治疗效果可能差异不大。研究表明,术中出血量是影响肝切除术安全性的关键,出血量过大将导致术后免疫功能降低,增加残留肿瘤细胞播散及肿瘤复发风险[25]。部分研究认为,LUS 下腹腔镜肝切除术对组织的损伤较常规腹腔镜肝切除术更小,术中出血更少,术后应激反应更轻,术后患者的免疫抑制程度也相对较轻[24]。还有研究[25]认为,LUS 较CT、MRI 等更有利于在术中发现肝转移,尤其是对直径<10 mm 的微小肝转移,更有利于术中清除病灶,改善临床预后。朱沭等[26]研究亦显示,LUS 引导下门静脉穿刺注射吲哚菁绿荧光肝段染色可引导断肝操作中肝断面的选择,有利于帮助术者实现真正意义上的腹腔镜解剖性肝段切除。还有Meta 分析显示,相较于非解剖性肝切除而言,解剖性肝切除有利于降低肝癌术后早期复发率,延长生存期[27]。但也有研究[28]认为,两种术式均具有较明显的手术应激,对免疫功能的影响及是否影响复发转移等尚存争议。本研究中,两组近期复发率(10.00%vs.17.65%)、生存率(96.67%vs.94.12%)比较差异均无统计学意义,这与研究样本较小及随访时间尚短有关,尚需进一步大样本、延长随访时间观察。但综合本研究结论,LUS 下腹腔镜左半肝切除术仍有望保护残肝功能,或有望降低近期复发风险,临床可根据患者的一般情况,结合术前评估等筛选适宜病例开展LUS 下腹腔镜手术治疗[29-30]。此外,本研究纳入的案例较少,进一步的研究有必要增加样本量,同时延长随访时间来评估LUS 下腹腔镜左半肝切除术治疗PLC 的有效性及安全性。
综上所述,LUS 下腹腔镜左半肝切除术治疗PLC 安全可行,近期疗效确切,不增加手术时间及难度,相反可提高手术操作的精准性,为“精准”肝切除创造有利条件,从而降低术中出血量及肝中静脉损伤,具有推广价值。
